医学におけるFrontiers
はじめに
直腸癌は、世界的に最も一般的な悪性腫瘍の1つです(1)。 米国がん合同委員会(AJCC)病期分類システムによると、原発腫瘍(T期)の解剖学的範囲は最も重要な予後予測因子の1つです。 ただし、直腸癌の同じtの段階の患者はかなり異なった臨床転帰を示すかもしれません。
1965年に初めて報告された癌胎児抗原(CEA)は、180-200kDaの糖タンパク質であり、免疫グロブリンスーパーファミリーのメンバーである(2)。 CEAは、結腸直腸癌(の90%を含む固形腫瘍の様々なによって分泌される3)。 結腸直腸癌における単一の最も重要で信頼性の高い血清予後バイオマーカーとして、上昇した術前CEAレベルは、結腸直腸癌(4-9)の予後不良と関連していることが判明している。
これまでの研究では、CEAが結腸直腸癌における癌細胞接着および自然免疫と関連していることが実証されている。 さらに、CEAは、結腸直腸癌細胞の転移部位への付着を促進し、腫瘍進行を支持することも報告された(1 0−1 2)。
伝統的に、腫瘍細胞の遠隔広がりは後期事象と考えられてきたが、いくつかの以前の研究の知見は、転移性の可能性の獲得が腫瘍進行の非常に早い段階(13-16)で起こる可能性があることを示した。 Wo et al. (17)は、リンパ節陽性に関与する非常に小さな腫瘍サイズが積極的な生物学の代理である可能性があることを報告した。 血清CEA上昇を伴う非常に早期の直腸癌は転移能の早期獲得を示唆し,直腸癌の非常に貧しい生存を予測することができると考えた。
しかし、我々の知る限りでは、直腸癌の予後を決定する際のT期と血清CEAレベル(C0およびC1)の関連を調査する研究はほとんど報告されていない。 したがって、我々は血清CEA上昇のコンテキストで非常に初期のT段階は、生物学的に攻撃的な疾患の代理であり、直腸癌の貧しい原因特異的生存(CSS)を予 我々の研究に対するリンパ節陽性の影響を除去するために、我々はその後、ノード陽性患者を除外し、ステージI-II患者に分析を焦点を当てた。
患者と方法
Surveillance,Epidemiology,and End Results Database
米国における癌発生率と生存に関する権威ある情報源であり、Surveillance,Epidemiology,and End Results(SEER)参加地域で発生した新たに診断された癌症例を含む集団ベースの情報の包括的な情報源として、SEERデータベースはアメリカの人口の約28%を網羅している。 SEERデータベースには識別子が含まれておらず、研究者に公開されていました。 SEER*Statは、オンラインアクセスを使用して患者情報を取得するためにSEERプログラムによって提供されるソフトウェアです。 まず、SEER*Statソフトウェア(SEER*Stat8.3.5)の症例リストセッションを使用して、すべての患者関連情報をリストし、January1、2004、December31、2015の間にステージI-II(ノード陰性)直腸癌と診断された患者をSEERデータベースから同定した(図1)。 直腸癌患者は、ICD-O-3部位コードC199およびC209および行動コード3(NAACCR項目522および523)によって同定された(9)。 術前血清CEAの情報は2004年から記録され、SEERのフォローアップは2015年に終了したため、これらの年を含めることにしました。

図1. 患者コホート定義のフローチャート。
その後、ネオアジュバント放射線療法、陽性の組織学的確認の欠如、未知の人種、非腺癌組織学、または積極的なフォローアップを受けたものは、我々の研究から除外された。 利用可能な術前血清CEAレベルを有する患者は、我々の研究に含まれており、我々は”陽性/上昇”と”陰性/正常”をグループ化しました; 通常の範囲内では、”C1およびC0(C段階情報)として。 CEAのカットオフ値は、それぞれ、非喫煙者のための2.5ng/mlと喫煙者のための5ng/mlであった。 さらに、以下の患者の臨床病理学的変数もSEERデータベースから検索された:Tステージ、人種、性別、腫瘍の位置、診断時の年齢、診断年、グレード、および組織学。
統計分析
本研究では、Pearsonのカイ二乗検定を使用して、SEERデータベースから取得したすべての患者の臨床病理学的変数を、術前の血清CEAレベルの正常 いくつかの多変数Cox比例ハザードモデルは,直腸癌の独立した予後変数を同定するために構築された。 生存曲線をKaplan–Meier法を用いて生成し,曲線間の差を対数ランク検定によって解析した。 本研究で関心のある主要な結果は、CSSおよび全生存率(OS)であった。 CSSは、診断日から癌特異的死亡日まで計算した。 直腸癌に起因する死亡は事象として扱われ、他の原因による死亡は死亡日に検閲された観察として扱われた。 CSSを予測する際に術前血清CEAレベルとTステージとの間に有意な相互作用があったかどうかを決定するために,相互作用変数(Tステージと血清CEAレベル)も定義した。 両面P<0.05は統計的に有意であると考えられた。 統計分析は、主に、SPSSバージョン2 2(IBM Corporation,Armonk,NY,USA)を使用して行った。
結果
患者の特徴
全体として、19,184人のステージi–II直腸癌患者と診断された患者が、1月、2004年からDecember31、2015年の間にSEERデータベースから同定された(図1)。 これらの患者のうち、13,007人(67.8%)の患者がC0期に割り当てられ、6,177人(32.2%)の患者がC1期に割り当てられた。 AJCCステージングシステムは、6,077人の患者がT1期、4,783人の患者がT2期、7,021人の患者がT3期、1,303人の患者がT4期であることを示唆した。 合計2,560人(13.3%)の患者がフォローアップ時間の終わりに直腸癌で死亡した。 コホート全体のフォローアップ時間の中央値は44ヶ月(0-143ヶ月)であった。 患者のベースライン特性を表1に要約する。
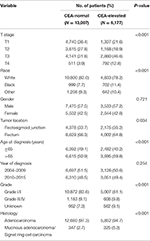
表1. I–II期直腸癌のベースライン特性を血清癌胎児抗原(CEA)レベルで比較した。
血清CEA上昇の文脈で他のT期と比較してT1期のリスクが改善された
C1期は、より高いT期、黒色、直腸sigmoid接合部、高齢、高悪性度、および粘液性腺癌/印環細胞癌と相関する可能性が高いことが判明した(表1、P<0.05)。 表2に示すように、人種、性別、腫瘍の位置、診断時の年齢、診断年、グレード、組織学、T期、および血清CEAレベルを多変量Cox分析に含めた。 多変量Cox分析を行ったとき、我々はステージI–II直腸癌における独立した予後因子として、以下の臨床病理学的特性を確信した;これらは、人種、性別、腫瘍の位 これは、血清CEA上昇の文脈では、T1ステージは、ステージT2およびT3と比較して直腸癌特異的死亡率の予想外の高いリスクを提示し、ことが示された。 ステージT1疾患では、血清CEAのレベルの上昇は、血清CEAの正常なレベルと比較して死亡率の227.6%のリスクの増加と関連していた。

表2. ステージI-II直腸癌における原因特異的生存(CSS)の多変量Cox回帰分析。
Kaplan–Meier生存曲線を図2、3にプロットします。 5年CSS率は、T1C0で92.2%、T1C1で75.2%、T2c0で93.1%、T2C1で86.7%、T3C0で84.6%、T3C1で76.3%、T4c0で62.9%、T4c1で43.6%であった(図2、P<0.001)。 したがって、T1C1はT3c1と比較して同様の5年CSS率を示しました(75.2対76.3%、P=0.238)。 さらに、この発見はOSでさらに顕著であった。 5年OS率は、T1C0で78.6%、T1C1で48.3%、T2C0で77.1%、T2C1で62.3%、T3C0で68.5%、T3C1で54.5%、T4C0で45.3%、T4C1で30.0%であった(図3、P<0.001)。 T1C1はt3c1と比較して有意に低い5年CSS率を示した(48.3対54.5%、P<0.001)。
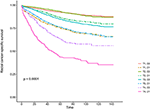
図2. Tステージのkaplan–Meier原因特異的生存(CSS)曲線と血清癌胎児抗原(CEA)レベルを組み合わせた。
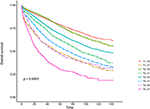
図3. T期のkaplan–Meier全生存率(O s)曲線と血清癌胎児抗原(CEA)レベルを組み合わせた。
T期における術前血清CEA上昇の影響
森林プロットを描き、それぞれのt期における正常CEA群と上昇CEA群のcssを比較するハザード比(HRs)を示した(図4)。 血清CEAの正常レベルと比較して、ステージT2では、血清CEAのレベルの上昇は、直腸癌特異的死亡率の69.0%のリスクの増加と関連していた;ステージT3では、血清CEAのレベルの上昇は、直腸癌特異的死亡率の67.2%のリスクの増加と関連していた(HR=1.672、95%CI=1.486-1.882、P<0.001);ステージT4では、血清CEAのレベルの上昇は、直腸癌特異的死亡率の81.3%のリスクの増加と関連していた。直腸がん特異的死亡のリスク(hr=1.813、95%ci=1.485-2.213、P<0.001);対照的に、ステージT1では、血清ceaのレベルの上昇は211までであった。直腸がん特異的死亡のリスクは6%増加した(HR=3.116、95%CI=2.639-3.679、P<0.001)。
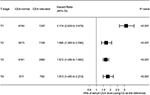
図4. T期による血清癌胎児抗原(CEA)の正常レベルと上昇レベルとの間の原因特異的生存(CSS)のハザード比(HRs)。
ディスカッション
我々は、直腸癌のCSSを決定する際にT期と血清CEAレベルの関連を調査することを目的としました。 我々は、非常に初期のTステージ(ステージT1)と血清CEA上昇と直腸癌は、このように貧しい腫瘍学的転帰を予測し、積極的な疾患のための生物学的サロゲートであ 私たちの研究には、i–II期直腸癌と診断された〜20,000人の患者が含まれています。
本研究では、血清CEA上昇は、より高いT期、黒色、直腸sigmoid接合部、高齢、およびより高い悪性度および粘液性腺癌/印環細胞癌と相関する可能性が高いことが カプラン-マイヤー生存分析は、血清CEA上昇の文脈では、ステージT1の5年CSS率は、ステージT3(76.3%)との統計的差を達成しなかった75.2%であった、ことを示した。 それは全生存に来るとき、術前の血清CEA上昇(48.3%)とステージT1の5年OS率は、CEA上昇(54.5%)に関与するステージT3よりもさらに低く、ステージT4(45)から統計的3%)、CEAの上昇術前血清レベルを意味するいくつかのステージT3疾患と比較して同様のCSSといくつかのステージT4疾患と比較して同様のOSとステージT1直腸癌のサブグループを識別することができます。
既知の直腸癌予後因子(人種、性別、腫瘍の位置、診断時の年齢、診断年、グレード、組織学)を調整した後、我々が定義した相互作用変数(T期および血清CEAレベル)は、直腸癌の独立した予後因子であることが示された。 多変量Cox分析は、血清CEA上昇の文脈では、T1ステージは、ステージT2およびT3と比較して直腸癌特異的死亡率の予想外の高いリスクを提示し、ことを示 ステージT1疾患では、血清CEAのレベルの上昇は、血清CEAの正常なレベルと比較して死亡率の227.6%のリスクの増加と関連していた。 さらに、人種、性別、腫瘍の位置、診断時の年齢、および腫瘍のグレードはまた、ステージI–II直腸癌の独立した予後因子として同定された。 T1とは別に、術前の血清CEA上昇は、それぞれのT段階で直腸癌特異的死亡率の-75%高いリスクを提示したが、その数はT1段階で211.6%に大幅に増加した。
2000年、AJCCの結腸直腸ワーキンググループは、従来のAJCC TNM病期分類システムにCEAの血清レベル(c期)を含めることを提案した(18)。 さらに、米国臨床腫瘍学会および腫瘍マーカーに関する欧州グループは、結腸直腸癌における予後ツールとして術前血清CEAレベルの包含を支持している(19-21)。
いくつかの以前の研究では、血清CEAレベルが結腸癌における強力な予後の役割として報告されていた(4-7,22-26)。 2011年には、Thirunavukarasu et al. (25)術前血清CEAレベルは結腸癌の独立した予後バイオマーカーであり、予後はより高い段階の低CEA患者と比較して低段階の高CEA患者で悪化したことを報 その研究では、高いCEAは、結腸癌の悪い腫瘍学的転帰を予測するための節陽性と同じくらい強いとさえ考えられた。
まだ、直腸癌における血清CEAレベルの予後的役割の解明に焦点を当てた研究はほとんどない。 2016年には、SEERデータベースを使用して、Tarantino et al. (9、27)は、術前の血清CEAのレベルの上昇は、直腸癌における全体的な悪化と癌特異的生存の強い予測因子であったという説得力のある証拠を提供し、二つの大 2018年、Liu et al. (8)は、術前血清CEAが直腸癌の独立した予後因子であることを示し、血清CEAレベルの上昇は、i〜IV期の正常血清CEAレベルと比較して明らかに生存率が悪いことを示した。しかし、術前血清CEAレベルの予後の役割を調査することに焦点を当てた以前の2つの研究だけでは、直腸癌の腫瘍転帰を予測する上でCEAレベルとt期の関連を調べなかった。
従来の研究では、がんが大きなサイズに成長するにつれて転移電位を段階的に獲得することが示されていましたが(28)、以前の研究では、転移電位の獲得は腫瘍の進行の非常に早い時期に起こる可能性があることが示されていました。 以前の研究では、リンパ節陽性に関与した場合、非常に小さな腫瘍サイズの非常に悪い生存を示した(17)。 さらに、我々の研究の知見は、非常に初期の段階(ステージT1)直腸癌における術前血清CEAレベルの上昇は、非常に貧しいOSとCSSと関連しており、積極的な生物学の代理である可能性があることを示している。 リンパ節の関与と血清CEA上昇の両方が転移能力の獲得と考えられると考えられた。 本発明者らの研究は、Woらの研究と組み合わせたものである。 転移能の獲得は、腫瘍進行の非常に早い段階で起こり得るため、腫瘍学的転帰が不十分であり、初期の生物学的特徴は、蓄積された転移能力ではなく、癌進行中の遠隔metastasisの可能性を決定する可能性が高いという前述の考えを一貫して支持している(29)。
さらに、私たちの研究の知見は臨床的意義があります。 現在、i期直腸癌は、比較的良好な腫瘍学的転帰のために根治的外科的切除のみで治療されている。 しかし、患者の約10-15%が根治的切除後に腫瘍再発を発症する(30、31)。 本研究では、我々は術前の血清CEA上昇の関与を持つそれらのステージT1直腸癌が腫瘍学者のより多くの注目を集めるべきであることを意味し、ステージI
しかし、我々の研究には二つの制限があります。 一方,本研究では,seerデータベースから入手できず,ある程度バイアスを導入する可能性のあるマイクロサテライト不安定性状態および術後合併症を含む直腸癌の既知の予後因子は含まれていなかった。 両方のグループでCEAの範囲と平均値を提供することはできません。 一方、本研究は、将来のデータに基づくのではなく、遡及的であった。 したがって、我々の調査結果は、特に大規模な前向き臨床研究では、他のコホートでも検証する必要があります。
結論として、我々の研究は、術前の血清CEA上昇に関与する場合、ステージT1直腸癌は、生物学的に攻撃的な疾患の代理であり、好ましくないOSおよびCSSと相関 さらに、直腸癌のこのサブグループは、腫瘍学者のより多くの臨床的注意に値する。 我々の知見は、将来のデータベース研究で検証された場合、早期直腸癌のための新しい治療法のアイデアを提供するだろう。
データ利用可能性に関する声明
この研究のために生成されたデータセットは、対応する著者の要求に応じて利用可能です。
倫理声明
本研究の患者はSEERデータベースから特定され、SEERプログラムに提出された要求によってデータの使用承認が得られました。 SEERデータベースが公開されているため、機関審査委員会の承認は必要ありませんでした。
著者の貢献
SWとWGはこの研究に実質的かつ直接的な貢献をし、提出を承認しました。
利益相反
著者らは、この研究は潜在的な利益相反と解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言している。
謝辞
この作業は、塩城市の医療科学技術開発計画プロジェクト(YK2015075)によって一部支援されました。
1. Bray F、Ferlay J、Soerjomataram I、Siegel RL、Torre LA、Jemal A.グローバルがん統計2018:GLOBOCANは、185カ国で36のがんの発生率と死亡率を世界的に推定しています。 CA Cancer J Clin. (2018) 68:394–424. ドイ:10.3322/caac.21492
PubMed要約/CrossRef全文/Google Scholar
2. ゴールドP、フリードマンそう。 免疫学的耐性および吸収技術によるヒト結腸癌における腫瘍特異的抗原の実証。 J Exp Med. (1965) 121:439–62. ドイ:10.1084/jem.121.3.439
PubMed要約/CrossRef全文/Google Scholar
3. ゴールドスタインMJ,ミッチェルEP. 結腸直腸癌患者の病期分類およびフォローアップにおける癌胎児抗原。 がん投資。 (2005) 23:338–51. 土井:10.1081/CNV-58878
PubMed要約/CrossRef全文/Google Scholar
4. Becerra AZ,Probst CP,Tejani MA,Aquina CT,González MG,Hensley BJ,et al. 結腸癌患者における術前癌胎児抗原レベルの上昇の予後的役割の評価:national cancer databaseからの結果。 アン-サーゴル (2016) 23:1554–61. 10.1245/10434-015-5014-1
PubMed Abstract|CrossRef全文|Google Scholar
5. 緒方Y,村上H,笹冨T,石橋N,森S,牛島M,et al. 術前血清カルチノエンブリオン抗原レベルの上昇は,ii期結腸癌の治癒可能性のある切除後に補助化学療法を必要とするための有効な指標となる可能性がある。 J-サーグ-オンコル (2010) 99:65–70. doi:10.1002/jso.21161
PubMed要約/CrossRef全文/Google Scholar
6. Quah HM,Chou JF,Gonen M,Shia J,Schrag D,Landmann RG,et al. アジュバント療法のためのハイリスクII期結腸癌患者の同定。 Dis結腸直腸。 (2008) 51:503–7. 土井:10.1007/10350-008-9246-z
PubMed要約/CrossRef全文|Google Scholar
7. スピンドラー BA、Bergquist JR、Thiels CA、Habermann EB、Kelley SR、Larson DW、et al. CEAの結合は段階IIの結腸癌の危険の層別化を改善する。 J胃腸外科(2017)21:770-7. 土井:10.1007/s11605-017-3391-4
PubMed Abstract|CrossRef全文|Google Scholar
8. 劉Q、リアンP、羅D、蔡S、李Q、李X。 直腸癌における癌tnm病期分類システムに関するアメリカ合同委員会と癌胎児抗原の組み合わせ:現実世界と大規模な人口ベースの研究。 OncoはTherをターゲットにしています。 (2018) 11:5827–34. ドイ:10.2147/OTT.S171433
PubMed要約/CrossRef全文|Google Scholar
9. タランティーノI,Warschkow R,Schmied BM,Güller U,Mieth M,Cerny T,et al. I期直腸癌における生存のためのCEAの予測値:人口ベースの傾向スコアマッチ分析。 J胃腸外科(2016)20:1213-22. 土井:10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. がん遺伝子 (2013) 32:849–60. ドイ:10.1038/onc.2012.112
PubMed要約/CrossRef全文/Google Scholar
12. Cai Z、Xiao J、He X、Ke J、Zou Y、Chen Y、et al. 腫瘍切除を受けている結腸直腸癌における術前癌胎児抗原の新しい予後の重要性にアクセスする:陽性および陰性よりも多い。 がんバイオマーク。 (2017) 19:161–8. doi:10.3233/CBM-160287
PubMed要約/CrossRef全文/Google Scholar
13. Engel J,Eckel R,Kerr J,Schmidt M,Fürstenberger G,Richter R,et al. 乳癌のための転移のプロセス。 ユーロJがん。 (2003) 39:1794–806. ドイ:10.1016/S0959-8049(03)00422-2
PubMed Abstract|CrossRef全文|Google Scholar
14. Hüsemann Y,Geigl JB,Schubert F,Musiani P,Meyer M,Burghart E,et al. 全身の広がりは乳癌の早いステップである。 癌細胞。 (2008) 13:58–68. 土井:10.1016/j.ccr。2007.12.003
PubMed抄録/CrossRef全文/Google Scholar
15. Podsypanina K,Du YC,Jechlinger M,Beverly LJ,Hambardzumyan D,Varmus H. 肺における未変換マウス乳腺細胞の播種および増殖。 科学だ (2008) 321:1841–4. 土井:10.1126/科学。1161621
PubMed要約/CrossRef全文/Google Scholar
16. Schmidt-Kittler O,Ragg T,Daskalakis A,Granzow M,Ahr A,Blankenstein TJ,et al. 潜伏播種細胞から明白な転移へ:全身性乳癌進行の遺伝子解析。 プロック-ナトルAcad Sci USA. (2003) 100:7737–42. ドイ:10.1073/pnas.1331931100
PubMed要約/CrossRef全文/Google Scholar
17. Wo JY,Chen K,Neville BA,Lin NU,Punglia RS. 結節陽性乳癌における癌特異的死亡率に対する非常に小さな腫瘍サイズの影響。 Jクリン-オンコール (2012) 23:32–3. 土井:10.1016/j.breastdis.2012.01.026
クロスリファレンス全文/Google Scholar
18. コンプトンC、フェノグリオ-プレイザー CM、ペティグルー N、フィールディングLP。 がん予後因子に関するアメリカ合同委員会コンセンサス会議:結腸直腸ワーキンググループ。 がんだ (2015) 88:1739–57. 土井:10.1002/(SICI)1097-0142(20000401)88:7<1739::AID-CNCR30>3.0.CO;2-T
PubMed要約/CrossRef全文|Google Scholar
19. Duffy MJ,van Dalen A,Haglund C,Hansson L,Holinski-Feder E,Klapdor R,et al. 結腸直腸癌における腫瘍マーカー:腫瘍マーカーに関する欧州グループ(EGTM)臨床使用のためのガイドライン。 ユーロJがん。 (2007) 43:1348–60. 土井:10.1016/j.ejca.2007.03.021
Pubmed要約/CrossRef全文/Google Scholar
20. Locker GY,Hamilton S,Harris J,Jessup JM,Kemeny N,Macdonald JS,et al. ASCO2006胃腸癌における腫瘍マーカーの使用に関する推奨事項の更新。 Jクリン-オンコール (2006) 24:5313–27. 土井:10.1200/JCO.2006.08.2644
Pubmed抄録/クロスリファレンス全文/Google Scholar
21. Duffy MJ,Lamerz R,Haglund C,Nicolini A,Kalousová M,Holubec L,et al. 結腸直腸癌、胃癌および胃腸間質癌における腫瘍マーカー:腫瘍マーカーに関する欧州グループ2014ガイドラインの更新。 Int J Cancer. (2014) 134:2513–22. 土井:10.1002/ijc.28384
PubMed要約/CrossRef全文/Google Scholar
22. ハリソン-ル、ギレムJG、パティP、コーエンAM。 術前のcarcinoembryonic抗原はノード陰性の結腸癌患者の転帰を予測する:572人の患者の多変量解析。 J Am Coll(1997)185:55-9. 土井:10.1016/S1072-7515(97)00012-4
PubMed Abstract|CrossRef全文|Google Scholar
23. ハァッJW、Oh BR、キムHR、キムYJ。 治癒可能性のある結腸癌における独立した予後因子としての術前の癌胎児抗原レベル。 J-サーグ-オンコル (2010) 101:396–400. doi:10.1002/jso.21495
PubMed要約/CrossRef全文/Google Scholar
24. 小澤H,小竹K,保坂M,平田A,中川Y,藤田S,et al. 結腸癌の予後グループ化システムへの血清carcinoembryonic抗原レベルの取り込み。 Int J Colorect Dis. (2017) 32:1–9. ドイ:10.1007/s00384-017-2772-1
PubMed Abstract|CrossRef全文|Google Scholar
25. Thirunavukarasu P,Sukumar S,Sathaiah M,Mahan M,Pragatheeshwar KD,Pingpank JF,et al. 結腸癌におけるC期:ステージング、予後、および管理におけるcarcinoembryonic抗原バイオマーカーの意味。 Jナトル癌Inst. (2011) 103:689–97. doi:10.1093/jnci/djr078
PubMed要約/CrossRef全文/Google Scholar
26. Margalit O,Mamtani R,Yang YX,Reiss KA,Golan T,Halpern N,et al. I期およびII期結腸癌における癌胎児抗原レベルの予後値を評価する。 ユーロJがん。 (2018) 94:1–5. 土井:10.1016/j.ejca.2018.01.112
PubMed要約/CrossRef全文/Google Scholar
27. タランティーノI,Warschkow R,Worni M,Merati-Kashani K,Köberle D,Schmied BM,et al. 術前CEAの上昇は、i-III期直腸癌患者の生存率の悪化と関連している。 Br J Cancer. (2012) 107:266. ドイ:10.1038/bjc.2012.267
PubMed要約/CrossRef全文/Google Scholar
28. Norton L,Massague J.がんは自己播種の病気ですか? ナットメッド (2006) 12:875–8. 土井:10.1038/nm0806-875
PubMed要約/CrossRef全文/Google Scholar
29. Yu KD,Jiang YZ,Chen S,Cao ZG,Wu J,Shen ZZ,et al. ノード陰性乳癌における癌特異的死亡率に対する大きな腫瘍サイズの影響。 マヨ-クリン-プロク… (2012) 87:1171–80. 土井:10.1016/j.mayocp.2012.07.023
Pubmed抄録/CrossRef全文/Google Scholar
30. Blumberg D,Paty PB,Picon AI,Guillem JG,Klimstra DS,Minsky BD,et al. I期直腸癌:高リスク患者の同定。 J Am Coll(1998)186:574-9; 579-80 土井:10.1016/S1072-7515(98)00018-0
PubMed Abstract|CrossRef全文|Google Scholar
31. Gunderson LL,Sargent DJ,Tepper JE,Wolmark N,O’Connell MJ,Begovic M,et al. アジュバント直腸癌における生存および再発に対するTおよびN期および治療の影響:プールされた分析。 Jクリン-オンコール (2004) 22:1785-96. 土井:10.1200/JCO.2004.08.173
PubMed Abstract|CrossRef Full Text|Google Scholar