塩化物イオンチャネルと輸送体:自然の好奇心と人間の病気の源から薬物標的まで
投稿日:20か月前投稿者:2013 | |
受容体、接着タンパク質、イオンチャネル、イオンポンプ、イオン輸送体:初期の学部教育では、学生は一体膜タンパク質の様々なタイプに導入されています。 彼らは研究を進めるにつれて、離散的な遺伝子ファミリーとタンパク質構造がこれらの異なるタンパク質クラスに関与しており、特定のタンパク質を適切なタンパク質クラスに割り当てる際にあいまいさがある可能性があると考える理由は決してないことを発見した。
これは、教室から研究室まで、塩化物チャネルを考慮するまで、事実上すべてのケースを満たします。 私たちは、それらが存在し、重要であり、いくつかの疾患領域で良好な薬物標的を作るかもしれないことを知っていますが、最近まで、治療法の世界ではやや汚名を着せられ、流行していませんでした。 選択的配位子の欠如は全く助けにはならなかった。 これに対する唯一の例外は、抑制性神経伝達物質GABAの結合時に開く内因性塩化物チャネルに結合されるGABA-a受容体であった。 ベンゾジアゼピンは、バリウムが1960年代に利用可能になって以来、この受容体を増強しており、鎮静作用および抗けいれん作用を提供している。 これは重要な概念を導入する:塩化物チャネルであると記述することができる複数の遺伝子家族および異なった蛋白質のタイプがある。
これは、カリウム、ナトリウム、またはカルシウムに対して選択的な孔を形成することができるタンパク質構造に柔軟性がほとんどない陽イオン選択的イオンチャネルについて理解していることとは対照的である。 他のハロゲン化物や小さなアニオンの膜輸送にはほとんど生理学的役割がないため、アニオンチャネルが塩化物選択性を示すべき生理学的理由はあまりないようである。 一方、カリウム、ナトリウム、カルシウムの膜電流はそれぞれ異なる基本的な役割を果たしており、これらの陽イオンに対する選択的な膜透過性は、細胞機能と実際には生命そのものにとって重要である。
GABA-a受容体は、cysループ五量体リガンドゲートイオンチャネルファミリーのメンバーであり、いくつかのタイプの興奮性および抑制性神経伝達物質ゲートチ 嚢胞性線維症膜貫通レギュレータ(CFTR)タンパク質は、ヌクレオチド調節塩化チャネルである。 それは多様なATP結合カセット(ABC)の運送者家族のメンバーで、膜を渡る基質を運ばないようでが塩化物チャネルとしてむしろ作用する唯一のものです。 電圧ゲート塩化物チャネルのCLCファミリーは、別の異なる遺伝子ファミリーから発生し、膜タンパク質の中でユニークな一般的な構造を持っています。 このタンパク質ファミリーは、過去30年間で多くの驚きをもたらしており、このファミリーのメンバーは、ここで紹介され、また、それらが薬物標的と考えら
塩化物チャネル分野からの他の刺激的な開発はカルシウム活動化させた塩化物(ClCa)チャネルの基礎となる蛋白質の分子同一証明に続いて現れた。 機能的には、我々はしばらくの間、彼らの生理学的役割について知っていたが、チャネルタンパク質の最近の分子同定は、その活性をプローブし、変更する このレビューでは、ClCaチャネルとCLCタンパク質を標的とすることの薬理学的可能性に焦点を当てています;それらの機能と細胞内局在化は、図1に要約されています。
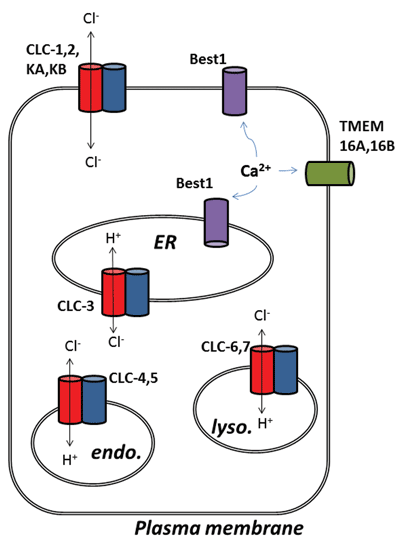
フィギュア1
CLCタンパク質の紹介
このタンパク質ファミリーの九つのメンバーは、CLC-1-7、CLC-KAおよびKBである。 創始者メンバーであるCLC−1は、骨格筋の電圧ゲート塩化物チャネルであり、以下に議論される。 多くの機能的研究は、光線がその水生犠牲者を気絶させることを可能にするElectroplax電気器官から単離されたCLC-0の名誉称号を持つ同族体について行われている。 脂質二重層へのCLC-0の再構成と単一イオンチャネルを流れる電流の電気生理学的記録は、興味深い特性を明らかにした。 通常、単一のイオンチャネルを含む膜の小さなパッチからの電流を記録するとき、一つは二つの電流振幅の間の変動を観察する:一つは閉じたチャネ ゆらぎは開状態と閉状態の間の遷移を反映している。 しかし、CLC-0では、単一のイオンチャネルタンパク質が独立して開くことができる二つの同等の細孔から構成されていることが明らかであった1。 したがって、このチャネルは二重バレルであると記述されていました(図2)。 したがって、腸内細菌からの相同体の結晶構造が、タンパク質複合体が二量体であり、各サブユニットがイオン伝導経路を有することを明らかにしたことは大きな驚きではなかった2(図2)。
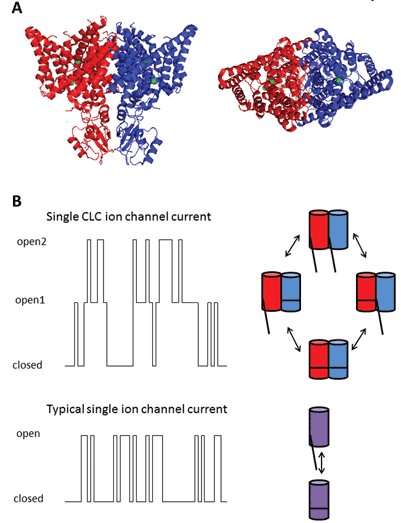
フィギュア2
大腸菌由来のCLC-ec1について詳細な機能実験を行ったときに第二の驚きが生じた。 Clc-ec1は、脊椎動物の骨格筋における長い間失われた親戚のように、塩化物チャネルとして機能するのではなく、厳密な2:1交換化学量論3を有する2cl-/H+交換トランスポーター、またはアンチポーターである3。 この蛋白質は低いph4の腸細菌の存続のために重要で、容認できるレベルで細胞pHを保つために塩化物の勾配を開発するために本当らしいです。 したがって、原核生物のClcは、病原性大腸菌またはサルモネラ感染を治療するための阻害剤の標的となる可能性があります4。 イオン交換挙動の発見は、cl-/H+交換が典型的なCLCsの真の機能であり、塩化物チャネルとして同定されたものは規則の例外である可能性があると仮定して、ほ乳類CLCsにこの塩化物対プロトン交換のいずれかが存在するかどうかを決定するためのさらなる努力を自然に刺激した。 これは、CLC-3からCLC-7までは、主に細胞内オルガネラに存在する2cl–/H+交換トランスポーターとして機能するという強い証拠があるため、CLC-1、CLC-2、KAおよびKBは真の原形質膜塩化物伝導性イオンチャネルである5-9であることが示唆されているためであると思われる。 典型的なCLC特性は交換輸送であり、すべての形態の細胞生命に見られるため、後者のサブクラスのタンパク質である善意の塩化物チャネルは、第二の基質イオンの移動に対する塩化物輸送のカップリングを失った”壊れた”塩化物輸送体と考えることができる。
CLC-1
CLCファミリーの創始者は骨格筋の電圧ゲート塩化チャネルであり、膜電位を調節し、活動電位に続いて膜を再分極して筋肉を弛緩させる役割を果たす。 ほとんどの組織では、カリウムチャネルが心臓および平滑筋においてこの役割を果たし、他の細胞型における膜興奮性を調節することが期待され 横尿細管系は、原形質膜(筋膜)への延長であり、収縮組織に浸透する。 それは筋肉中の電気活動の急速な広がりのために重大で、急速な、管理された収縮を画策します。 T細管の限られたスペースへの筋肉細胞からのカリウムの流出は細胞外のカリウムの集中を上げ、延長された膜の脱分極の原因となるこのイオン傾 塩化物チャネルが優勢な再分極の役割を果たしているので、これは防止される。 CLC-1の機能変異の喪失は、ヒト、ヤギ、およびマウスにおける筋緊張症につながり(最近のレビュー see10)、再分極膜電流の喪失と一致する筋弛緩障害を特徴
骨格筋に限定された発現では、CLC-1は、CLC-1機能を増加または減少させ、それによって筋肉興奮性をそれぞれ減少または増加させることによって筋収縮を制御する薬物の魅力的な標的である可能性がある。 CLC-1機能を増加させる化合物は、特に塩化物チャネル活性の部分的な損失を補うことができる場合には、筋緊張症を治療することができるかもしれ CLC-1の阻害は、筋収縮の閾値を低下させる可能性があり、筋衰弱または筋ジストロフィーなどの変性疾患の場合に有用であり得る。
CLC-2
内向きに整流する塩化物チャネルであるCLC-2は、組織分布がやや広くなっています。 それは神経活動を調節する中枢神経系で見つけることができます11-13。 アストロサイトでは、細胞接合部への細胞内ターゲティングは、グリアカム(MLC1)との相互作用によって調節され、このターゲティングを混乱させ、巨脳性白質脳症を引き起こす変異14。 最近の治療上の関心は、それがそれぞれ、腸および肺分泌物において役割を果たしている腸粘膜および肺細気管支におけるCLC-2発現を伴います。 便秘を緩和するために臨床的に使用される薬物であるLubiprostoneは、CLC-2を活性化することによってその効果を発揮することが提案されたが、この効果は物議 この混合物がある調査のCLC-2チャネルを活動化させる間、他でCLC-2人身売買を調整し、プロスタグランジンの受容器のactivation15、16によってCFTR機能を高めます。 しかし、気道CLC-2機能を増加させることは、嚢胞性線維症における代替の塩化物経路を提供することができるという十分な証拠が残っている17。
CLC-KA/KB
これらの塩化物チャネルは腎上皮で顕著に発現し、受動的塩化物フラックスに対する細胞膜の透過性に寄与する。 それらは、ネフロンの上行肢および遠位尿細管において重要な役割を有し、一次尿から頂端膜を介して輸送された後、塩化物再吸収のための基底外側ルー CLC-KBをコードするCLCKB遺伝子は、バーター症候群の根底にある五つの遺伝子の一つである。 CLC-KBの機能喪失変異は、塩化物の再吸収不良をもたらし、多尿症に関連する塩消耗性障害をもたらす。 CLC-Κ B変異(BARTTER’S type III)の影響を受ける個人の主な特徴の1つは、低血圧です。 この疾患のより深刻な形態は、CLC-KAとKBの両方の血漿膜への輸送に重要な補助タンパク質であるバルティンをコードするBSND遺伝子(Bartter’S TYPE IV)の変異によっ この形態の障害には、感覚性難聴も含まれ、これは、CLC−K aおよびKBの両方の内耳の上皮膜への人身売買の喪失によってもたらされると考えられる。 おそらく、CLC−K aまたはKB活性のいずれかの喪失は、聴覚系によって許容され得るが、両方ではない。 このことは,CLC-K aまたはCLC-Κ bのいずれかに対して選択的な阻害剤,または両方の部分的阻害が,血圧を低下させる可能性のある新規ループ利尿剤として作用し,副作用が少ないことを示唆している。 これは薬理学の調査およびrats20に管理されたとき利尿の効果をもたらした低いmicromolar親和性19の新しい抑制剤の派生物の開発をもたらしました。 一方,CLC-Κ bチャネルを活性化する薬物は,BARTTERのIII型患者における欠陥チャネルの残存活性を増強する可能性がある。
CLC-7
2cl–/H+交換トランスポーターサブクラスのCLC-7は薬物作用の有望な標的であり、その阻害は骨粗鬆症に有益である可能性がある。 もう一度、この徴候はOSTEROPETROSIS21を引き起こすCLC-7の機能損失の突然変異によって引き起こされる人間の病気の観察からの起源を取ります。 この疾患では、破骨細胞による骨のリモデリングが欠損しており、これは酸および酵素分泌の欠損によって引き起こされると考えられている。 これは密な骨をもたらし、CLC-7阻害剤によって再現されれば骨の溶解を減少させ、したがって骨粗鬆症患者の骨格を強化する可能性がある22,23。 概念実証研究では、acidification24の薬理学的阻害または抗体によるCLC-7機能の破壊25は骨吸収を減少させた。 しかし、ヒトおよびマウスの研究では、clc-7機能の欠如は、リソソーム機能の低下のために神経貯蔵および変性障害と関連している可能性があることが示唆されているため、CLC-7阻害は合併症なしではない可能性がある26。
機能喪失ヒト変異-CFTRからの教訓
新規CLC標的薬の治療適応症のいくつかは、CLC機能不全によって引き起こされるものとは異なる、スペクトルの反対側の端にある障害を治療することを目的としていることを考慮することは、この時点で簡単に休止する価値がある。 上記のものに加えて、Dent’s I病は、CLC-5機能の喪失によって引き起こされるX連鎖腎臓病である(最近のレビューについては27を参照)。 すべてはまれな受継がれた無秩序であり、主要な蛋白質の欠陥はターゲット膜に減らされた蛋白質の活動か輸送を含みます。 実際、多くの個々の突然変異は、ER保持およびタンパク質成熟の欠如を引き起こす。 嚢胞性線維症と並行して行うことができ、罹患した個体のほとんどはER保持Δ F508変異を有する。 嚢胞性線維症を治療するための最近および層別化されたアプローチは、変異タンパク質折りたたみ(CF補正)を修正し、/または原形質膜CFTR塩化チャネル(CF増強剤)の活性を増加させるための二重突起攻撃の結果となっている。 成功は蛋白質の生合成または人身売買(例えばG551D)の損失なしでCFTRの活動を減らす突然変異の患者で有効である増強剤class28と浮上していますが、(大部分のケースで要求される)折る矯正剤の有効性は確立されています29残っています29。 CLC機能の喪失に関連する疾患はすべてまれな遺伝的疾患であるが、私たちはいつか筋緊張症、バーター症候群、デント病およびosteopetrosisだけでなく、嚢胞性線維症を治療することができるかもしれない彼らの障害の実際の原因を修正する薬。
カルシウム活性化塩化物チャネル
最後に、多くの細胞型において明確に定義された生理学的役割を有するカルシウム活性化塩化物(ClCa)チャネル この物語には、CLCA、Bestrophin、Tweety、TMEM16遺伝子ファミリーのメンバーである四つのタイプのタンパク質が含まれています。 すべての場合において、それらの組換え過剰発現は、細胞内カルシウム濃度を上昇させ、様々な程度に、膜脱分極によって刺激される膜塩化物電流の生成 CLCAの旅は、これが分泌されたタンパク質であることが判明したときに終わりましたが、発現系に内在するClCaチャネルの膜発現を上方制御する可能性 TweetyとBestrophinタンパク質は、主要な組織で研究されているClCaチャネルのすべての特性を示すわけではありませんが、Best1は感覚ニューロンにおけるClCaの成分に関与しているように見えます31そしてまた、小胞体からのカルシウム放出の重要な調節因子であるかもしれません32,33。 三つの独立した研究では、カルシウム活性化塩化物チャネル34-36の主要成分の候補としてTMEM16A(Ano1とも呼ばれる)が提案された。 分子ツールの生成によって促進された多くのその後の研究は、これを支持してきた。 TMEM16Aは血管平滑筋における膜興奮性を調節するために重要であり、肺高血圧症の動物モデルではアップレギュレートされ、チャネル阻害によってトーンを減少させることができる37,38。 感覚ニューロンでは、TMEM16Aは膜のhyperexcitabilityに炎症性メディエーターの存在を結合し、TMEM16Aの阻止はantinociceptive効果を持っています39。 喘息の動物モデルでは、この特定の塩化物チャネルの発現が増加し、その阻害は有益な効果を有する可能性がある40。 また、腸のカハールの間質細胞にも見られ、腸壁の平滑筋のリズミカルな収縮にはチャネル機能が必要である41。 さらに、TMEM16Aの活性化は、嚢胞性線維症における上皮塩化物分泌のための代替経路を提供する可能性がある42。 TMEM16ファミリーの残りの部分の正確な機能を取り巻くいくつかの議論がまだありますが、ClCa機能はまた、嗅覚有毛細胞におけるClCaチャネルの根底にあると考えられているTmem16B(Ano2)に帰されています43、44。 癌細胞生物学におけるこのクラスのイオンチャネルにも役割があり、その阻害は細胞増殖を妨げる可能性がある45-48。
おわりに
このレビューでは、塩化物伝導または輸送タンパク質の多様な役割と、その機能不全が動物モデルにおけるヒトの障害または疾患様症状にどのように結合されるかを強調している。 塩化物チャネルおよび輸送体の膜輸送を阻害、活性化または改善する薬理学的試薬の深刻な欠如がある。 嚢胞性線維症におけるCFTRの欠陥のある機能を逆転させる薬剤が進歩しており、これはうまくいけば、異なるタイプの遺伝性変異に特異的な薬剤をも TMEM16Aカルシウム活性化塩化物チャネルの阻害剤および活性化剤42、49は有用な実験室ツールを証明しており、新しい化合物は、特に組織特異的効果を 特定のClcに特異的な分子は、おそらく最もとらえどころのないです。 電圧ゲートCLC活性化50の構造的基礎を理解することは、合理的な構造ベースの薬物設計によって標的とされるタンパク質ドメインを同定する可能性が このようなツールは、ここでレビューされ、提示された新しい治療アイデアのいくつかをテストに入れることを可能にします。
著者略歴

ジョン-リッピアット博士は、レスター大学でカリウムチャネルの構造、機能、薬理学に関する博士号を取得しました。 オックスフォード大学で膵β細胞機能と糖尿病を学び、その後リーズ大学で薬理学の講師に就任した。 彼の研究は、いくつかの異なるタイプのイオンチャネルおよびトランスポーターの構造的および生理学的特性およびそれらの新しい薬理学的試薬によ
号
号4 2013
関連トピック
塩化物チャネル、薬物標的、イオンチャネル