実質細胞に対する同族抗原の関与は、CD8+t細胞増殖をin situで刺激する
- 同族CD8+T細胞は、LNおよび炎症組織
- CD8+t細胞は炎症部位で増殖する<9 7 9 7><2 6 3 9>予想されるように、移植片部位を排出する腎LNにおいて、強力なOT−i応答が最初に検出され、これは、OVA抗原の存在に依存していた(図1 0)。 1a、b)。 移植後3日で、分割されたOT-Iは、B6を排出するLNsで検出することができた。②膵島移植(図1) た(図1A)。 1b、平均=9.2×104)。 対照的に、100倍少ない分割されたOT-I細胞は、B6内で検出することができました。①移植片(図1-2) 1a,b,平均=6.6×102)。 分割されたOT−i細胞の数は、移植片部位で3日目から6日目まで3 0 0倍に増加した(図1 0A)。 1×105、P<3545>0.0001、ウェルチの補正を伴う対のない両側t検定)であったが、LNの増加はなかった(図1b)。 1b)。 B6のOT-I応答。σ ova移植片はLNで増殖したOT-i細胞の浸潤によって説明できた。 しかし、CFSEプロファイルは、移植片のOT-I細胞が6日目にLNの細胞よりも高度に分割されたため、移植片とLN部位の間で異なっていた(図10B)。 1a)。 この違いについては、少なくとも二つの可能な説明があります。 何度も分裂した細胞のみが移植片に浸潤した。 あるいは、移植片に到達する細胞は、より迅速に分割され、おそらく利用可能な抗原の豊富さに起因する。 6日目のLNと比較して移植片の絶対細胞数の増加は、この後者の説明を調査するために私たちを導いた。 島との同族の相互作用は拡大を促進する
- 常在白血球との同族の相互作用は必要ない
- 実質細胞との同族の相互作用は重要である
- t細胞は炎症部位で増殖する
- 実質細胞との同族の相互作用は増殖を駆動する
- IL−2は炎症部位でより重要である<9 7 9 7><2 6 3 9>本発明者らは、IL−2R a発現が、cd8+t細胞の増殖および末梢実質(膵島移植片)内での蓄積に対して、lnの排液中のプライミング部位内と比較してより重要であることを示した(図1)。 7a)。 さらに,プライミングサイトから離れた第二のサイト,すなわち非排水LNにおける応答を解析した。 OT−Iマウス由来のCTV標識CD8+t細胞を、B6.CD4 5.1宿主マウス(CD4 5.2+、IL−2R A−CD4 5.2+)およびOT−i/Ly5.1(IL−2R A+、CD4 5.1+CD4 5.2+)に同時移入した。1+)B6の単一の接木を受け取る前。ソヴァ島。 移入されたT細胞集団のそれぞれの別個のCD4 5対立遺伝子シグネチャ(CD8およびVa2の染色と組み合わせて)は、分割されたWT:IL−2Rako OT−iの比を定量 図7A、補足図7A、補足図7B。 3). IL-2RA WTは、排水(p=0.025、両側対t検定)または非排水(P=0.044、両側対t検定)LNのいずれかと比較して、移植部位でIL-2RA KO OT-Iを明らかに凌駕した。 これは、炎症部位での抗原との二次遭遇時のCD8+T細胞のIL−2への依存性の増加と、排液LNにおける初期プライミング中と比較して一致する。 図7:IL-2は、炎症部位でのCD8+T細胞増殖にとってより重要である。 (a)b6から回収した分割したIL−2R A W T:IL−2R A KO OT−i細胞の比。β OVA膵島移植片、b6.CD45.1宿主マウスへの同時移植(それぞれの106)後の腎LNおよび非排水鼠径LNを排出する。 比率は、破線で接続された個々のマウスの結果と個々の臓器のために計算され、両側のペアのt-テストによって比較されました。 結果は、n=5レシピエントマウスと三つの独立した実験の代表について示されています。 (b)内因性CD4+およびCD8+細胞におけるIL−2発現、およびB6のb6レシピエントにおける移入OT−i細胞でのIL−2発現。ソヴァ島移植片。 上部のパネルは腎臓LN(固体灰色)および接木(黒いライン)を流出させる接木のための代表的な流れのcytometryプロットを示す。 下のパネルは、移植されていない(対照LN)から採取した腎LnのIL-2発現の平均蛍光強度(MFI)、ならびに移植されたマウスの移植および排水腎LN(dLN)を要約 結果は、平均+s.d.として示され、n=6は、二つの独立した実験からプールされ、ウェルチの補正と両側の対になっていないt検定によって比較されました。
同族CD8+T細胞は、LNおよび炎症組織
に見出される(図1)。 1)我々は、実質抗原、オボアルブミン(OVA)に対するCD8T細胞応答を分析することができるモデルを確立しました。 OT-Iマウスは、MHCクラスi分子H-2kb上に提示されたOVA257-264ペプチドのCD8+T細胞認識を媒介するトランスジェニックTCRを発現する。 CD8T細胞は、OT-I/CD45.1マウスから濃縮され、CFSE色素標識され、i.v.によってB6(CD45.2+)宿主マウスに採用的に移入された。 養子に移入されたT細胞は、CD45.1染色(ならびにCD8およびOT-I TCRのVa2鎖)によって宿主細胞と区別することができ、一方、CFSE-色素希釈を使用して、増殖した細胞を同定した(例えば、図10B)。 図1A、補足図1B、補足図1B。 1). 実質抗原は、B6を移植することによって導入された。既にOT-I/CD45.1T細胞を受けていた宿主マウスの腎カプセルの下にあるβ ova島(このような島は、ラットインスリンプロモーター下の実質β細胞においてOVAを発現する、補足表1)。 すべての3つのソース(ホスト、T細胞ドナーと膵島ドナー)は、B6の背景を持っているので、H-2kbを発現しています。 したがって、OVA抗原発現は移植されたβ細胞に限定されていたが、我々は、交差提示を介してDCなどの非実質的なAPCによるβ細胞由来のOVAの提示は、LNプライ

1+CD8+Va2+gate)、4 0 0B6の単一移植片を受領した3日後または6日後に移植片を移植した。ソヴァ島。 (a)代表的なフローサイトメトリプロット。 分割されていないOT−iピークの位置は、B6島移植片の「抗原なし」対照を用いて決定した。 (b)腎LNおよび移植片における分割OT−iの総数(ここで、各点は個々のマウスを表す)。 7つの独立した実験からのプールされたデータ: n=8日目の移植片の受信者3とn=14日目の移植片の受信者6。 ある日6移植片は、フローサイトメーターの誤動作のために失われました。 水平バーは平均であり、P値は、ウェルチの補正を用いた対のない両側t検定によって計算された。
CD8+t細胞は炎症部位で増殖する<9 7 9 7><2 6 3 9>予想されるように、移植片部位を排出する腎LNにおいて、強力なOT−i応答が最初に検出され、これは、OVA抗原の存在に依存していた(図1 0)。 1a、b)。 移植後3日で、分割されたOT-Iは、B6を排出するLNsで検出することができた。②膵島移植(図1) た(図1A)。 1b、平均=9.2×104)。 対照的に、100倍少ない分割されたOT-I細胞は、B6内で検出することができました。①移植片(図1-2) 1a,b,平均=6.6×102)。 分割されたOT−i細胞の数は、移植片部位で3日目から6日目まで3 0 0倍に増加した(図1 0A)。 1×105、P<3545>0.0001、ウェルチの補正を伴う対のない両側t検定)であったが、LNの増加はなかった(図1b)。 1b)。 B6のOT-I応答。σ ova移植片はLNで増殖したOT-i細胞の浸潤によって説明できた。 しかし、CFSEプロファイルは、移植片のOT-I細胞が6日目にLNの細胞よりも高度に分割されたため、移植片とLN部位の間で異なっていた(図10B)。 1a)。 この違いについては、少なくとも二つの可能な説明があります。 何度も分裂した細胞のみが移植片に浸潤した。 あるいは、移植片に到達する細胞は、より迅速に分割され、おそらく利用可能な抗原の豊富さに起因する。 6日目のLNと比較して移植片の絶対細胞数の増加は、この後者の説明を調査するために私たちを導いた。
島との同族の相互作用は拡大を促進する
移植片における同族MHCの局所拡大への寄与の可能性を決定するために、我々はbm1由来の島を使用した。②ovaマウス(補足表1)。 Bm1で。σ ovaマウスでは、H–2kbm1分子はH-2kbに対する三つの変異のためにOVA257-264ペプチドを提示することができない(ref. 19). B6に対する応答の比較。とbm1.σova島移植片は、排水腎LNにおける同様のOT-I応答にもかかわらず、OT-Iの拡張はbm1で六倍に減少したことを示した。b6と比較されるžova。④移植片(平均=4.7×104を2.6×105分割したOT-Iと比較して、P=0.0153ウェルチの補正による対のない両側t検定;図。 2a)。 Bm1に浸潤OT-I細胞のこのあまり効率的な拡張。σova移植片は、移植された膵島細胞と同族の相互作用が局所T細胞拡張に寄与することを示唆した。

1+CD8+Va2+ゲート)の移植後6日目のOt−i細胞のフローサイトメトリー分析。 (a)400B6の単一移植片を受領した後の排水腎LNおよび移植片における合計分割されたOT-I。bm1とも呼ばれる。ソヴァ島。 B6のデータ。σ ova移植マウスは、図に示すもののサブセットである。 1b.各点は、個々のマウスを表します。 二つの独立した実験からプールされたデータは、各パネルに示されている:n=5b6の受信者。β ova移植、およびn=6bm1の受信者。├グラフト 水平バーは平均であり、P値は、ウェルチの補正を用いた対のない両側t検定によって計算された。 (b)200の島の接木が同じ腎臓の反対の棒に置かれ、共通の流出の腎臓LNを共有する両極接木モデルの模式図。 (C)B6でOT-Iを分割した合計。とKbKO。(d)B6とする。λ OVAおよびB6両極移植片(cおよびdのそれぞれにおける2つの独立した実験からプールされたn=5レシピエントマウス)の同じマウスのデータを破線で連結した:p値は、対になったt検定によって計算した。
H-2kbm1alloantigenによる寄与を排除するために、KbKOを生成しました。膵島β細胞でOVA抗原を発現するが、アロ抗原またはH-2kbを欠いているσ ovaマウス(補足表1)。 次に、B6に対する応答を比較するために”バイポーラグラフトモデル”を使用しました。とKbKO。B6宿主マウスにおいて、同じ腎臓の反対側の極に配置されたσ OVA島移植片は、移植片浸潤T細胞が同じLNでプライミングされたT細胞に由来するよ 2b)。 B6には10-100倍以上のT細胞が存在していた。kbkoよりも。①移植片(図1-2) 2c)。 個々のマウスについて計算された腎臓の反対極における分割されたOT−iの比を使用して、相対応答比(RRR)を導出した。 RRRは、移植細胞との同族の関与が起こったときに局所T細胞拡張が26倍大きいことを示した(Rrr=B6で26.4±14.1。略称は”KbKO”。σ ova移植片、P=0.0025、比対t検定、図。 2c)。
また、バイポーラB6に対する応答を比較しました。およびB6(抗原なし)移植片(図1 0B)を含む(図1 0B)。 2d)。 非常に少数のOT-IがB6移植片内で検出された(図10B)。 そして、これらの多くは血液汚染に由来するOT-Iを循環させていた可能性が高いと考えています。 したがって、抗原を欠く移植片の移植に関連する非特異的炎症は、炎症を起こした組織内で効率的なT細胞拡張をもたらさない。 これとは対照的に、B6に対する応答。σ ova移植は再び非常に強力であり、B6移植のそれよりも900倍以上大きかった(Rrr=950±252B6のために。σ ova:B6移植片,P<0.0001,ratio paired t-test,Fig. 2d)。
これらの実験は、炎症を起こした標的組織内のCD8T細胞の拡張が局所抗原提示によって有意に促進されたことを示した。 これは、必ずしも、例えば、移植片中の宿主DCを交差提示することによる、T細胞増殖への他の寄与を排除するものではない。 我々は、t細胞と膵島細胞との間の同族の相互作用が実質的なT細胞拡張をもたらすことを唯一認めている。
常在白血球との同族の相互作用は必要ない
島は、β細胞、内皮細胞および島常在白血球(IRL)を含む細胞の複雑なクラスターである。 そこで、我々は次に、t細胞拡張を駆動するためにt細胞に浸潤する抗原を提示した膵島細胞を明らかにしようとしました。 最も明白な候補はIRLです。 これらのCD4 5+細胞は、DCまたはマクロファージとして様々に定義されており、Cd1 1CおよびF4/8 0を同時発現し、抗原2 0、2 1、2 2、2 3を処理して提示することが したがって、ローカルCD8T細胞拡張を駆動するドナー IRLの役割を検討しました。 B6β ovaマウスをCd1 1C.DTRに交配した。Gfpマウスは、Cd1 1C.DTRを得るためである。GFP。β細胞がOVAを発現し、Cd11C+細胞がジフテリア毒素(DT)注射によってアブレーションすることができるσovaマウス8。 我々は、最初の島はCd11C.DTRから単離されたFACSによってテストされました。DTで処理されたGFPマウスは、Cd1 1C+細胞を枯渇させた(図1 0B)。 3a、b)。 未処理対照マウスにおけるCD1 1c+IRLは、CD4 5およびCd1 1Cの染色ならびにGFPレポーターのそれらの発現によって同定され、DT処理によって明らかに枯渇 0 0 0 2、Welchの補正を伴う対のない両側t検定)。 本発明者らはまた、Cd1 1C+IRLがF4/8 0およびH−2Kb MHCクラスiを共発現していることを確認した(補足図4)。 また、F4/8 0+細胞は、DT処理マウスの膵島からも枯渇した(図2A)。 2b)。 Cd11c.DTR.GFP。未処理およびDT処理マウスから単離されたσova島は、同じ腎臓の反対側の極に移植された。 分割されたOT−i数は、移植片間で類似しており、IRL枯渇が移植片部位でのCD8+T細胞増殖に影響を及ぼさなかったことを示している(図1 0A)。 3c)。 IRLが局所CD8T細胞増殖に重要ではないことを確認するために、本発明者らは、第2の実験セットを行った。 KbKOさんβ OVAマウスを照射し、KbkoまたはB6骨髄(B M)のいずれかで再構成して、H−2κ B発現が全ての細胞に存在しないか、または選択的にIRLに回復したβ OVA島の源を 3d)。 バイポーラ移植モデルにおけるそのような島の比較は、両方の移植片において同様のレベルのOT−i細胞拡張を示した(図1 0A)。 3e)。 したがって、IRLは局所CD8T細胞拡張の主要なドライバーではありません。

Cd11C.DTRにおけるCd11C+IRLの枯渇を示すフローサイトメトリー分析。DTで処理したGFPマウス: (a)未処理対照マウス由来の膵島におけるCd1 1c+IRLのゲーティングおよび単一のDT処置の翌日のそれらの枯渇、および(b)未処理およびDT処置マウス中のCd1 1c+IRLの列挙を示す代表的なプロット。 各点は、1〜8匹のマウスからプールされた島を含む個々の島の調製物、n=5未処理の島の調製物および4つの独立した実験からプールされた6DT処理された島の調製物を表す。 ウェルチの補正を用いた対のない両側t検定によって計算されたP値。 (c)Cd1 1C.DTRから得られた膵島の双極移植後6日での総分割OT−i。GFP。未処理またはDTで処理されたσ ovaマウス(n=6レシピエントマウスは、二つの独立した実験からプール)。 同じマウスのデータは破線で接続されています。p値はratio paired t-testによって計算されます。 (d)それぞれKbkoまたはB6BMで再構成したKbkoマウスのCd1 1C+IRL上のH−2KB発現の不在または存在を示す代表的なプロット。 生きている細胞でPregated。 (e)キメラマウス(単一実験からのn=3レシピエントマウス)から得られた膵島の双極移植後6日での総分割OT−i。 同じマウスのデータは破線で接続されています; 比対t検定によって計算されたP値。
実質細胞との同族の相互作用は重要である
B6。RIP-Kbマウスは、ラットインスリンpromoter24の制御下でβ細胞にh-2kbをトランスジェニックに発現する。 これらのマウスをKbKOに交差させることによって。②kbkoを生成したマウス。ソワ。H-2kb発現がβ細胞に限定されたβ kbマウス(補足表1)。 Β細胞上でのH−2κ Bの発現は、島のFACS分析によって確認された(図1 0A)。 4a)。 我々は、膵島造血細胞(CD45+)および内皮細胞(CD31+)にゲートし、H-2kbは、いずれかのKbKOでこれらの細胞上で発現していなかったことを示した。ソワまたはKbKO。ソワ。B6マウスにおける強力な発現と比較したβ κ Bマウス(図1 0B)。 4a)。 残りのCD4 5−CD3 1−細胞は自家蛍光陽性であり、内分泌細胞に富化されている。 KbKOからの島のFACS分析。ソワ。β κ Bマウスは、β細胞富化自家蛍光集団内で、B6島で見られるレベルと同様のレベルでH−2κ B発現を示した(図1)。 4a)。 バイポーラグラフトモデルにおける比較は、同族抗原がβ細胞上で発現されたときにOT-Iの拡張が14倍大きかったことを示した(KbKOのRRR=14.0±4.1。ソワ。kbkkkkkkkkkkkσ ova移植片、P=0.0008、比対t検定、図。 4b)。

(a)フローサイトメトリプロット(生細胞上でゲート)実質細胞上のH-2kb発現の選択的回復を示す。 ヒストグラムは、KbKO(影付き)、B6(破線)またはKbKOからの島を表します。①kb(太字)マウス。 (b)Kbkoのバイポーラ移植後6日目での総分割OT−i。とKbKO。 ソワ。├………. 島(3つの独立した実験からプールされたn=6レシピエントマウス)。 同じマウスのデータは破線で接続されています。p値はratio paired t-testによって計算されます。
t細胞は炎症部位で増殖する
以上の知見は、標的部位で局所的な増殖があったことを示している。 積極的に増殖する細胞を検出するために、我々はFucciRG/OT-I/CD45.1マウスをfuccirgマウスに交配し、FucciRG/OT-I/CD45を生成した。マウスの1つ(FucciOT-Iと略される)。 このようなマウスでは、細胞は、G0/G1の間に赤色(Fuccir)を蛍光し、S/G2/Mの細胞周期期の間に緑色(Fuccig)を蛍光する2 5、2 6。 サイクルフェーズ間の移行中のFucciRとFucciGレポーターの緩やかな分解と蓄積は、さらに区別が行われることを可能にします:サイクルG1細胞対静止G0でより強いFucciR発現、非常に初期のg1で二重陰性FucciR−G−細胞、およびG1/Sで弱く二重陽性FucciR+G+細胞(refs26、27)。 未移植マウスからの静止Fucciot−i細胞は、Fuccig−であった(図1 0B)。 5a、上部パネル、未接木)。 Fucci色素との干渉を避けるために、CFSEをCTVに置換した。 B6を受けたマウスで。CTV希釈の分析は、分画されたFucciot−iが排液性腎LN中に存在し、これらのいくつかは、活性な細胞分裂を示唆するFuccig+であったことを示した(図1 0A)。 5aの上部のパネル、LNを流出させる)。 移植部位では、多くの分裂を経た(CTVはもはや検出できない)FucciOT-Iが検出され、これらの多くは進行中の増殖を支持するFucciG+であった(図10B)。 5a、上部パネル、新鮮な移植片)。 分割されたOT−i集団内のFuccig+細胞の割合の比較(図4)。 5c)は、新鮮な移植片内の進行中の増殖(26.8±8.8%FucciG+)は、排水腎LN(7.3±1.6%、P=0.008、ウェルチの補正と不対両尾tテスト)または非排水腎LN(2.1±2.1%、P=0.003、ウェルチの補正と不対両尾tテスト)のいずれかでそれを超えていることを示した。 実際、FucciGおよびFucciR発現の両方の検査は、ほとんどの移植片浸潤OT-Iが積極的に分裂していることを示した、すなわち、非常に少数の細胞が、未移植マウスのLN 5a、下部パネル)。 炎症部位でのこの増殖はin situで生成されたと推測したが、これは単に増殖細胞の最近の到着を反映している可能性を完全に割り引くことはできなかった。 これを明らかにするために、我々はB6のバイポーラ移植片を収穫した。①ova島は切除直後に一方の移植片を分析し、他方の移植片を1日間培養した(図。 5a)。 OT-Iの数は培養期間にわたって増加しなかったが(Fig. Fuccig+OT−i細胞は、おそらく最適以下のex−vivo条件下での細胞死を反映して、多くのFuccig+OT−i細胞が引き続き検出された(図5B)(1 4.2±4.2%Fuccig+、図5B)。 5c)。 培養移植片のプロファイルは、一日のための可能な募集なしで、移植片に高いde novo増殖があったことを示すであろう。

(1+CD8+Va2+リンパ球上にゲートされた)、腎LnsまたはバイポーラB6におけるFucciot−i細胞による応答を示す概略的および代表的なフローサイトメトリプ├グラフト 一方の極からのLNSおよび移植片を直ちに(移植片の6日後に新鮮に)検査し、他方の極からの移植片を分析の1日前に培養した。 未移植マウスからのLNは、分裂およびFuccig発現の不在(上パネル)および静止Fucciot-IにおけるFuccir高細胞(下パネル)の優位性を示すために含まれた。(b)新鮮な培養移植片において、全分割Fucciot-iが含まれていた。 平均+s.d.、n=5、両側比対t検定によって計算されたP値。 (c)新鮮な非排水および移植片排水腎LNならびに新鮮および培養移植片において、%Fuccig+ot−iを分割した。 平均+s.d.、n=5処理中のLNの損失のためにn=4の非排水LNを除いて、n=5。 P値はWelchの補正を用いた両側の不対t検定によって計算した。 データは、二つの独立した実験からプールされています。
実質細胞との同族の相互作用は増殖を駆動する
我々は次に、移植片、炎症性DCなどの宿主由来のAPCにおけるT細胞増殖の別の潜在的な局所ドライバーの役割を評価するためにFucciOT-Iモデルを利用しました。 ホストAPCの貢献を排除するために、まずKbKOの背景を導出しました。 KbKOマウスはOT-I細胞を拒絶したので、我々は宿主として使用するためにB6キメラにKbKO BMを作成しました; したがって、造血細胞はH-2kbを欠いていたが、OT-I細胞の許容性であった。 これらのキメラには、Fucciot−i t細胞およびkbkoのバイポーラ移植片を与えた。β ova島(H-2κ b発現を欠き、したがってOVA抗原を提示する能力を欠く)およびKbko。ソワ。β kb島(H-2kbおよびOVA抗原の両方がβ細胞に限定された)。 キメラにはH-2kb陽性APCが欠けていたため、OT-I応答を開始するためにova257-264ペプチドコーティング脾臓細胞を投与する必要があった。 このプライミングの成功は、腎LN中のFucciOT-I細胞におけるCTV-希釈によって示されたが、収穫時にはこれらはFucciG−であり、積極的に分裂しているようには見え 6a、d)。 非常に少数のOT-IはKbKOに潜入しました。しかし、KbKO内では明らかに拡大された。ソワ。61.4±26.6のrrr KbKOの移植片。ソワ。kbkkkkkkkkkkk├お得な情報 0 0 0 8、両側比対t検定)。 したがって、宿主APC上の同族抗原の非存在下でさえ、実質β細胞上の同族抗原は、移植片部位でCD8T細胞増殖を駆動するのに十分であった。 Kbko中に存在する少数のFucciot−i t細胞。σ ova移植片は、高度に分割された画分への非効率的な進行の点で、LNのものに似ていた(図。 6a、c、LNで7.5±0.9%、KbKOで19.3±3.3%を高度に分割しました。およびFuccig発現の欠如(図1 4A)。 6a、d、LNの0.1±0.0%およびKbKOの0.1±0.1%。σova移植片)は、同族抗原の非存在下で移植部位でot-I増殖がほとんど起こらなかったことを示唆している。 これとは対照的に、KbKO内のOT-I。ソワ。β kb移植片は、主に高度に分割された(92.3±1.0%、図。 これらのうちのいくつかはFuccig+であり、したがって活発に増殖していた(図6A、c)。 6a,d,5.0±1.2%FucciG+)。 したがって,島実質β細胞による同族抗原提示は,Fucciot-iのinsituでのdenovo増殖を促進することができた。

宿主造血細胞がH-2kb発現を欠いているB6宿主マウスへのKbKO BMにおける移植に対するFucciOT-I応答。 移植マウスは、ot-Iプライミングを開始するために、移植の日にペプチドコーティングひ臓細胞を受けた。 1+CD8+Va2+リンパ球上にゲートされた)。 上のパネルは、グラフトもプライミングもされていないマウスのLNにおける静止OT-Iにおける分裂およびFucciG発現の欠如を示す。 下の三つのパネルは、バイポーラグラフトとプライミングマウスにおける応答を示す:腎LN、KbKOを排出する。とKbKO。ソワ。├グラフト 移植マウスの分割細胞は二つのセクターに分割され,高度に分割された細胞はCTVが検出限界を超えて希釈されたセクターに落ちた。 (b)合計kbkoでfucciot-Iを分割しました。とKbKO。ソワ。σ kbバイポーラグラフト、両側比対t検定によって計算されたP値。 両極移植マウスの腎LNおよび移植片を排出する際の(c)%高度に分割された%および(d)%FucciG+OT-I。 P値は両側対t検定により計算した。 個々のマウスの結果は、二つの独立した実験からプールされた破線、n=6レシピエントマウスによって接続されています。
IL−2は炎症部位でより重要である<9 7 9 7><2 6 3 9>本発明者らは、IL−2R a発現が、cd8+t細胞の増殖および末梢実質(膵島移植片)内での蓄積に対して、lnの排液中のプライミング部位内と比較してより重要であることを示した(図1)。 7a)。 さらに,プライミングサイトから離れた第二のサイト,すなわち非排水LNにおける応答を解析した。 OT−Iマウス由来のCTV標識CD8+t細胞を、B6.CD4 5.1宿主マウス(CD4 5.2+、IL−2R A−CD4 5.2+)およびOT−i/Ly5.1(IL−2R A+、CD4 5.1+CD4 5.2+)に同時移入した。1+)B6の単一の接木を受け取る前。ソヴァ島。 移入されたT細胞集団のそれぞれの別個のCD4 5対立遺伝子シグネチャ(CD8およびVa2の染色と組み合わせて)は、分割されたWT:IL−2Rako OT−iの比を定量 図7A、補足図7A、補足図7B。 3). IL-2RA WTは、排水(p=0.025、両側対t検定)または非排水(P=0.044、両側対t検定)LNのいずれかと比較して、移植部位でIL-2RA KO OT-Iを明らかに凌駕した。 これは、炎症部位での抗原との二次遭遇時のCD8+T細胞のIL−2への依存性の増加と、排液LNにおける初期プライミング中と比較して一致する。
図7:IL-2は、炎症部位でのCD8+T細胞増殖にとってより重要である。
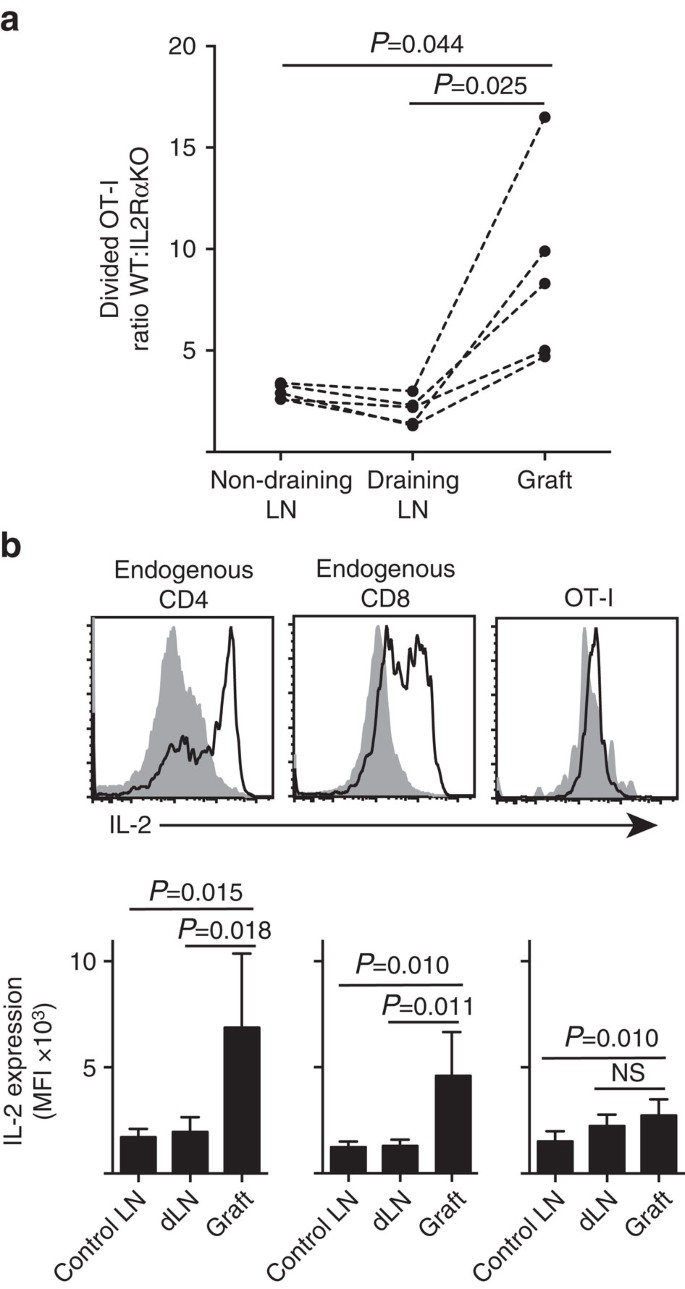
(a)b6から回収した分割したIL−2R A W T:IL−2R A KO OT−i細胞の比。β OVA膵島移植片、b6.CD45.1宿主マウスへの同時移植(それぞれの106)後の腎LNおよび非排水鼠径LNを排出する。 比率は、破線で接続された個々のマウスの結果と個々の臓器のために計算され、両側のペアのt-テストによって比較されました。 結果は、n=5レシピエントマウスと三つの独立した実験の代表について示されています。 (b)内因性CD4+およびCD8+細胞におけるIL−2発現、およびB6のb6レシピエントにおける移入OT−i細胞でのIL−2発現。ソヴァ島移植片。 上部のパネルは腎臓LN(固体灰色)および接木(黒いライン)を流出させる接木のための代表的な流れのcytometryプロットを示す。 下のパネルは、移植されていない(対照LN)から採取した腎LnのIL-2発現の平均蛍光強度(MFI)、ならびに移植されたマウスの移植および排水腎LN(dLN)を要約 結果は、平均+s.d.として示され、n=6は、二つの独立した実験からプールされ、ウェルチの補正と両側の対になっていないt検定によって比較されました。

(a)b6から回収した分割したIL−2R A W T:IL−2R A KO OT−i細胞の比。β OVA膵島移植片、b6.CD45.1宿主マウスへの同時移植(それぞれの106)後の腎LNおよび非排水鼠径LNを排出する。 比率は、破線で接続された個々のマウスの結果と個々の臓器のために計算され、両側のペアのt-テストによって比較されました。 結果は、n=5レシピエントマウスと三つの独立した実験の代表について示されています。 (b)内因性CD4+およびCD8+細胞におけるIL−2発現、およびB6のb6レシピエントにおける移入OT−i細胞でのIL−2発現。ソヴァ島移植片。 上部のパネルは腎臓LN(固体灰色)および接木(黒いライン)を流出させる接木のための代表的な流れのcytometryプロットを示す。 下のパネルは、移植されていない(対照LN)から採取した腎LnのIL-2発現の平均蛍光強度(MFI)、ならびに移植されたマウスの移植および排水腎LN(dLN)を要約 結果は、平均+s.d.として示され、n=6は、二つの独立した実験からプールされ、ウェルチの補正と両側の対になっていないt検定によって比較されました。
炎症部位でのCD8+T細胞増殖に対するIL-2への依存性の高まりは、局所IL-2産生の必要性を推論した。 したがって、本発明者らは、IL−2を産生する能力について、種々のT細胞(内因性宿主由来CD4+およびCD8+ならびに移入されたOT−i CD8+T細胞)の可能性 7b)。 移植片またはLNから調製した細胞懸濁液を、細胞内IL−2の発現のために染色する前に、PMAおよびイオノマイシンで短時間(4時間)再刺激した。 内因性宿主由来CD4+およびCD8+T細胞の検査は、排水または非排水LNのいずれかと比較してIL-2染色のMFIの明確な増加と移植片炎症の部位でIL-2産 炎症部位のOT-I CD8+T細胞におけるIL-2レベルは、非排水LNのものよりも適度に増加したが、排水LNのものと有意に異ならなかった。 これらのデータの一つの解釈は、ot-I実質細胞とot-Iの同族の相互作用は、OT-Iは、局所移植環境における内因性CD4+およびCD8+T細胞に由来するパラクリンIL-2に依存しているように、急速な増殖が、貧しいIL-2産生を誘導することである。 しかし、追加の実験は、実質抗原の非存在下での外因性IL−2がOT−i CD8+細胞増殖を駆動できないことを示した。 IL−2(組換えhIL−2、2 5,0 0 0IU)を、b6の双極性移植片を受けたB6マウスに腹腔内投与した。ソヴァ島とB6島。 移植後6日目にIL-2またはビヒクル処理マウスから回収された臓器におけるOT-I回復の比較は、実質抗原すなわちB6島移植を欠いている二つのサイト342)および非排水鼠径LN(IL-2処理マウスにおける1,660+1,023と比較して、ビヒクル処理で1,648+633、P=0.987、平均±s.d.、n=3、ウェルチ補正を伴う両側の対のないt-検定)。