急性腎損傷に対するCRRT中のクエン酸塩抗凝固
急性腎損傷
急性腎損傷(AKI)は、多くの原因が考えられる臨床症候群であり、最近の血清クレアチニン濃度の増加および/または尿排出量の減少によって証明される、数時間または数日にわたる腎機能の急激な低下と単純に定義される。
これは、腎機能の低下がゆっくりではあるが不可逆的に進行し、数ヶ月および数年にわたって起こる慢性腎臓病(CKD)とは異なる。 AKIはもちろん、基礎となるCKDを有する患者で起こり得、AKIの診断は、CKDの最終的な診断の正常なリスクよりも大きいと関連している。
国際的に合意されたガイドラインでは、AKIの診断は以下の場合に行うことができると述べています。
•血清クレアチニンが0.3mg/dL(26.5μ mol/L)以上48時間以内に増加する;または
•過去7日以内に血清クレアチニンが50%以上増加した;または
•尿量が
AKIは、腎機能の軽度の低下(ステージ1AKI)から重症度の全スペクトルを網羅しています。腎不全(ステージ3aki)。 ステージングは、尿出力データの有無にかかわらず、血清クレアチニン測定に依存する(表I)
|
ステージ |
血清クレアチニン |
尿の出力 |
|
1 |
1.5-1.9 ベースライン |
6-12時間 |
|
2 |
2.0-2.9回表 |
⩾ 12 時間 |
|
3 |
3.0 ベースライン |
または |
表I:AKI重症度の3つの段階(参照から1)
AKIの原因は、従来、三つの見出しの下に分類されています:前腎;腎(内因性); そしてpostrenal、AKIが特定の腎臓の病因学を有することができるが、また腎臓の外の第一次問題に起因できるという事実を強調する。
腎臓への血流を減少させる効果を有する状態(腎灌流)は、腎前AKIの潜在的な原因であり、嘔吐、下痢、出血、火傷または敗血症性ショックによる血液量減少、心不全および肝不全(肝硬変)などによる心拍出量の減少が含まれる。 内因性AKIの主な原因は、腎虚血または腎毒性薬物/毒素の摂取に起因する腎尿細管壊死である。 重症患者におけるAKIの最も一般的な原因である敗血症は、腎尿細管壊死に類似する内在性腎損傷の定義が不十分であることが部分的に原因である。 最後に、腎後AKIは、腎臓の遠位の尿流を妨害する任意の状態から生じる;これらには、腎結石(結石);前立腺疾患(腫瘍/肥大);膀胱機能不全;および尿道狭窄が含
AKIに対するAKI腎置換療法の管理
AKIに対する特定の治療法はなく、管理は根本的な原因に向けられた治療と主に支持的である。 腎毒性薬物の離脱、体液蘇生、電解質および酸-塩基障害の矯正は、すべてこの一般的な支持的管理の一部である。 正常な血圧および心拍出量を回復させるための昇圧剤または変力性薬物の投与が必要な場合がある。
本記事の焦点である腎補充療法(RRT)は、保存的支持管理に反応しない重度のAKI患者に対する最後の手段治療を表している。 AKIを有するICU患者の約23%(すなわち、すべてのICU患者の約13%)がRRTを受けている。 <5501>腎補充療法(RRT)は、腎機能を置換しようとするすべての治療の総称である。 末期腎疾患へのドナー腎臓の移植は究極のRRTと考えることができるが、この用語は、より多くの場合、血液フィルタとして半透過性膜を利用するプロセ 腹膜透析および血液透析:透析RRTの2つの広範なタイプは、AKIの治療のために利用可能である(そしてそのことについては、末期CKD)。
対照的に、血液透析は、体外(体外)の機械で血液を濾過することを含む。 血液はフィルター/透析器に送り込まれ、そこで老廃物や余分な体液が除去され、その後身体に戻されます。 この体外回路(透析装置および患者からのそして患者への接続の管)はprocoagulant環境である。
血液透析、血液ろ過および血液ろ過
現代の透析装置には、血液ろ過(HF)および血液透析(HD)のオプションがあり、血液透析(HD)、血液ろ過(HF)、血液ろ過(HDF)の三つの異なる透析モダリティが可能である。
3つのモダリティの中心にあるのは、血液フィルターを構成する半透過性膜である。 患者から汲み上げられた血液がこの膜の片側を流れると、余分な水と廃棄物の溶質が膜を通過します。 濾過された血液が患者に戻されると、濾液または流出液は廃棄物に圧送される。
血液透析(HD)のプロセスは、膜の反対側の血液に連続的かつ逆流する透析液を使用することを含む。 透析液の組成および流量は、血液溶質に関して半透過性膜を横切る一定の濃度勾配を保証する。 これらの濃度勾配は、次に、膜を横切る溶質分子の制御された拡散を容易にする。
血液から除去しなければならない尿素やクレアチニンのような溶質については、濃度勾配は血液から透析液への拡散方向であるようなものであるのに対し、重度のAKIに伴うアシドーシスを矯正するために血液に添加することが多い重炭酸塩のような溶質については、血液に対して重炭酸塩濃度が高い透析液は、透析液から血液への拡散方向とは逆の方向に拡散することを保証する。 透析液組成および流量の調整は、このように患者固有の代謝補正を可能にする。
体液過剰は、血液透析中に矯正されるAKIの特徴であることが多い。 これは、半透膜を横切って存在する静水圧勾配に依存する限外濾過によって達成される。 膜の血液側の相対的な正の静水圧は、血液から透析液に水を効果的に「押し出す」。
この限外濾過はまた、溶質対流(または溶媒抗力)と呼ばれる機構によって限外濾過中に水と共に引きずられる溶質分子の通過を容易にする。 血液透析中の溶質拡散、溶質対流、限外ろ過の複合効果は、細胞外および細胞内コンパートメント内の流体量および組成が、正常に機能する腎臓を有するものの間に関連するものにできるだけ近くに回復することを目的としている。
血液ろ過(HDF)は、HFとHDの組み合わせです。 それは対流および限外濾過によって高分子量の溶質の最適の整理と結合される透析の液体への拡散によって低分子量の溶質の最適の整理を可 HFと同じように、HDFは連続的な取り替えの液体を要求し;HDと同じように、hdfは透析の液体を要求する。
AKIに対するRRTの開始とタイミング–間欠的対連続的rrt
すべての腎補充療法(PD、HD、HF、HDF)は、間欠的に(通常は3〜4時間のセッションで)、または腎機能が回復す 末期腎不全の患者で、生涯(慢性)RRTを必要とする患者の場合、治療は断続的な血液透析(IHD)のみであり、ほぼ常に週に三回、四時間のセッションで提供される。
AKIの患者は、AKIを沈静化させた重大/急性疾患の解決中にrrtが腎機能をサポートするための一時的な要件のみを有する。 AKI患者のRRTの平均持続時間は約13日であるが、特定の場合には数日間しか必要ではないか、または何週間も延長することができる。
高カリウム血症(血漿カリウム>6.0-6.5mmol/L)
•重度の尿毒症(血漿尿素>30mmol/L)
•尿毒症脳症の徴候
•アシドーシス(pH•急性肺水腫
AKIのこれらの極端な効果しかし、rrtを開始(および停止)するための最適なタイミングは現在不明であり、進行中の研究の主題である。 現在のところ、AKIのための特定のタイプのRRTをサポートする信頼できるデータはなく、その結果、すべてのタイプのRRTが採用されている。
しかし、現在のガイドラインは、モダリティが何であれ、RRTは最も重症の(血行力学的に不安定な)患者に断続的にではなく連続的に送達されるべきであ 最近の調査では,連続腎補充療法(Crrt)はAKIに対する間欠療法よりもはるかに頻繁に使用されており,最も一般的に使用されるCRRTは連続静脈静脈血ろ過(CVVHF)であり,続いて連続静脈静脈血ろ過(CVVHDF)であることが示されている。
連続腎補充療法(CRRT)中の抗凝固
crrtは、腹膜透析を除く他のすべての腎補充療法と共通して、非生理学的な体外回路を介して血液を圧送する。 非生理学的表面との接触時に凝固する血液(凝塊)の固有の特性は、「凝塊を含まない」患者の体外回路を維持するためには、血液を抗凝固させなければな
CRRTは、治療期間が延長され、血液が回路を通って圧送される速度が比較的遅いため、断続的なモダリティと比較して、特に抗凝固の必要性を有する。 さらに、CRRTを必要とする患者の血液は、根底にある重大な病気(例えば敗血症)または外傷のために、すでに相対的な凝固促進状態にあることが多い。
長年にわたり、非分画ヘパリン(UF)または低分子量ヘパリン(LMWH)のいずれかであるヘパリンは、CRRTを含む透析処置に使用される唯一の抗凝固剤であった。 ヘパリンは使用され続けます;それはRRTを要求する患者の大半のためのanticoagulationの安く、一般に安全な平均です。
しかし、全身性ヘパリン抗凝固は避けられないため、必然的に出血のリスクが高まるため、透析処置中のヘパリン抗凝固は、現在出血しているか、または通常の出血リスクよりも高い人には絶対に禁忌である。
さらに、ヘパリンは少数である(
ヘパリンの使用に関連する潜在的な出血およびHIT-IIリスクは、RRTを必要とする一部の患者のための代替抗凝固剤の必要性を強調した。 クエン酸塩はそのような代替手段を提供した。 最初に1980年代初頭に首尾よく使用された透析回路の地域クエン酸塩のanticoagulationはヘパリンが禁忌とされる患者のその少数のために最初に予約されました。 それはクエン酸塩抗凝固CRRTとヘパリン抗凝固CRRTを比較する無作為化比較試験の結果と変わりました;これらはクエン酸塩がヘパリンより有効で、安全な抗凝固剤であることを示しました。
クエン酸塩は、CRRTを必要とするすべてのAKI患者のための選択の抗凝固剤として近年浮上しています。 世界中の集中治療室は現在、CRRTのためのヘパリンから地域のクエン酸塩抗凝固への切り替えを報告しています。 一部の当局は、断続的(慢性)血液透析(IHD)のためのヘパリン抗凝固ではなくクエン酸塩の使用を推奨している。
クエン酸–抗凝固作用のメカニズムとCRRTへの応用
クエン酸は、一世紀以上にわたって輸血のために寄付された血液を抗凝固/保存するために使 このiCaは、血小板凝集およびフィブリン産生を担う内因性および外因性凝固経路におけるいくつかの重要なステップの両方に必要な補因子であり、それによってフィブリン凝塊形成が行われる。
血漿iCa濃度を約0.35mmol/L(通常のref範囲1.15-1.30mmol/L)に低下させることにより、血液凝固を防止する。 この非生理学的で重度の低カルシウム血症状態は、血漿クエン酸濃度を約3mmol/L(通常の血漿クエン酸濃度〜0.1mmol/L)に上げることによって達成される。
Morabitoらによって概説されている詳細には違いがあるが、CRRT中のクエン酸抗凝固のためのすべてのプロトコルは、クエン酸含有溶液(通常はクエン酸三ナトリウムまたは酸-クエン酸-デキストロース(ACD)溶液)を患者から離れる場所に近いプレフィルター/透析ラインに連続注入することを含み、別の溶液として、または予備希釈代替液と組み合わせて使用する。 この注入の流量は、〜3mmol/Lの血中クエン酸濃度を達成するように調整され、それによって約0.35mmol/Lの血漿iCaが得られる。
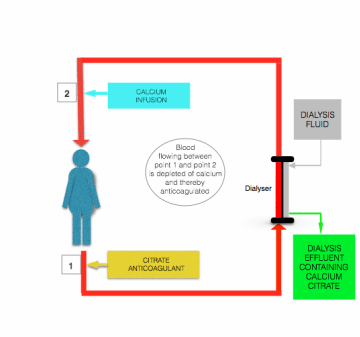
クエン酸塩の注入によって引き起こされるhypocalcemiaは患者に入るところの近くのpostfilterラインに血が患者に戻る前に、カルシウム含んでいる解決(塩化カルシウムかグルコン酸カルシウム)の注入によって訂正されます(上の図を見て下さい)。
ヘパリン抗凝固に対するクエン酸抗凝固の主な安全上の利点は、抗凝固が体外回路に限定されることである。 このいわゆる「局所抗凝固」は、注入されたクエン酸塩の大部分がフィルター/透析器を通過する間に血液から(クエン酸塩アニオンまたはクエン酸カルシウムキレートのいずれかとして)除去されるために達成される。
フィルター後の血液中の残りのクエン酸塩は、全身循環で希釈され、組織細胞(主に肝細胞)のミトコンドリアにおける酸素依存性クレブス周期によ
クエン酸の代謝は重炭酸塩の産生と関連している: 代謝された1ミリモルのクエン酸塩ごとに、3ミリモルの重炭酸塩が生成される。 この主に肝臓のルートによるクエン酸塩の急速な整理(血のクエン酸塩の半減期は普通およそ5分です)普通CRRTの間に全身のanticoagulationの不在、およびそれによ
クエン酸-抗凝固CRRT中の潜在的な代謝障害
最近まで、すべてのAKI患者に対してクエン酸-抗凝固CRRTを完全に受け入れることに対する明らかな抵抗は、治療を受け
クエン酸-抗凝固CRRTを投与された患者では、以下の電解質および酸-塩基障害が報告されている :
•低カルシウム血症/高カルシウム血症
•低マグネシウム血症/高マグネシウム血症
•低ナトリウム血症/高ナトリウム血症
•代謝性アルカローシス
*代謝性アシドーシス
これらの障害は、いくつかの理由で発生する可能性がありますが、末梢循環におけるクエン酸の蓄積(クエン酸毒性)は、これらの障害のほとんどの中心となる可能性があります。 クエン酸塩がCRRT中に蓄積する理由は次のとおりです。
•肝疾患によるクエン酸塩の代謝障害および/または不十分な灌流による酸素の送達の減 敗血症/心原性ショックにおける)
•透析中の膜開存性の漸進的な減少により、クエン酸塩の濾過が減少し、全身循環へのクエン酸塩送達が増加した
•操作エラー–体外回路へのクエン酸塩注入速度が偶発的に増加し、全身循環へのクエン酸塩送達が増加した
•血液製剤輸血–血液製剤中に存在するクエン酸塩防腐剤は、CRRTから生じる全身循環におけるクエン酸塩負荷を増加させる。5501>, 周辺循環のクエン酸塩の蓄積は結果的に減らされた血しょうイオン化されたカルシウム集中(hypocalcemia)の循環のイオン化されたカルシウムのクエン酸塩の 十分に重度の低カルシウム血症は、心臓不整脈と、最終的には、心停止を引き起こす可能性がある場合。
クエン酸の蓄積(毒性)中に血漿イオン化カルシウムが減少するが、クエン酸に結合したカルシウムが測定された総カルシウムに含まれるため、総カルシウムが増加する(高カルシウム血症を示す)。 イオン化カルシウムに対する合計の比率(通常は2.0)の>2の増加。1は定期的に利用できる血しょうクエン酸塩の推定の不在のクエン酸塩の毒性の最も信頼できる信号であるために見つけられました。
クエン酸塩抗凝固に伴う血漿ナトリウム(高ナトリウム血症)の増加のリスクは、CRRTに使用されるクエン酸塩溶液のナトリウム含有量(高張性)が高 例えば、ある議定書で使用されるクエン酸三ナトリウムの4%の解決は420mmol/L.の集中でナトリウムを含んでいます実際には、hypotonic透析/取り替えの液体の使用はこの危険を軽減でき、hypernatremiaはすべての記述によってクエン酸塩の抗凝固のまれな複雑化です。
クエン酸塩の抗凝固の間のhypomagnesia(減らされた血清のマグネシウム)の危険はカルシウムと共通に、マグネシウムがまた(キレート)クエン酸塩に結合できる二価 クエン酸塩のキレート化の行為によるマグネシウムの損失が透析/取り替えの液体のマグネシウムによって十分に補われなければ、hypomagnesiaは起こることが
クエン酸-抗凝固CRRTを投与された患者の生化学的モニタリング
集中治療室内に設置された血液ガス分析器を用いたポイント-オブ-ケア試験では、ほとんどのパラメータ(イオン化カルシウム、pH、重炭酸塩、塩基過剰、ナトリウム、乳酸)の迅速かつ便利な測定が可能であるが、血清総カルシウムおよびマグネシウムの推定は通常、これらのプラットフォームでは利用できず、これらの測定のためにサンプルを実験室に送付する必要がある。
最近の2つの研究は、一部の血液ガス分析装置が、極めて低い非生理学的濃度(〜0)でイオン化カルシウムを測定する際に信頼できない可能性があ3ミリモル/L)postfilter血液中に存在します,正確に全身循環中の血漿イオン化カルシウムを測定する能力が(濃度がはるかに高い場合)疑いではありません.
|
測定される変数 |
監視間隔 |
目標値 または約。 参照範囲 |
測定の目的 |
対象外の場合の是正措置 |
|
Postfilterイオン化カルシウム(iCa)濃度、すなわちpostfilterポートからサンプリングされた血液。 |
開始のそしてクエン酸塩の線量の変更の後の1時間以内に、そして4-6時間毎に |
0.25-0.35ミリモル/L |
|
クエン酸塩の線量の調節:ica>0.35なら増加して下さい、iCaなら減少して下さい |
|
全身イオン化カルシウム(iCa)、すなわち患者からサンプリングされた血液 |
ベースライン(開始前)、その後、開始後1時間、その後、少なくとも4-6時間ごとに |
1.15-1.30ミリモル/L |
|
カルシウム注入率の調節;icaなら増加して下さい1.30 |
|
患者 から採取した血液(TotCa=iCa+アルブミンに結合したカルシウム+クエン酸に結合したカルシウム) |
少なくとも12-24時間ごとに(全身イオン化カルシウム推定と同時でなければならない) |
totCa:iCa比の決定にのみ必要です(以下を参照してください) |
||
|
イオン化カルシウムに対する合計の比率 (TotCa:iCa) |
少なくとも12-24時間ごとに |
クエン酸塩の蓄積/毒性を時々”クエン酸塩ロックと呼ばれる検出するため” |
オプションは次のとおりです:
|
|
|
動脈血ガス分析
|
ベースライン(開始前)。 開始から1時間以内に、少なくとも4-6時間ごとに。 |
pH7.35-7.45 バイカルブ23-28mmol/L BE–2-+3 ミリモル/L |
酸塩基障害を検出するには:代謝性アルカローシス 代謝性アシドーシス |
代謝性アルカローシスの場合のオプションは次のとおりです:
|
|
血清ナトリウム |
一日一回 |
135-145 ミリモル/L |
高ナトリウム血症/低ナトリウム血症を検出するには |
まれな発生-正しい透析/置換液を確認します。 |
|
血清乳酸 |
ベースライン(開始前)、臨床ニーズに応じて |
クエン酸の毒性の危険がある状態にある人の識別を助けるため |
TotCaと一緒に、考慮してください:iCa比、クエン酸毒性のリスク |
|
|
血清マグネシウム |
少なくとも毎日一度は |
hypomagnesiaを検出するには |
マグネシウム注入による矯正 |
表II:クエン酸塩-抗凝固CRRT中の生化学的モニタリング(Ref24)