神経学におけるフロンティア
はじめに
多巣性運動神経障害(MMN)は、1988年(1)に伝導ブロック(CB)を有する複数の運動神経に影響を与える純粋な運動神経障害として初めて記載された。 モーター CBはMMNの診断のための中心の電気生理学的な認刻極印である。 神経超音波は、末梢神経の形態学的特徴を供給することができる。 神経断面積(CSAs)における末梢神経または頸部根の多焦点拡大は、MMN(2-4)で報告されている。 Kerasnoudis et al. (5)化合物運動活動電位(CMAPs)と上腕の正中神経のCSAsとの間の相関を報告した(r=0.851,p<0.001)。 Beekman et al. (6)超音波検査研究は、純粋に臨床的根拠で予想以上に伝導異常と互換性のある神経CSAの増加を示したことがわかりました。 さらに,一部の部位はCBを伴わずに神経肥大を示した。 多焦点CBsはMMNの神経に沿って分布していた; しかし、これらの研究は、限られた形態学的情報を提供し、いくつかの所定のサイトを測定しました。 本研究では、神経に沿って連続走査を使用し、超音波に基づいて複数のサイトでCSAを測定することは、MMNの伝導ブロックと増加したCSAとの間のより正確な相関を可能にした。
方法
被験者
2014年12月から2018年5月の間に、12人のMMN患者がAanem(7)によって提案された基準に従って北京連合医科大学病院から連続的に募集された。 年齢(±1年)によって一致した健康なコントロール(HC)の同じ数は、コントロールとして登録されました。 すべての患者と健康なコントロールは、感覚検査と一緒に、手首、親指と指の屈曲、opponens pollicis、外転pollicis brevis、指の広がり、および内転筋pollicisの筋力テストを含む標準化された臨床 臨床検査,筋電図,神経超音波検査を同日に行った。 北京連合医科大学病院の倫理委員会は、私たちの研究プロトコルを承認し、すべての患者はヘルシンキの宣言に従ってインフォームドコンセントフォーム
神経伝導研究
運動神経伝導研究(NCSs)は、10mmディスク電極でCMAPsを記録しながら、経皮的最大上神経刺激を伴う両側正中神経および尺骨神経のすべ 標準セグメントは、正中神経は手首から肘および肘から腋窩、尺骨神経は手首から下肘および上肘から腋窩と定義された。 インチング技術(2cm単位で神経のコースに沿って刺激)は、同じセグメント全体で連続した超音波検査と一緒に、CBの正確なサイトを検出し、部分伝導ブロ 標準セグメントのCB診断とインチング技術は、AANEM(7)によって提案された基準に従って行われました。 真の伝導ブロックのみを含めるためには、遠位CMAPは1mVでなければならなかった。 皮膚温度が<3 8 3 3>3 1℃のままであることを確実にするために室温を維持した。
超音波検査
超音波検査は、10MHz線形アレイ変換器(GE LOGIQ e、USA)を用いて、両側正中神経および尺骨神経の手首から腋窩までの神経追跡を介して行われた。 神経サイズの人工的な増加を排除するために、これらの測定にはズーム倍率の使用は許可されなかった。 初期設定は深さを含むすべての検査の間に一定した保たれた。 トランスデューサは、最小かつ最も明るい画像を得るために選択された角度で神経に対して垂直に保たれた。 各神経上の所定部位のCsaは,神経の高エコー縁のすぐ内側をトレースすることによって測定した。 当研究室からの以前の報告に従って、各神経について十の所定の部位を測定した(8)。 正中神経の場合、10のサイトには、手根管の出口(M1)、手首の折り目の中間点(M2)、手根管の入口(m3)、手首の折り目の近位4cm(M4)、手首の折り目と肘の間の中間(M5)、pronator teres(M6)、肘(M7)、肘の上4cm(M8)、肘の上8cm(M9)、腋窩(m10)が含まれていた。 尺骨神経の場合、10の部位には、手首(U1)、手首に近位の4cm(U2)、尺骨動脈からの出発点(U3)、尺骨屈筋手根の筋肉腹(U4)、肘骨トンネルの出口(U5)、肘骨トンネルの内側(U6)、肘骨トンネルの入口(U7)、肘骨トンネルの入口に近位の4cm(U8)、肘骨トンネルの入口に近位の8cm(u9)が含まれていた。)、および腋窩(u10)。 上記の部位を除いて、他の拡大部位でも測定を行った。 CSAの拡大は、私たちの研究室で規範的な値に参照された(正中神経では、前腕-肘セグメントは≥10mm2であり、肘-腋窩セグメントは≥9mm2であった;尺骨神経では、前腕と腕のセグメントの両方は≥6mm2であった)。 CSA測定後,神経は再び連続的に追跡され,完全に記録された。 神経の拡大をもたらす一般的な圧縮神経障害は、研究から除外されていた。 超音波検査者は、患者の情報に盲目にされました。
統計
MMNのCsaは非正規分布を示した。 Mann−Whitney U−検定を用いて、mmnおよび健常対照、ならびにCBを有するセグメントとCBを有しないセグメントとの間の最大Cs Aの差を比較した。 最大CSAは、標準セグメント全体の最大CSAとして定義されました。 すべての検定で、両側P値<0.05が統計的に有意であると考えられました。
結果
臨床的特徴
8人の男性と4人の女性が平均年齢43.7歳(範囲21-62、SD13.2)、12人の健康な対照(平均年齢43.6、範囲28-57、SD13.3、8人の男性)を本研究に含めた。 平均疾患持続時間は65であった。3(24-108)ヶ月。 平均身長は168(155–186)cm、平均体重は65.4(56.5-88)kgであった。 すべての患者は治療未経験であった。
断面積(CSA)
10部位におけるMMNおよびHCの中央値および尺骨神経のCSA値を表1および図1に示します。 CSA拡大は健常対照と比較して多巣性であった。 正中神経では,csa値が高いのは主に前腕セグメントと上腕セグメントに分布していた。 尺骨神経の下肘部位と上腕セグメントはより明白なCSA拡大を示した。 興味深いことに、手根管や立方トンネルなどの神経圧迫の一般的なサイトは、健康なコントロールと比較してMMN患者の一般的なCSAの増加を明らかにし

表1. MMNおよびH Cにおける正中神経および尺骨神経の異なる部位におけるCS A。

図1. 中央および尺骨神経における10のCSA部位の分布。 10mm2のラインは、他のセグメントから重要な異常CSAサイトを区別するように設定されました。 (A)正中神経の場合: M1-carpel cannelの出口、M2-手首の折り目の中間点、M3-carpel cannelの入口、M4-手首の折り目の近位4cm、M5-手首の折り目と肘の間の中間点、M6-pronator teresへの入り口、M7-肘、m8-肘の上4cm、m9-肘の上8cm、M10-腋窩。 (B)尺骨神経のために: U1-手首、u2-手首の上の4cm、U3-尺骨動脈からの出発点、U4-屈筋の手根尺骨の筋肉腹と一緒に、U5-立方トンネルの出口、U6-立方トンネルの内側、U7-立方トンネルの入口、u8-立方トンネルの入口に近い4cm、u9-立方トンネルの入口に近い8cm、U10-腋窩。 CS A、断面積;MMN、多巣性運動神経障害。
maxCSAとMedical Research Council Sum Score(Mrc)の相関
12人のMMN患者では、MMN患者の1人が仕事上の怪我で切断されたため、合計23の正中神経と23の尺骨神経が含まれていました。 神経の最大神経CSAとそれに対応する筋力との間の傾向は、以下の二つのタイプに分けられる(図2):(1)CSAが増加し、MRCが減少した。 (2)CSAが増加し、MRCは明らかな変化を示さなかった。
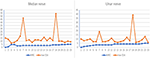
図2. 神経maxCSAとMRCの間の相関。 神経の最大神経断面積(CSA)と対応する筋力との間の傾向。 横軸は、切断のために側方神経を記録することができなかった23人の患者の12人の両側神経を示し、縦軸は神経断面積(mm2)または筋力評価を表す。 MRC、医学研究評議会の合計スコア;maxCSA、特定の神経の最大断面積。
CSAとCBの相関
運動NCSsでは、12の明確なCBと12の可能性のあるCB領域が中央神経と尺骨神経の標準セグメントにわたって検出されました。 超音波検査では、CSAの増加が36の部位で検出され、圧迫されやすいセグメントが除去された。 正中神経では、標準セグメントの最大CSAの中央値(P25、P75)は、CBのない人では10.3(8-12)mm2、CBのある人では21.22(8.5、38)mm2であった(Z=1.409、P=0.159)。 尺骨神経では、標準神経セグメントの最大CSAの中央値(P25、P75)は7.7であった(5。CBのないそれらのための8,7)mm2およびCBとのそれらのための6.25(5,8.25)mm2(Z=0.744、P=0.457)。
CBとcsaが増加した9つの標準セグメント(図3、ビデオ1)、CBと通常のCSAが増加した15セグメント(図4、ビデオ2)、CSAが増加したがCBがない27セグメント(図5、ビデオ3)があった。 部分伝導ブロックを用いた標準セグメント検出では伝導ブロックがほとんど確認されなかった五つのセグメントにわたってインチング技術と超音波による連続走査を行った。 インチング技術と超音波を組み合わせることにより、別の二つのセグメントは、同じサイトでCBsと増加したCSAを示し、3つのセグメントは、同じサイトでcbsが、正常なCSAを示した。
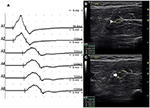
図3. モード1。 両側の手の進歩的な非対称的な弱さの28歳の男性4年。 検査では、手の尺骨神経神経支配筋肉(MRCグレード右3、左4)が明らかになった。 尺骨神経の左前腕セグメントにわたって使用されるインチング法は、MMNを有する一人の患者で同じ部位に伝導ブロックとCSAの拡大を示した。 (A)A1(潜時4.9m s、持続時間8.2m s、振幅1 4.8mv、領域3 8.2mvms、伝導速度6 6.6m/s)とA2(潜時5.2m s、持続時間8.2m s、振幅9.5mv、領域2 6.1mvms、伝導速度1 1.6m/s)の間 (B)白色の矢頭は、A1のCS Aが8mm2であることを示した。 (C)矢印は、A2のCS Aが1 9mm2(A1、エルボ−6cm;A2、エルボ−4cm;A3、エルボ−2cm)であったことを示す(ビデオ1)。 CSAの横断面区域;CBの伝導のブロック;l、左;r、右。
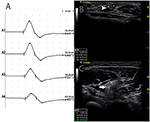
図4. モード2。 右上肢MRCグレード3と左4と両側上肢の進行性非対称衰弱の11年と46歳の女性は、同じサイトで伝導ブロックと正常なCSAを示しました。 (A)A1とA2の間に伝導ブロックが検出されました。 (B)白い矢頭は、A1で6mm2(潜時2.8m s、持続時間3.8m s、振幅1 2.4mv、領域1 3.3mvms、伝導速度5 0.9m/s)を示し、(C)矢印は、A2で8mm2(潜時6.8m s、持続時間3.9m s、 CSA、断面積; CB、伝導ブロック;l、左;r、右。
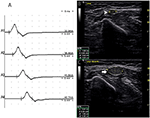
図5. モード3。 51歳の女性は、左上肢の衰弱とMRCグレード4の4年と対応する伝導ブロックなしでCSAの拡大を示した。 (A)左尺骨神経の標準セグメント運動神経伝導研究。 CBは検出されなかった。 尺骨神経の左上腕を横断する神経超音波検査は、(B)A3の部位で8mm2であったCS A(白矢頭)(潜時8.6m/s)および(C)左尺骨の肘に近位6cmの部位のCSA(矢印)は39mm2(潜時12.0ms、持続時間7.9ms、振幅8.4mv、面積19.5mvms、伝導速度18.2m/s)であったが、同じセグメント(A1、手首;A2、肘の下;A3、肘の上;A4、腋窩)にわたってCBは検出されなかった(ビデオ3)。 CSAの横断面区域;CBの伝導のブロック;l、左;r、右。
ディスカッション
電気生理学的研究は神経の生理学的特徴を反映し、超音波研究は神経の形態学的特徴を明らかにする。 MMNは運動神経のみが関与する運動C bとCSAとの相関を探索するための理想的なモデルの一つであり,CBは主な電気生理学的特徴である。 以前の研究は、CBとCSA(5、6、9)との間の相関を報告しているが、限られたサイトは、超音波下で神経連続スキャンせずに観察され、MMNの病変は、確率的に、常に
本研究では、神経全体に沿って連続走査を行い、異常部位のCSAを記録しました。 さらに、Cs Aを、1 0の所定の部位で測定した。 必要に応じてインチング技術を行った。 MMN患者のこのグループの疾患期間は長く、多様であり、超音波および電気生理学的特性に影響を与えている可能性があるが、我々はまだCSAとCBの間の関係の三つのモードを発見した:対応する神経CSA拡大を伴うCB(モード1)、対応する神経CSA拡大を伴わないCB(モード2)、および対応するCBなしの神経CSA拡大(モード3)。 その結果,CBはcsaの増加と常に相関するとは限らない。
CBとCSAの間のこれらの異なる相関パターンの潜在的なメカニズムはまだ不明である。 さらに、神経拡大の背後にある真の対応する病理学的症状は明確には明らかにされていない。 神経の低エコーの拡大は、活性炎症およびタマネギ球根を反映し得るが、追加の高エコー原性束/血管周囲組織を伴う神経の拡大は軸索変性を反映し得る(10)。 つまり、軸索および髄鞘病変の両方が神経CSAの拡大につながる可能性があります(11)。 モード2に関しては、対応するCS A拡大のないCBを容易に理解することができる。 現時点では、MMNは、Ranvierのノードで電圧ゲートNa+チャネルに対する抗GM1抗体損傷に関連する免疫媒介性運動神経障害と考えられている(12、13)。 理論的には、抗GM1抗体は軸索に直接および補体依存性の損傷を引き起こし、伝導ブロックにつながりますが、明らかなミエリン変化はないかもし Taylor et al. 抗体攻撃がパラノーマルミエリンの成分に向けられる可能性があると仮定し、MMN軸索病理学的変化がミエリン病理よりも優勢であることを見出した(14)。 また、MMNにおける正常なCSAとCBに関連する我々の知見は、主神経CSAは影響を受けないままであるのに対し、単一の束のみが拡大されているという事実の結
モード1(CBとcsaの増加)に関して、mmnにおけるCSAの増加が磁気共鳴画像法(MRI)(16)および他の超音波(3)研究で報告されている。 MMN患者は、神経に沿って同じサイトで多巣性神経CSA拡大と伝導ブロックを持っていたことを我々の発見は、CBのサイトでは、損傷した電圧ゲートNa+チャネルだけでなく、脱髄、浮腫、およびタマネギ球形成(6、17)などのいくつかの病変があったことを示唆している可能性がある。 このモードは,CBは異なるメカニズムによって引き起こされる可能性があり,MMNは症候群である可能性があることを示した。 MMNのすべての症例が抗GM1IgM抗体によって引き起こされるわけではなく、他の免疫プロセスも関与して脱髄/再髄鞘化および軸索変性/再生プロセス
モード3の機構にはさらなる探索が必要です。 MMNにおけるCBのない神経CSAの拡大、あるいは神経生理学的機能不全のない四肢も、他の報告(で発見された6、9、18)。 炎症性浸潤,浮腫,チャネル機能不全が早期にRanvierの節で発生すると,イオンチャネルの脱分極しきい値は正常範囲にとどまり,塩刺激伝達の機能不全はまだ達しておらず,CBは検出できないと仮定した。 MMN患者では、CBなしでCSAの増加が検出された場合、神経の形態学的変化も臨床的意義を有するはずである。 神経に沿った連続走査および形態学的変化を検出するためのより多くの部位での測定は、MMNの診断感度を高める可能性がある。
結論として、CBとCSAの間には三つの相関パターンが存在し、電気生理学的および形態学的変化はMMNで常に一貫していなかった。 超音波検査では、CBがなくても、MMNの神経に沿ったより多くの病変を検出することができました。 モーター NCSと超音波研究の組み合わせは、MMNの臨床診断のためのより多くの情報を提供することができます。
これは、単一のパラメータ比較、断面研究でした。 本研究におけるMMN患者の異なる疾患期間は、それらの様々な高さ、重量に加えて、神経CSAおよび神経伝導速度検出に影響を与える可能性がある。 さらに、我々は、運動神経CBが提示され、超音波上のCsaに関連する変化があったかどうかを観察しただけであり、CBとCSAの間の相関の異なるパターンの潜在的 最も重要なパラメータである神経CSAのみがこの研究に含まれていたので、より正確な研究を行うためには、エコー強度のようなより多くの指標が関与す
データ利用可能性に関する声明
記事内で公開されていないデータは利用可能であり、資格のある研究者からの要求に応じて共有されます。
倫理声明
北京連合医科大学病院の倫理委員会は、私たちの研究プロトコルを承認し、すべての患者はヘルシンキ宣言に従ってインフォームドコンセントフォームに署名しました。
著者の貢献
YL:電気生理学的および超音波研究、データの取得、統計分析、および原稿執筆。 JN:電気生理学的および超音波学的研究および統計分析。 LC:研究のコンセプトとデザインと原稿編集。 TL:データ収集と原稿編集。 QD:電気生理学的および超音波学的研究。 SWおよびYG:電気生理学的研究。 ML:調査の概念および設計、データ検討、原稿の編集、および重大な修正。
利益相反
MLは北京首都特別基金(Z171100001017220)からの支援を受けた。
残りの著者らは、この研究は利益相反の可能性があると解釈される可能性のある商業的または財政的関係がない場合に行われたと宣言している。
謝辞
我々は、北京首都特別基金(Z171100001017220)からの資金提供を感謝する。
補足資料
この記事の補足資料はオンラインで見つけることができます: https://www.frontiersin.org/articles/10.3389/fneur.2019.01055/full#supplementary-material
ビデオ1. モード1: MMNの同じ部位での伝導ブロックとCSAの拡大。
動画2. モード2:MMNの同じ場所の伝導のブロックそして正常なCSA。
動画3. モード3:対応する伝導のブロックのないCSAの拡大。
略語
MMN、多巣性運動神経障害、CB、運動神経伝導ブロック、CSA、断面積、NCS、運動神経伝導研究。
1. Parry GJ,Clarke S.多巣性後天性脱髄性ニューロパチーは運動ニューロン疾患を装っている。 筋肉神経。 (1988) 11:103–7. 土井:10.1002/mus.880110203
PubMed要約/CrossRef全文/Google Scholar
2. Grimm A、Rattay TW、Winter N、Axer H.末梢神経超音波スコアリングシステム:ベンチマークと比較分析。 Jニューロル… (2017) 264:243–53. ドイ:10.1007/s00415-016-8305-y
Pubmed要約/CrossRef全文|Google Scholar
3. Rattay TW,Winter N,Decard BF,Dammeier NM,Hartig F,Ceanga M,et al. 扱われたmultifocalモーターニューロパシーのフォローアップ用具として神経の超音波。 ユール-ジュロル (2017) 24:1125–34. 土井:10.1111/ene.13344
Pubmed要約/CrossRef全文/Google Scholar
4. Loewenbruck KF,Liesenberg J,Dittrich M,Schafer J,Patzner B,Trausch B,et al. 多巣性運動神経障害(MMN)および優勢な下部運動ニューロン疾患(ALS/LMND)を伴う筋萎縮性側索硬化症の分化における神経超音波。 Jニューロル… (2016) 263:35–44. ドイ:10.1007/s00415-015-7927-9
PubMed Abstract|CrossRef全文|Google Scholar
5. Kerasnoudis A,Pitarokoili K,Behrendt V,Gold R,Yoonさん多巣性運動神経障害: 神経超音波、電気生理学的、および臨床所見の相関。 ジェファーソン-ネルヴィスト(Jeferon Nervist)。 (2014) 19:165–74. doi:10.1111/jns5.12067
PubMed要約/CrossRef全文/Google Scholar
6. Beekman R,van den Berg LH,Franssen H,Visser LH,van Asseldonk JT,Wokke JH. 超音波検査では多巣性運動神経障害において広範な神経拡大を示した。 神経内科 (2005) 65:305–7. 土井:10.1212/01.wnl.0000169179.67764.30
Pubmed要約/CrossRef全文/Google Scholar
7. Olney RK、Lewis RA、Putnam TD、Campellone JV Jr.多巣性運動神経障害の診断のためのコンセンサス基準。 筋肉神経。 (2003) 27:117–21. 土井:10.1002/mus.10317
Pubmed要約/CrossRef全文/Google Scholar
8. Niu J、Cui L、Liu M.慢性炎症性脱髄性多発性神経障害からcharcot-marie-toothタイプ1Aを区別する際の末梢神経の複数のサイト超音波検査。 前のページへ:前のページへ: (2017) 8:181. ドイ:10.3389/fneur.2017.00181
PubMed要約/CrossRef全文/Google Scholar
9. Pitarokoili K、ゴールドR、ユンさん伝導ブロックのない多巣性運動神経障害の場合の神経超音波。 筋肉神経。 (2015) 52:294–9. 土井:10.1002/mus.24583
Pubmed要約/CrossRef全文/Google Scholar
10. Hartig F,Ross M,Dammeier NM,Fedtke N,Heiling B,Axer H,et al. 神経超音波は、慢性炎症性脱髄性多発性神経障害における治療応答を予測する-将来のフォローアップ。 神経治療薬。 (2018) 15:439–51. 土井:10.1007/s13311-018-0609-4
PubMed Abstract|CrossRef全文|Google Scholar
11. Tsukamoto H,Granata G,Coraci D,Paolasso I,Padua L.腓骨頭における共通腓骨神経伝導ブロックにおける超音波と神経生理学的相関。 クリン-ニューロフィジオール (2014) 125:1491–5. 土井:10.1016/j.clinph.2013.11.041
PubMed要約/CrossRef全文/Google Scholar
12. Harschnitz O,Jongbloed BA,Franssen H,Straver DC,van der Pol WL,van den Berg lh. MMN: from immunological cross-talk to conduction block. J Clin Immunol. (2014) 34(Suppl 1):S112–9. doi: 10.1007/s10875-014-0026-3
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Franssen H. The node of Ranvier in multifocal motor neuropathy. J Clin Immunol. (2014) 34(Suppl 1):S105–11. doi: 10.1007/s10875-014-0023-6
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Taylor BV, Dyck PJ, Engelstad J, Gruener G, Grant I, Dyck PJ. Multifocal motor neuropathy: 伝導ブロックの部位での病理学的変化。 JニューロパトールExp Neurol. (2004) 63:129–37. doi:10.1093/jnen/63.2.129
PubMed要約/CrossRef全文/Google Scholar
15. Grimm A,Winter N,Rattay TW,Hartig F,Dammeier NM,Auffenberg E,et al. 健康なコントロールと多発性神経障害を持つ患者における神経束の神経形態の内部を見てください。 クリン-ニューロフィジオール (2017) 128:2521–6. 土井:10.1016/j.clinph.2017.08.022
PubMed要約/CrossRef全文/Google Scholar
16. Haakma W,Jongbloed BA,Froeling M,Goedee HS,Bos C,Leemans A,et al. MRIでは,多巣性運動神経障害における正中神経および尺骨神経における肥厚および変化した拡散を示した。 ユーロラジオール (2017) 27:2216–24. ドイ:10.1007/s00330-016-4575-0
PubMed Abstract|CrossRef全文|Google Scholar
17. 梶R,岡N,辻T,目崎T,西尾T,秋口I,et al. 多巣性運動神経障害における伝導ブロック部位の病理学的所見。 アン-ノイロール (1993) 33:152–8. 土井:10.1002/ana.410330204
Pubmed要約/CrossRef全文/Google Scholar
18. ガヤルドE、能登Y、サイモンNG。 末梢神経障害の診断における超音波:構造は神経筋クリニックで機能を満たす。 J Neurol脳神経外科精神科. (2015) 86:1066–74. 土井:10.1136/jnnp-2014-309599
PubMed Abstract/CrossRef Full Text/Google Scholar