17.3:錯体イオンの形成
錯体イオンの形成が溶解度に及ぼす影響
安定な錯体イオンを形成する配位子を溶液に添加すると、難溶性の塩の溶解度はどうなるか。 そのような例の1つは、従来の白黒写真で発生します。 白黒写真フィルムには、AgBrの感光性微結晶、またはAgBrと他のハロゲン化銀の混合物が含まれていることを思い出してください。 AgBrは難溶性の塩であり、kspは5.35×10-13で25℃である。 カメラのシャッターが開くと、撮影された物体からの光がフィルム上の結晶の一部に当たり、AgBrを黒色のAg金属に変換する光化学反応を開始する。 よく形成された安定した負の画像は、変換されたAgBrの粒子の数に対応する灰色の色調で表示され、最も明るい領域が最も暗い領域にさらされます。 画像を固定し、フィルムの処理中により多くのAgBr結晶がAg金属に変換されるのを防ぐために、フィルム上の未反応のAgBrを錯化反応を用いて除去し、難溶
臭化銀の溶解に対する反応は以下の通りである:
\
と
\
平衡ははるかに左にあり、Ag+とBr−イオンの平衡濃度は非常に低い(7.31×10-7M)。 その結果、純粋な水を使用してフィルムの単一ロールから未反応AgBrを取除くことは数万リットルの水および大量の時間を要求する。 しかし、Le Chatelierの原則は、より多くのAgBrが溶解する原因となる生成物のいずれかを除去することによって、反応を右に動かすことができることを示してい 臭化物イオンは化学的に除去することは困難であるが、銀イオンはアンモニアのような中性配位子、またはシアン化物やチオ硫酸塩(S2O32-)のような陰イオン配位子と様々な安定な二配位錯体を形成する。 写真加工では、過剰なAgBrは、チオ硫酸ナトリウムの濃縮溶液を用いて溶解される。
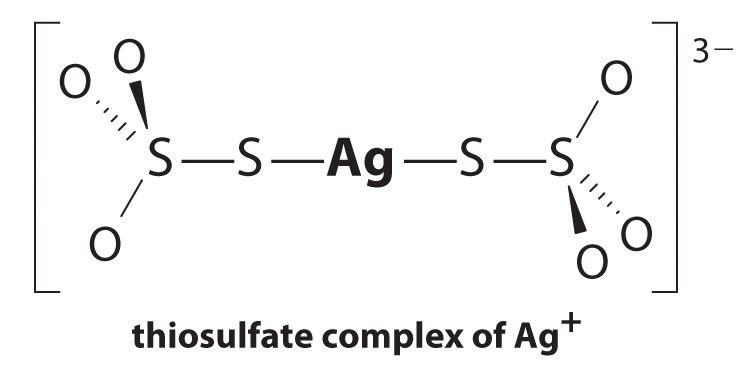
Ag+とチオ硫酸塩との反応は以下の通りである:
\^{3−}_{(aq)}\label{17.3.
\
平衡定数の大きさは、溶液中のほとんどすべてのAg+イオンが直ちにチオ硫酸塩によって錯体化されて3−を形成することを示している。 適切な反応を記述し、それらを一緒に添加することによって、AgBrの溶解度に及ぼすチオ硫酸塩の効果を見ることができます:
\\ \これは、Ag\Mathrm{Ag^+(aq)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{3{3-}(aq)}\hspace{3mm}K_\textrm f&=2です。9\10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=15端\{整列}\ラベル{17.3.6}\)
KとKspを比較すると、錯体イオンの形成はAgBrの溶解度を約3×1013増加させることが示されている。 低コストと低毒性と組み合わせた溶解度の劇的な増加は、チオ硫酸ナトリウムが白黒フィルムの開発にほぼ普遍的に使用されている理由を説明 必要に応じて、銀は、いくつかの方法のいずれかを使用してチオ硫酸塩溶液から回収され、リサイクルされ得る。
複雑なイオンが大きなKfを有する場合、複雑なイオンの形成は難溶性塩の溶解度を劇的に増加させる可能性がある。
例\(\PageIndex{2}\)
一般的なイオン効果のために、AgClのような塩は、水よりもKClの濃縮溶液中ではるかに可溶性が低いと予想されるかもしれません。 しかし、銀イオンが塩化物イオン(Agcl2-)と二配位錯体を形成する傾向があるという事実を無視しているため、このような仮定は間違っているだろう。 それぞれの状況におけるAgClの溶解度を計算する:
- 純粋な水
- 1.0M KCl溶液中で、任意の錯体イオンの形成を無視して
- 複雑なイオンの形成を考慮に入れて、Agcl2−が有意な濃度
で形成される唯一のAg+錯体であると仮定することを除いて、AgClおよびKf=1に対してKsp=1.77×10-10である。Agcl2のための1×105-。
与えられた:AgClのKsp、Agcl2−のKf、およびKCl濃度
求められた:複合イオンの形成の有無にかかわらず、水およびKCl溶液中のAgClの溶解度
戦略:
- AgClの溶解度積式を記述し、水中のAg+とCl−の濃度を計算します。
- KCl溶液中のAg+の濃度を計算します。
- AgClの溶解とAgcl2複合体の形成のための平衡化学式を書く。 2つの方程式を追加し、全体的な平衡の平衡定数を計算します。
- 反応全体の平衡定数式を書きます。 複雑なイオンの濃度を解く。
溶液
- a XをAgClの溶解度と等しくすると、平衡==X Mになります。,
従って25°Cの純粋な水のagclの容解性は1.33×10-5Mです。
- B xがKcl溶液中のAgClの溶解度に等しい場合、平衡状態で=X Mおよび=(1.0+x)M.これらの値を溶解度積式に代入し、xがKcl溶液中のAgClの溶解度に等しいと仮定<< 1.0,
共通のイオン効果が唯一の重要な要因であった場合、AgClは水よりも1.0M KCl溶液に約五桁溶けにくいと予測される。
- c錯体イオンの形成の影響を説明するためには、まず錯体イオンの溶解と形成の両方の平衡方程式を記述する必要があります。 KspとKfに対応する式を追加すると、Kcl溶液中のAgClの溶解を記述する式が得られます。 したがって、反応の平衡定数はKspとKfの積である。:
\\ \これは、次のようになります。\Mathrm{Ag^+(aq)}+\mathrm{2cl^{-}}\rightleftharpoons\mathrm{3{-}}\hspace{3mm}K_\textrm f&=1.1\times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\1.9\times10^{-5}\end{align}\)
D我々はxがKCl溶液中のAgClの溶解度に等しいとすると、平衡=xと=1.0−xで。<< 1.0,
運動\(\PageIndex{2}\)
それぞれの状況におけるヨウ化水銀(II)(Hgi2)の溶解度を計算する:
- 純粋な水
- NaIの3.0M溶液で、2−が有意な量で存在する唯一のHg含有種であると仮定すると
Hgi2ではKsp=2.9×10-29、2−ではKf=6.8×1029。
回答
- 1.9 × 10-10 M
- 1.4メートル
可溶性金属錯体を形成することによって金属塩の溶解度を増加させる錯化剤、分子またはイオンは、洗濯洗剤の一般的な成分である。 石鹸の主要成分である長鎖カルボン酸は、「硬質」水中に高濃度で存在するCa2+およびMg2+と不溶性塩を形成する。 これらの塩の沈殿物は浴槽リングを生成し、衣類に灰色の色合いを与える。 ピロリン酸塩(O3POPO34−、かP2O74−)または三リン酸塩(P3O105−)のような錯化の代理店を洗剤に加えることは複雑イオン形成のための平衡定数が大きい:
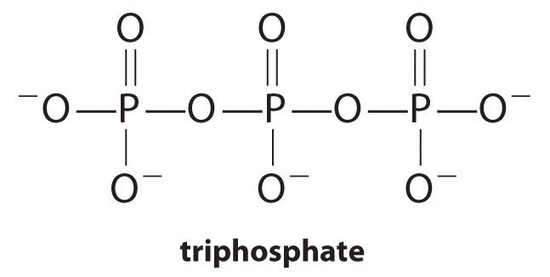
しかし、リン酸塩は、富栄養化、魚や他の水生生物を殺す溶存酸素のレベルの大幅な減少に最終的につながることができ、水の体内で藻類の過剰な量の成長を促進することにより、環境損傷を引き起こす可能性があります。 その結果、米国の多くの州ではリン酸塩含有洗剤の使用が禁止されており、フランスは2007年からその使用を禁止しています。 「リン酸を含まない」洗剤は、酢酸または他のカルボン酸の誘導体などの異なる種類の錯化剤を含有する。 リン酸代用品の開発は、激しい研究の分野です。
市販の軟水軟化剤は、複合ナトリウム塩であるイオン交換樹脂に水を通すことによって硬水を処理するために錯化剤を使用しています。 水が樹脂の上を流れると、ナトリウムイオンが溶解し、不溶性塩が樹脂表面に沈殿する。 このように処理された水は、Na+の存在のために塩辛い味を有するが、それはより少ない溶解ミネラルを含む。
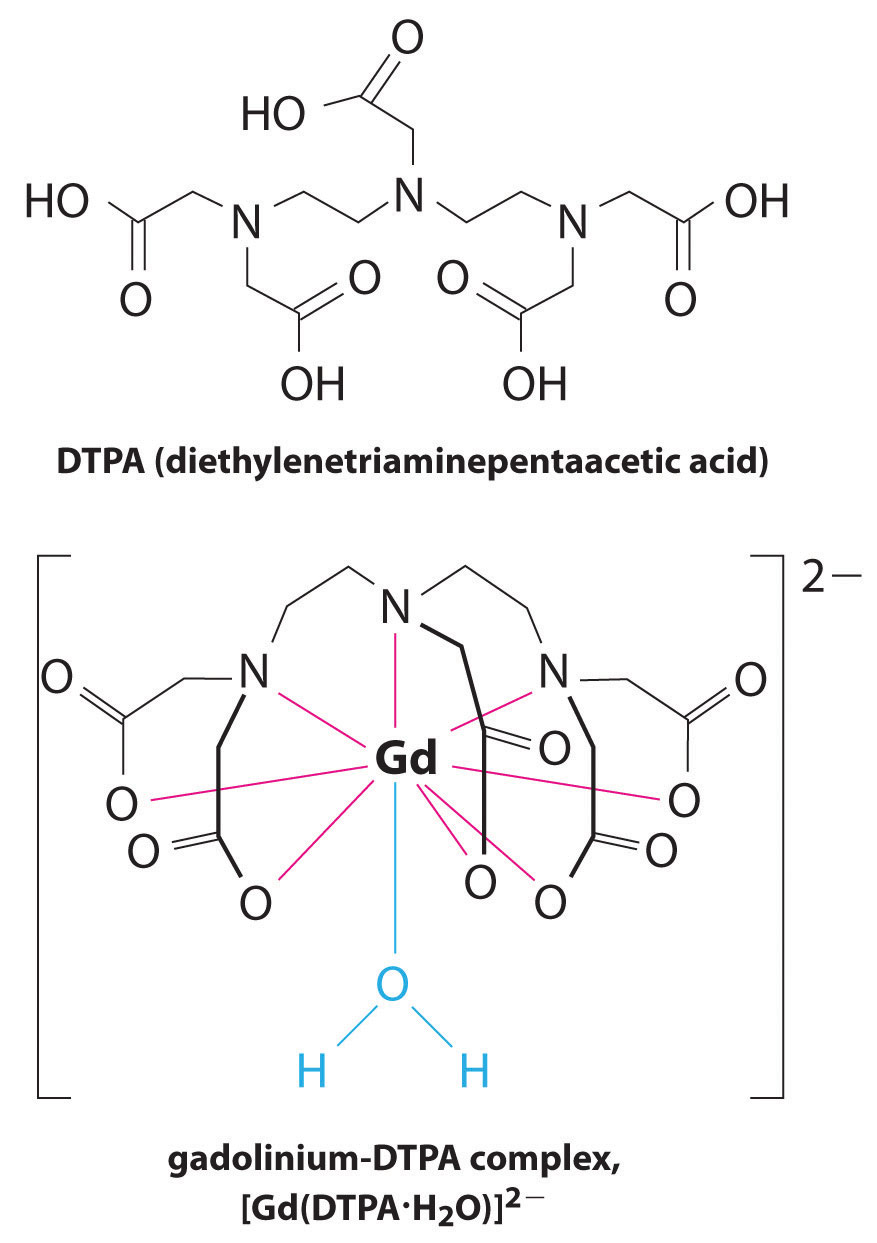
錯化剤の別の応用は医学に見られる。 X線とは異なり、磁気共鳴画像法(MRI)は、内臓などの軟部組織の比較的良好な画像を与えることができる。 MRIは、軟部組織の主要な構成要素である水中の水素原子の1H核の磁気特性に基づいています。 水の性質は、細胞内にあるのか血液中にあるのかにあまり依存しないため、コントラストの良いこれらの組織の詳細な画像を得ることは困難です。 この問題を解決するために、科学者たちは、”MRI造影剤”として知られている金属錯体のクラスを開発しました。”患者にMRI造影剤を注入することは、正常組織の細胞、腫瘍、または血管の水の磁気特性に選択的に影響し、医師はこれらのそれぞれを別々に”見る”ことがで このアプリケーションのための最も重要な金属イオンの一つは、七つの不対電子と非常に常磁性であるGd3+です。 Gd3+(aq)は非常に毒性があるため、体内で解離せず、腎臓によってそのまま排泄される非常に安定した複合体として投与されなければならない。 ガドリニウムに使用される錯化剤は、DTPA5−(ジエチレントリアミン五酢酸)のような配位子であり、その完全にプロトン化された形態がここに示されている。
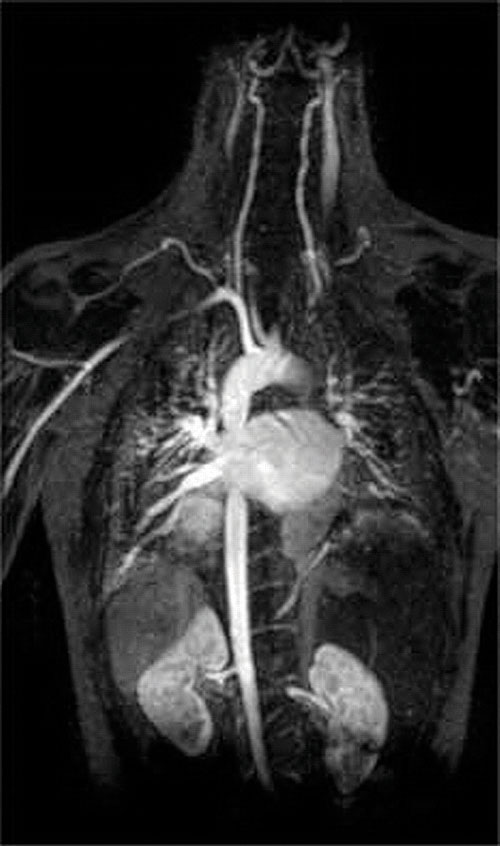
図\(\PageIndex{2}\):心臓、動脈、および静脈のMRI画像。 患者にMRI造影剤として知られる安定した複合体の形で常磁性金属カチオンを注入すると、細胞内の水の磁気特性が変化する。 異なるタイプの細胞における異なる環境は異なる反応を示すので、医師は軟組織の詳細な画像を得ることができる。