2.3:一酸化炭素とバックボーン
一般的な特性
COは、結合時に金属中心の酸化状態に影響を与えないが、総電子数を二単位増加させる与格のL型配位子である。 我々は最近、カルボニル配位子に実際に2つの結合相互作用があることを見てきました:配位子-金属n→d π相互作用と金属-リガンドdn→π*相互作用。 後者の相互作用は、金属が電子密度を配位子に還元するため、バックボンドと呼ばれます。 バックボーンの存在を思い出させるために、私は可能な限り右手の共鳴構造を使用するのが好きですが、どの共鳴形態が描かれていてもCOをL型配位子として扱うことを覚えておくことが重要です。

M=C=Oにおける軌道相互作用
COは強いπ供与体(またはπ塩基)であり、良好なπ受容体(またはπ酸)である。 結紮されたCOの特性は金属中心の同一性に深く依存する。 より具体的には、金属中心の電子特性は、金属カルボニル錯体におけるバックボンドの重要性を決定する。 最もぶっきらぼうに、より多くの電子が豊富な金属中心はCOにbackbondingで優れています。 バックボーンの強さを確認することが重要なのはなぜですか?
赤外分光法は、バックボンドのアイデアを経験的に支持するために有名に使用されてきました。 以下の表は、いくつかの金属カルボニル錯体を”周期的”な順序で並べ、C=O延伸モードに対応する周波数を提供する。 例外なく、すべての複合体化COは、自由COのそれよりも低い伸張頻度を有することに留意されたい。 バックボンドは責任があります! 錯体化した一酸化炭素中のC–O結合次数は(ほとんど常に)遊離C Oのそれよりも低い。

金属-カルボニル錯体におけるC=O延伸周波数。 何かがここでオフに見えるのですか?
上の図は、周期表を左から右に移動するときの周波数の明確な増加(C–O結合次数の増加)を示しています。 この発見は、中性金属中のd電子の数が左から右に移動するにつれて増加すると考えると奇妙に見えるかもしれません。 より多くのd電子を持つ金属中心は、バックボンド(およびより多くの”電子リッチ”)で優れているべきではありませんか? ここで何が起こってるの? 軌道エネルギーの周期的な傾向を思い出してください。 左から右に移動すると、d軌道エネルギーは減少し、dn軌道とπ*軌道のエネルギーは分離します。 その結果、より電気陰性の後期遷移金属に向かって移動するにつれて、バックボーン軌道相互作用は悪化します(強い軌道相互作用にはよく一致した軌道 有機化学からエナミンとエノールエーテルに類推することができます。 エノールエーテル中のより電気陰性酸素原子は、エナミンの窒素原子よりも悪い電子供与体である。

バックボンドの重要性は、金属の電気陰性度とその電子密度に依存する。
もちろん、金属中心上の他の配位子のバックボンドへの寄与も忘れられません。 論理的には、電子供与性配位子はバックボンドをより強くする傾向があり(金属をより良い電子供与体にする)、電子吸引性配位子はバックボンドを悪化させる。 例えば,金属中心に電子に富むホスフィン配位子を添加すると,バックボンドの改善によりC O延伸周波数が減少する。
カルボニル配位子は、複数の金属中心を橋渡しすることができることで有名です。 架橋カルボニル錯体における結合は、錯体の構造および架橋モードに応じて、”伝統的”または非局在化のいずれかであり得る。 架橋モードの多様性は,CO配位子上に存在する異なる電子供与体と受容体(および非局在化結合の可能性)に由来する。 既知のブリッジモードを下の図に示します。
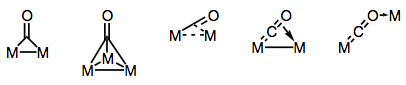
カルボニル配位子を持つ橋を構築!