7.5:複合体IV
複合体IVは電子輸送鎖の最終目的地です。 ここで、呼吸超複合体の他のメンバーを通って移動してきた電子は、最終的に水にそれを減少させ、O2に配信されます。 電子の最初の添加と水の最終的な放出の間に多くの活性酸素種が形成されなければならないが、反応は細胞損傷の可能性が最小限に抑えられるよ 同時に、より多くの陽子が内部ミトコンドリア膜を横切って励起される。
- 複合体IVでは、電子は最終目的地であるO2分子に送達されます。
- O2は水に還元されます。
運動\(\PageIndex{1}\)
酸素分子を水に還元するために必要な電子の数を示すために、バランスの取れた酸化還元半反応を書いてください。
答え
O2→H2O
O2→2H2O(oバランス)
O2+4h+→2H2O(hバランス)
O2+4e-+4H+→2H2O(電荷バランス)
O2+4e-+4H+→2H2O(電荷バランス)
O2+4e-+4H+→2H2O(電荷バランス)
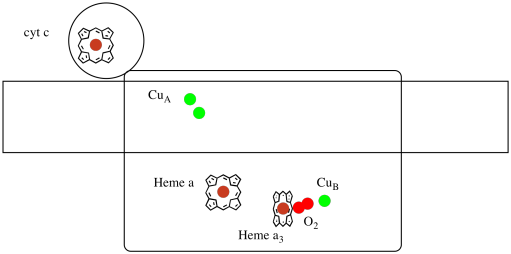
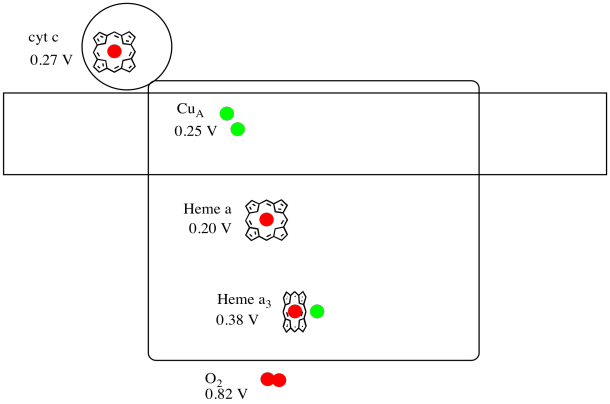
複合体IVのX線構造を以下に示す。 ここでも、行列は画像の下端にあり、膜間空間は上部にあります。 そこにシトクロムcがドッキングしています
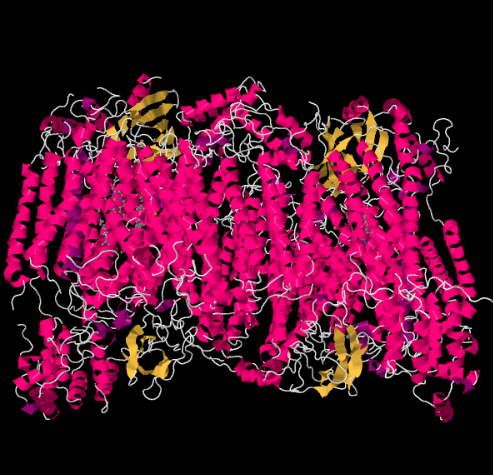
移動電子キャリア、シトクロムcは、複合体IVで結合し、CuAと呼ばれる二核銅サイトに電子を送達します。 下のタンパク質の内部を見ると、その二核銅サイトがわかります。 それはタンパク質と他には何も結合していないので、私たちは写真の上部に二つの銅イオンを自分で見ています。 銅原子のこのペアは、あなたが下と左に見ることができるヘム、シトクロムa、に電子を送信します。 そこから、電子は別の二核クラスターに進み、今度はヘム結合した鉄(シトクロムa3)と近くの銅(CuB)からなる。 この二核サイトは、二酸素の水への還元を行う。 この構造では、シトクロムa3とCuBの間の活性部位に結合した一酸化炭素分子が存在する。 炭素原子は鉄に結合し、酸素は銅に結合する。 それは酸素分子が結合し、水に還元されるのを待っている場所です。
それについて考えると、電子は最初の三つの錯体で見たものとは反対の方向に移動していることを意味します。 複合体iおよびIIでは,電子はミトコンドリアマトリックスから送達され,膜間空間に向かって移動し,ミトコンドリア膜のユビキノンで停止した。 複合体IIIでは,電子はミトコンドリア膜から膜間空間のシトクロムcまでその”上向き”方向に続いた。 複雑なIVでは、電子はコースを逆転させ、mitochondrialマトリックスの方に戻って移動しています。 覚えておいてください、ミトコンドリアマトリックスは陽子ポンピングのためにnドープされているので、これらの電子は膜の正の側から負の側に移動しています。 それは難しいに違いない。
- 錯体IVでは、電子輸送は他の錯体とは反対方向にある。
- 電子は電荷勾配に対して膜間空間側からミトコンドリアマトリックス側に移動する。
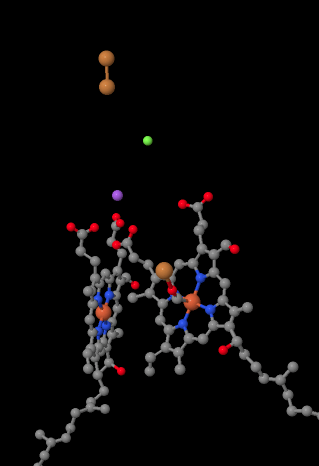
複合体の重要な配位子をもう一度見てみましょう。 漫画を以下に示します。 漫画では、O2分子はヘムa3とカブの間のその位置で結合していることが示されています。 その二核金属部位は、酸素分子が水に還元される場所である。
O2をH2Oに還元するには四つの電子が必要であるため、その還元が進む前に四つのシトクロムc分子が複合体IVで結合しなければならない。 酸素分子の配位環境は、過酸化物のような細胞内に持続する活性酸素種を形成するのではなく、二つの金属の間で、単に一つに結合するのではなく、水に至るまでより迅速に減少させることができる可能性が高い。
運動\(\ページのインデックスを作成します。\(\ページのインデックスを作成します。\(\ページのインデックスを{2}\)
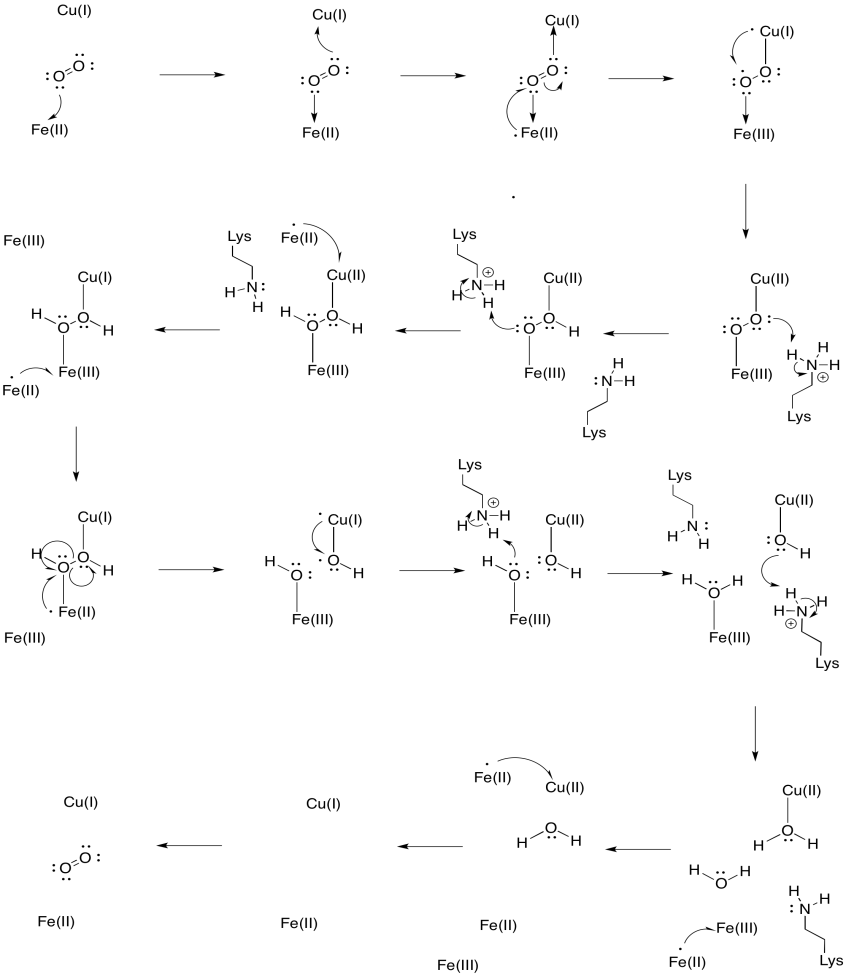
ヘムa3の鉄は還元されたFe(II)状態で始まり、カブは還元されたCu(I)状態で始まると仮定します。 4つの電子と4つの陽子を加えて、酸素を水に還元するメカニズムを提供します。 電子供与体としてFe(II)を使用し、プロトン供与体としてリジンを使用する。
これら二つの金属に加えて、カブに結合した修飾ヒスチジン-チロシン共役も存在する。 このチロシンは還元に使用される可能性のある即時電子の別の供給源を提供することが示唆されている。
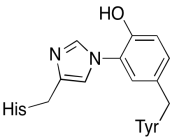
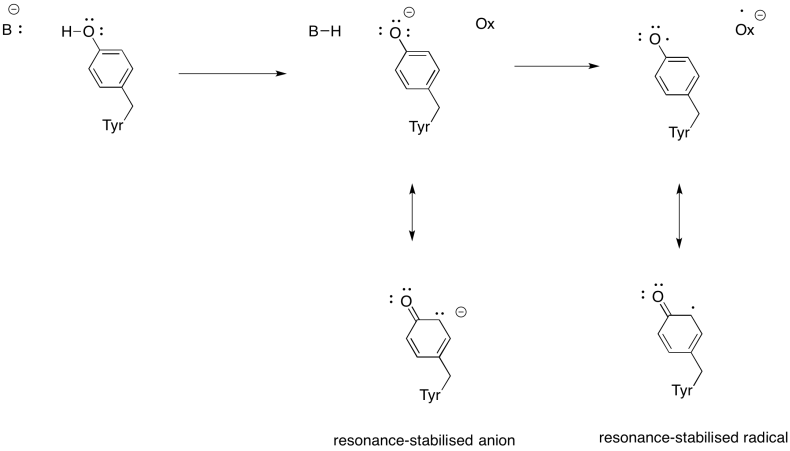
運動\(\PageIndex{3}\)
チロシンは、生化学的プロセスにおけるプロトンと電子の両方のソースになることができる理由を示しています。
酸素を水に還元する必要性に加えて、複合体IVはプロトン勾配にも寄与し、ミトコンドリア膜を横切って追加のプロトンをポンピングする。 そのタスクは、追加の課題を提示します。 電子が反対方向に移動しているので、単純な結合機構は不可能である。 それはメカニズムが金属が酸化状態を変えると同時に起こる蛋白質のconformational変更を含むことしかしあります。 調整の環境の微妙な変更は近くのアミノ酸の残余の変位で起因するかもしれません。 特定のアミノ酸が膜間空間に向かって上方にシフトすると、それがプロトンを引っ張る可能性があることを想像するのは簡単です。
- 陽子ポンピングと電子輸送は、複素IVでは反対方向に実行され、結合されていなければなりません。
- 複合体IVにおけるプロトンポンプは、立体配座変化に依存しなければならない。
運動\(\PageIndex{4}\)
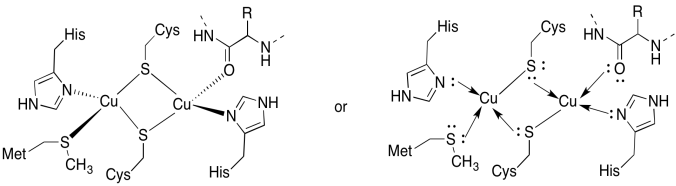
CuAサイトには二つの銅が含まれており、二つの橋渡しシステインによって支えられています。 両方とも末端ヒスチジンによって結合される。 さらに、一方の銅は付加的なメチオニンによって結合され、他方はタンパク質骨格からのカルボニルによって結合される。
- 結合部位に銅を引きます。
- 各銅の形状を記述します。
- 各銅がCu(I)の場合、錯体中の各銅の配位電子数は何ですか?
- 各銅がCu(I)の場合、複合体の全体電荷は何ですか?
回答a)
a)
Cu(I)=d10
4ドナー=8e-
合計=18e-
回答d)
d)2x Cu(I)=d10
4ドナー=8e-
合計=18E-
回答d)
d)2x Cu(I)=d10
4ドナー=8e-
合計=18e-
回答d)
d)2x Cu(I) = 2+
2 x Cys-S- = 2-
その他全てニュートラル
合計= 0
運動\(\PageIndex{5}\)
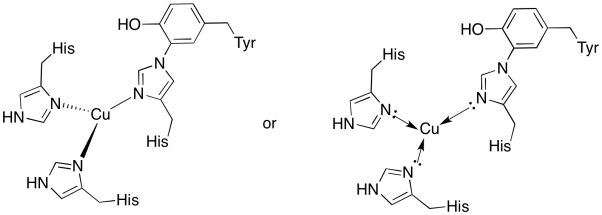
カブサイトの銅は、二つのヒスチジンとヒスチジン-チロシン共役によって結合されている。
- 結合部位に銅を引きます。
- 銅の形状を記述します。
- 銅がCu(I)の場合、錯体中の配位電子数は何ですか?
- 銅がCu(I)の場合、錯体の全体電荷は何ですか?
回答a)
a)
<564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564><564>) = 1+
ヒスチジン中性
合計= 1+
運動\(\PageIndex{6}\)
蛋白質内の個々の場所の減少の潜在性を測定することは困難である。 しかし、研究者は様々な条件下でEPRスペクトルを測定することによってこれらの値を推定することができました。 以下の還元電位を仮定して、シトクロムcから分子酸素への電子の輸送のための反応進行図を描く。
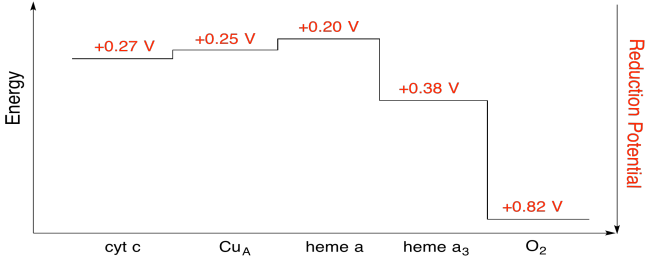
運動\(\PageIndex{7}\)
上の図の値を使用して、電子がヘムaからヘムa3に移動したときのエネルギー変化を計算します。還元電位を仮定すると、
ヘムa3(ox)+e-→ヘムa3(red)Eored=0.20V
ヘムa3(ox)+e-→ヘムa3(red)Eored=0.20Vとなる。38V
次に、反応の電位差、Δ Eo=0.38-(0.20)V=0.18V.
ファラデー関係Δ G=-n F Δ Eoは
Δ G=-1×96,485J V-1mol-1×0.13V=17,367J mol-1=17.4kJ molを与える-1
帰属
Chris P Schaller,Ph.D.,(聖ベネディクト大学/聖ヨハネ大学)