3.3 시클로 헥산의 형태
시클로 헥산의 형태
시클로 헥산의 평면 구조는 분명히 불가능합니다. 결합 각도는 반드시 120,000,000,000,10.5,000,000 이상적인 사면체 각도보다 큰 것입니다. 또한 이러한 구조의 모든 탄소-탄소 결합은 가려집니다. 그 결과 각도와 가리는 균주는이 구조를 심각하게 불안정하게 만듭니다. 6 원 링의 반대편에있는 두 개의 탄소 원자가 링의 평면에서 들어 올려지면 각도 변형의 대부분을 제거 할 수 있습니다.
이 보트 구조는 여전히 두 개의 가려진 결합과 보트의”활”과”선미”에 두 개의 수소 원자가 심하게 군집되어 있습니다. 이 입체 군집은 종종 입체 장애라고합니다. 보트 형태를 비틀면 입체적인 방해가 부분적으로 완화 될 수 있지만 트위스트 보트 컨 포머는 여전히 보트 컨 포머를 특징 짓는 균주 중 일부를 유지합니다. 마지막으로,하나의 탄소를 링 평면 위로 들어 올리고 다른 탄소를 평면 아래로 들어 올리면 상대적으로 변형이없는’의자’컨 포머가 형성됩니다. 이것은 시클로 헥산 분자에 의해 채택 된 주된 구조입니다.
시클로 헥산의 형태에 관한 조사는 에이치 삭스(1890)와 이 모어(1918)에 의해 시작되었지만,1950 년까지는 바튼(노벨상 1969 년 하셀과 함께)에 의해 의자 컨 포머의 상호 전환의 다양한 결과와 늘어진 결합의 다른 방향에 대한 완전한 치료가 설명되지 않았다. 뒤에 오는 면담은 이 구조적 분석의 근본적인 특징의 어떤을 선물한다.
시클로 헥산의 의자 형태를 면밀히 살펴보면,12 개의 수소가 구조적으로 동등하지 않다는 것을 알 수 있다. 그 중 6 개는 탄소 고리의 주변에 위치하며 적도라고합니다. 다른 6 개는 반지의 대략 비행기(각 위치에서 3)의 위 그리고 아래에 동쪽으로 향하게 하고,반지의 대칭 축선에 평행하게 맞추어지기 때문에 축이라고 불립니다.
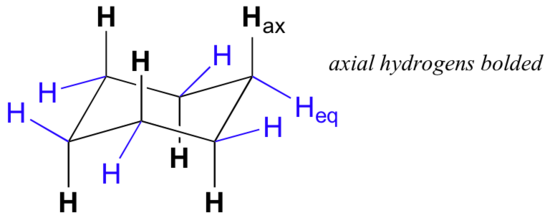
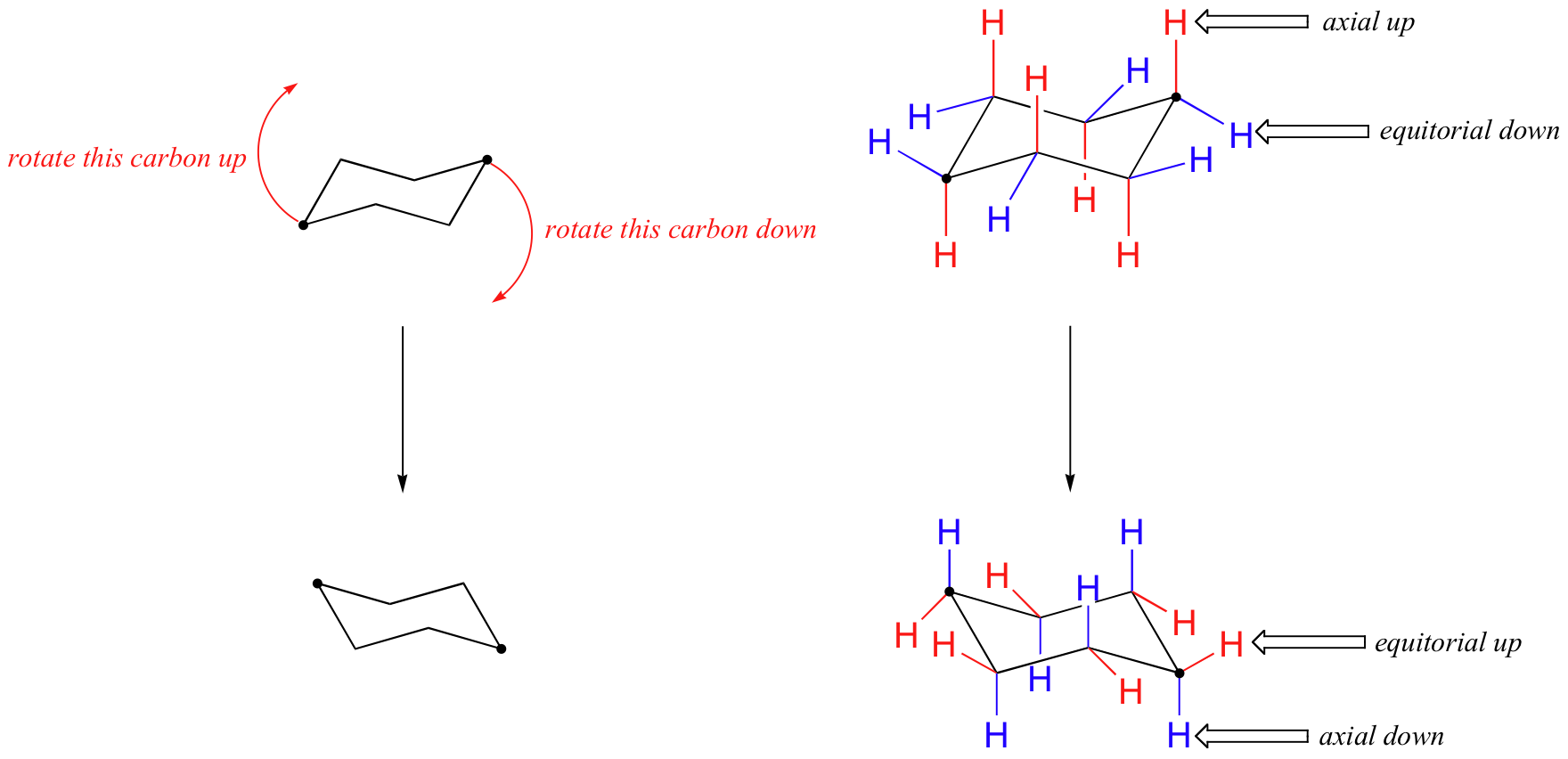
위의 그림에서 적도 수소는 파란색으로 표시되고 축 수소는 굵게 표시됩니다. 빠른 평형 상태에서 시클로 헥산의 두 가지 동등한 의자 형태가 있기 때문에 12 개의 모든 수소는 50%적도 및 50%축 특성을 갖습니다. 아래 그림은 시클로 헥산의 분자 모델을 두 개의 서로 다른 의자 형태 사이에서 변환하는 방법을 보여줍니다.이 모델은 모델로 연습해야합니다. ‘링 플립’은 적도 수소를 축 방향으로 만들고 그 반대도 마찬가지입니다.
축 결합은 서로 평행하기 때문에 수소보다 큰 치환기는 일반적으로 적도가 아닌 축 방향으로 향할 때 더 큰 입체 군집을 겪습니다. 결과적으로,치환 된 시클로 헥산은 더 큰 치환기가 적도 배향을 가정하는 형태를 우선적으로 채택 할 것이다.
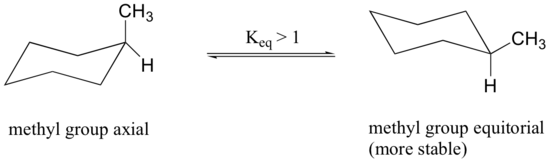
상기 구조의 메틸기가 축방향 위치를 점유할 때,링의 동일한 측면에 위치한 2 개의 축방향 수소에 의해 입체 군집을 겪는다.

메틸 그룹이 적도인 구조는 안정되어 있고,따라서 평형은 이 방향에서 속입니다.
시클로 헥산에 대한 축 방향 대 적도 위치에 배향 된 다른 치환기 그룹에 의해 경험되는 상대 입체 장애는 화합물의 구조적 평형에 의해 결정될 수있다. 해당 평형 상수는 컨 포머 간의 에너지 차이와 관련이 있으며 이러한 데이터를 수집하면 적도 또는 축 위치에 존재하는 치환기의 상대적 경향을 평가할 수 있습니다.이러한 자유 에너지 값(값이라고도 함)의 표는 여기를 클릭하여 검사 할 수 있습니다.
이 표의 에너지 값을 살펴보면,치환기의 명백한”크기”(축 방향보다 적도에 대한 선호의 관점에서)는 축 비닐 그룹이 에틸보다 덜 방해 받고 요오드가 염소보다 약간 적다는 사실에 의해 입증 된 바와 같이 시클로 헥산에 대한 폭 및 결합 길이에 의해 영향을 받는다는 것이 분명하다.
우리는 서로 다른 고리 탄소 원자에 2 개 이상의 치환기를 갖는 시클로 알칸이 한 쌍(때로는 그 이상)의 구성 입체 이성질체로 존재한다는 것을 이전에 주목했다. 이제 우리는 유리한 링 형태가 구성 이성질체의 특성에 영향을 미치는 방법을 조사해야합니다. 구성 입체 이성질체는 안정적이며 쉽게 상호 변환되지 않는 반면 구조적 이성질체는 일반적으로 빠르게 상호 변환됩니다. 치환 된 시클로 헥산에 대한 가능한 구조를 검사 할 때 두 가지 원칙을 따르는 것이 유용합니다:
(나는)의자 형태는 일반적으로 다른 가능성보다 더 안정적이다.(3114>
2)체어 컨 포머의 치환기는 축 위치의 입체 장애 증가로 인해 적도 위치를 차지하는 것을 선호합니다.
다음 방정식 및 공식은 사이클로헥산 고리에 두 개 이상의 치환기가 존재하면 예측할 수 있는 방식으로 두 개의 체어 컨 포머의 상호 전환이 어떻게 변하는지 보여줍니다.
1,1-이산화 시클로 헥산의 경우,치환체 중 하나는 반드시 축 방향이어야하고 다른 하나는 적도이어야한다. 치환기는 1,1-디메틸 시클로 헥산에서 동일하기 때문에,두 개의 컨 포머는 동일하고 동일한 농도로 존재한다. 에 1-티-부틸-1-메틸 시클로 헥산 티-부틸 그룹은 메틸보다 훨씬 크며,더 큰 그룹이 적도 인 그 의자 컨 포머는 평형(>99%)에서 선호 될 것이다. 결과적으로,이 화합물의 메틸기는 거의 독점적으로 그 방향으로 축 방향이다.
1,2-,1,3-및 1,4-이환 화합물의 경우 분석은 좀 더 복잡합니다. 두 그룹 모두 적도가 항상 가능하지만,이것이 시스 관계 또는 트랜스 관계가 필요한지 여부는 치환기의 상대적인 위치에 따라 다릅니다. 우리가 탄소#1 에서#6 까지 고리 주위를 셀 때,각 탄소의 최상층 결합은 적도(또는 축)에서 축(또는 적도)으로 방향을 바꿉니다. 의자 반지 모양의 주어진 측에 유대가 항상 이 유행에서 교체한ㄴ다는 것을 기억하는 것이 중요하다. 따라서,시스-1,2-이환의 경우 치환기 중 하나는 적도이어야하고 다른 하나는 축 방향이어야한다는 것이 분명해야합니다; 트랜스 이성질체에서 둘 다 적도 일 수 있습니다. 적도와 축 결합의 교대 특성으로 인해 반대 관계는 1,3-이변에 적용됩니다(시스는 모두 적도,트랜스는 적도/축입니다).
마지막으로,1,4-이환은 1,2 패턴으로 되돌아갑니다:
위의 분석은 암기 하려고 해야 하는 것이 아닙니다: 오히려,축 방향 및 적도 치환기에 대한 올바른 방향을 가리키는 결합으로 의자 형태로 시클로 헥산을 그리는 데 익숙해집니다. 의자 형태에서 구조를 올바르게 그릴 수 있다면 항상 어떤 위치가 축 방향이고 어느 위치가 적도인지 결정할 수 있어야합니다.