17.3: Dannelsen Av Komplekse Ioner
Effekten Av Dannelsen Av Komplekse Ioner På Oppløselighet
Hva skjer med oppløseligheten av et sparsomt løselig salt hvis en ligand som danner en stabil kompleks ion blir tilsatt til løsningen? Et slikt eksempel forekommer i konvensjonell svart-hvitt fotografering. Husk at svart-hvitt fotografisk film inneholder lysfølsomme mikrokrystaller Av AgBr, eller blandinger Av AgBr og andre sølvhalogenider. AgBr er et lettoppløselig salt, med en ksp på 5.35 × 10-13 ved 25°C. Når lukkeren av kameraet åpnes, treffer lyset fra objektet som fotograferes noen av krystallene på filmen og initierer en fotokjemisk reaksjon som konverterer AgBr til svart Ag-metall. Velformede, stabile negative bilder vises i gråtoner, som svarer til antall korn Av AgBr konvertert, med områdene utsatt for mest lys som mørkeste. For å fikse bildet og forhindre at Flere AgBr-krystaller omdannes til Ag-metall under bearbeiding av filmen, fjernes den uomsatte AgBr på filmen ved hjelp av en kompleksasjonsreaksjon for å oppløse det sparsomt oppløselige saltet.
reaksjonen for oppløsning av sølvbromid er som følger:
\
med
\
likevekten ligger langt til venstre, og likevektskonsentrasjonene Av Ag+ og Br− ioner er svært lave (7,31 × 10-7 M). Som et resultat vil fjerning av uomsatt AgBr fra enda en enkelt filmrulle ved bruk av rent vann kreve titusenvis av liter vann og mye tid. Le Chateliers prinsipp forteller oss imidlertid at vi kan kjøre reaksjonen til høyre ved å fjerne et av produktene, noe som vil føre Til At Mer AgBr oppløses. Bromidion er vanskelig å fjerne kjemisk, men sølvion danner en rekke stabile to-koordinatkomplekser med nøytrale ligander, som ammoniakk, eller med anioniske ligander, som cyanid eller tiosulfat (S2O32−). Ved fotografisk behandling oppløses overflødig AgBr ved bruk av en konsentrert løsning av natriumtiosulfat.
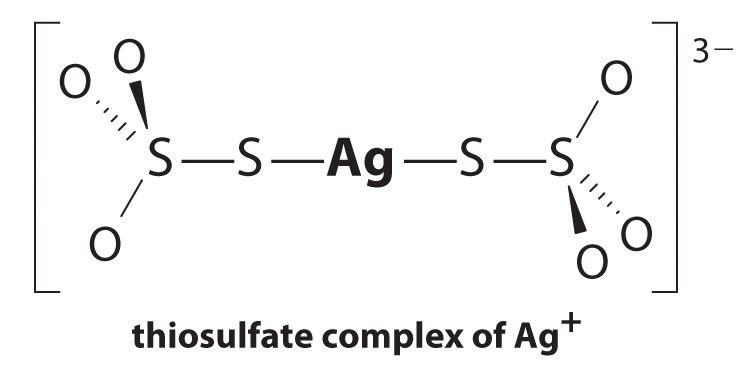
reaksjonen Av Ag+ med tiosulfat er som følger:
\^{3−}_{(aq)} \ etikett{17.3 .5a}\]
med
\
størrelsen på likevektskonstanten indikerer at nesten Alle Ag + – ioner i oppløsning umiddelbart vil bli kompleksert av tiosulfat for å danne 3−. Vi kan se effekten av tiosulfat På Oppløseligheten Av AgBr ved å skrive de riktige reaksjonene og legge dem sammen:
\\ \mathrm{Ag^+(aq)} + \mathrm{2S_2O_3^{2 -} (aq)} \ rightleftharpuns\mathrm {^{3 -} (aq)}\hspace{3mm}K_ \ textrm f & =2.9\tider10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f} = 15 \ end{align} \ etikett{17.3.6}\)
Sammenligning Av K med Ksp viser at dannelsen av det komplekse ion øker oppløseligheten Av AgBr med omtrent 3 × 1013. Den dramatiske økningen i løselighet kombinert med lave kostnader og lav toksisitet forklarer hvorfor natriumtiosulfat er nesten universelt brukt for å utvikle svart-hvitt film. Om ønskelig kan sølvet gjenvinnes fra tiosulfatløsningen ved hjelp av en av flere metoder og resirkuleres.
hvis et komplekst ion har en stor Kf, kan dannelsen av et komplekst ion dramatisk øke oppløseligheten av svakt oppløselige salter.
Eksempel \(\PageIndex{2}\)
på grunn av den vanlige ioneffekten kan vi forvente at et salt Som AgCl skal være mye mindre løselig i en konsentrert løsning Av KCl enn i vann. En slik antagelse ville imidlertid være feil fordi den ignorerer det faktum at sølvion har en tendens til å danne et to-koordinatkompleks med kloridioner (AgCl2−). Beregn løseligheten Av AgCl i hver situasjon:
- i rent vann
- i 1,0 M KCl-løsning, ignorerer dannelsen av komplekse ioner
- den samme løsningen som i del (b) bortsett fra å ta hensyn til dannelsen av komplekse ioner, forutsatt At AgCl2− er Det eneste Ag+ – komplekset som dannes i betydelige konsentrasjoner
Ved 25°C, Ksp = 1,77 × 10-10 For AgCl og Kf = 1.1 × 105 Til AgCl2 -.
Gitt: Ksp Av AgCl, Kf Av AgCl2− og kcl konsentrasjon
Bedt om: løselighet Av AgCl i vann og I KCl løsning med og uten dannelse av komplekse ioner
Strategi:
- Skriv løselighetsproduktuttrykket For AgCl og beregn konsentrasjonen Av Ag+ og Cl− i vann.
- Beregn konsentrasjonen Av Ag+ I kcl-løsningen.
- Skriv balanserte kjemiske ligninger for oppløsningen Av AgCl og for dannelsen Av AgCl2-komplekset. Legg til de to ligningene og beregne likevektskonstanten for den totale likevekten.
- Skriv likevektskonstantuttrykket for den samlede reaksjonen. Løs for konsentrasjonen av det komplekse ion.
Løsning
- A Hvis vi lar x lik oppløseligheten Av AgCl, så ved likevekt = = x m. Erstatte denne verdien i løselighetsproduktuttrykket,
dermed er oppløseligheten Av AgCl i rent vann ved 25°C 1.33 × 10-5 M.
- B hvis x er lik oppløseligheten Av AgCl I kcl-løsningen, så ved likevekt = x m og = (1,0 + x) M. Erstatte disse verdiene i løselighetsproduktuttrykket og antar at x << 1.0,
hvis den vanlige ioneffekten var den eneste viktige faktoren, ville Vi forutsi At AgCl er omtrent fem størrelsesordener mindre løselig i en 1.0 M KCl-løsning enn i vann.
- C for å redegjøre for effektene av dannelsen av komplekse ioner, må vi først skrive likevektsligningene for både oppløsning og dannelse av komplekse ioner. Å legge til ligningene som svarer Til Ksp og Kf gir oss en ligning som beskriver oppløsningen Av AgCl i En KCl-løsning. Likevektskonstanten for reaksjonen er derfor produktet Av Ksp og Kf:
\\ \mathrm{Ag^+(aq)}+\mathrm{2Cl^{-}}\rightleftharpuns\mathrm{^{-}}\hspace{3mm}K_ \ textrm f& =1,1 \ tider10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=1.9\times10^{-5} \ end{align}\)
D Hvis vi lar x lik oppløseligheten Av AgCl I kcl-løsningen, så ved likevekt = x og = 1.0-x. Erstatte disse mengdene i likevektskonstantuttrykket for nettreaksjonen og antar at x << 1.0,
Det Vil Si at AgCl oppløses i 1,0 M KCl for å produsere en 1,9 × 10-5 m løsning Av AgCl2-komplekse ion. Dermed forutsier Vi At AgCl har omtrent samme oppløselighet i en 1,0 M KCl-løsning som den gjør i rent vann, som er 105 ganger større enn det som forutsettes basert på den vanlige ioneffekten. (Faktisk er Den målte oppløseligheten Av AgCl i 1,0 M KCl nesten en faktor på 10 større enn den i rent vann, hovedsakelig på grunn av dannelsen av andre kloridholdige komplekser.)
Øvelse \(\PageIndex{2}\)
Beregn oppløseligheten av kvikksølv (II) jodid (HgI2) i hver situasjon:
- rent vann
- en 3,0 m oppløsning Av NaI, forutsatt at 2-er den eneste Hg-holdige arten til stede i betydelige mengder
Ksp = 2,9 × 10-29 For HgI2 og Kf = 6,8 × 1029 for 2−.
Svar
- 1.9 × 10-10 M
- 1.4 M
Kompleksdannende midler, molekyler eller ioner som øker oppløseligheten av metallsalter ved å danne oppløselige metallkomplekser, er vanlige komponenter i vaskemidler. Langkjedede karboksylsyrer, hovedkomponentene i såper, danner uoppløselige salter Med Ca2+ og Mg2+, som er tilstede i høye konsentrasjoner i “hardt” vann. Utfelling av disse saltene produserer en badekarring og gir en grå tinge til klærne. Tilsetning av et kompleksdannende middel som pyrofosfat (O3POPO34− ELLER P2O74 -) eller trifosfat (P3O105−) til vaskemidler forhindrer magnesium – og kalsiumsalter i å utfelle fordi likevektskonstanten for kompleksiondannelse er stor:
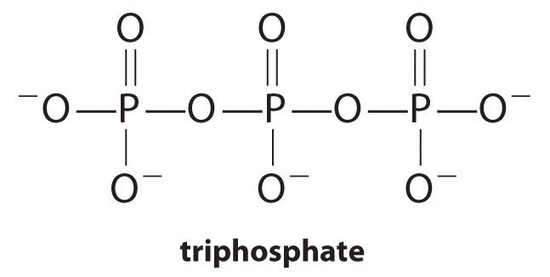
med
fosfater kan imidlertid forårsake miljøskader ved å fremme eutrofiering, veksten av store mengder alger i en vannkilde, noe som til slutt kan føre til store reduksjoner i nivåer av oppløst oksygen som dreper fisk og andre vannlevende organismer. Følgelig har mange stater i Usa forbudt bruk av fosfatholdige vaskemidler, Og Frankrike har forbudt bruk fra 2007. “Fosfatfrie” vaskemidler inneholder forskjellige typer kompleksdannende midler, som derivater av eddiksyre eller andre karboksylsyrer. Utviklingen av fosfatstatninger er et område med intens forskning.
Kommersielle vannmyknere bruker Også et kompleksdannende middel til å behandle hardt vann ved å sende vannet over ionbytterharpikser, som er komplekse natriumsalter. Når vann strømmer over harpiksen, oppløses natriumion, og uoppløselige salter utfelles på harpiksoverflaten. Vann behandlet på denne måten har en saltere smak på grunn Av Tilstedeværelsen Av Na+, men den inneholder færre oppløste mineraler.
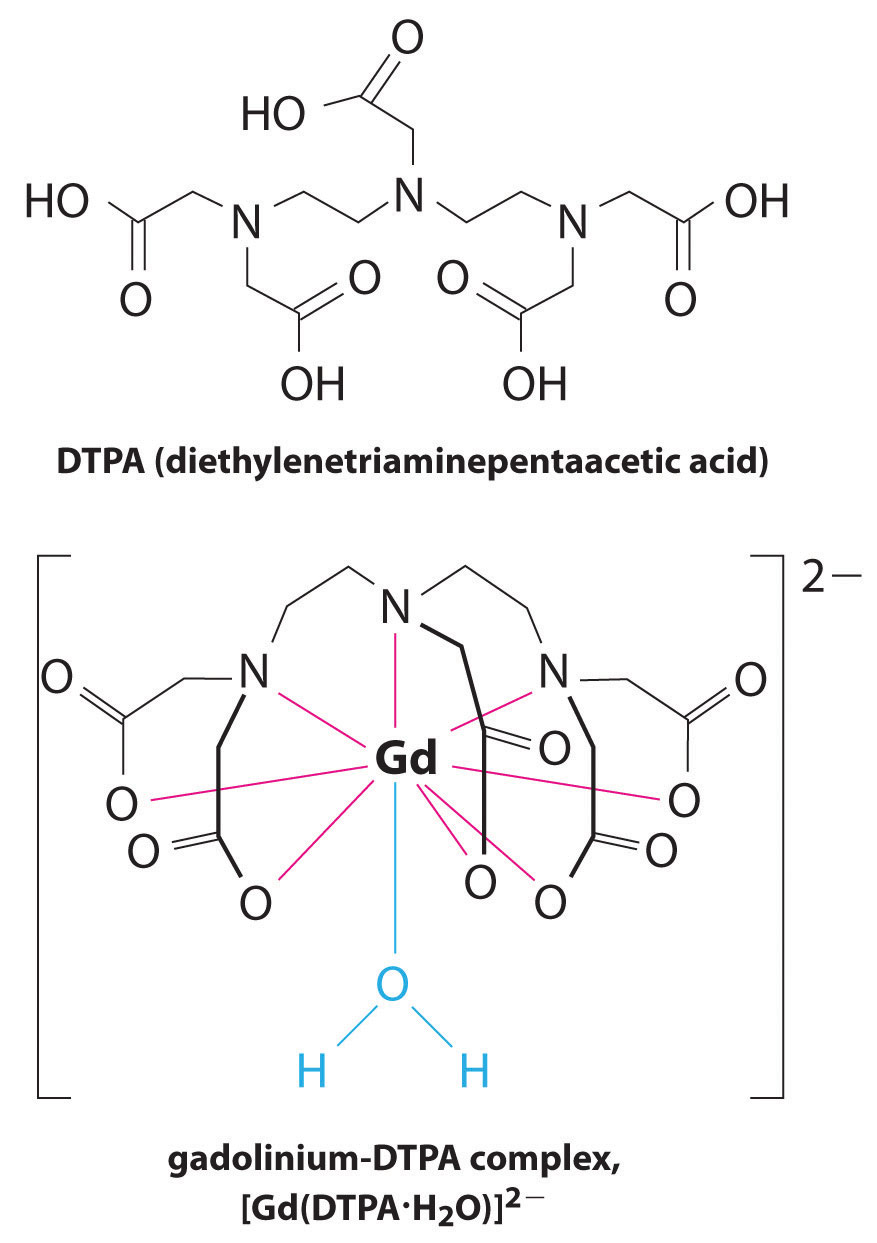
en annen anvendelse av kompleksdannende midler finnes i medisin. I motsetning til røntgenstråler kan magnetisk resonansavbildning (MR) gi relativt gode bilder av myke vev som indre organer. MR er basert på de magnetiske egenskapene TIL 1h-kjernen av hydrogenatomer i vann, som er en viktig komponent i bløtvev. Fordi egenskapene til vann ikke avhenger veldig mye av om det er inne i en celle eller i blodet, er det vanskelig å få detaljerte bilder av disse vevene som har god kontrast. For å løse dette problemet har forskere utviklet en klasse av metallkomplekser kjent som ” MR-kontrastmidler.”Injisering AV ET MR-kontrastmiddel i en pasient påvirker selektivt de magnetiske egenskapene til vann i celler av normalt vev, i svulster eller i blodkar og tillater leger å “se” hver av disse separat (Figur \(\PageIndex{2}\)). En av de viktigste metallioner for denne applikasjonen Er Gd3+, som med syv uparede elektroner er svært paramagnetisk. Fordi Gd3+(aq) er ganske giftig, må den administreres som et meget stabilt kompleks som ikke dissocierer i kroppen og kan utskilles intakt av nyrene. Kompleksdannende midler som brukes til gadolinium er ligander som DTPA5− (dietylentriaminpentaeddiksyre), hvis fullt protonerte form er vist her.
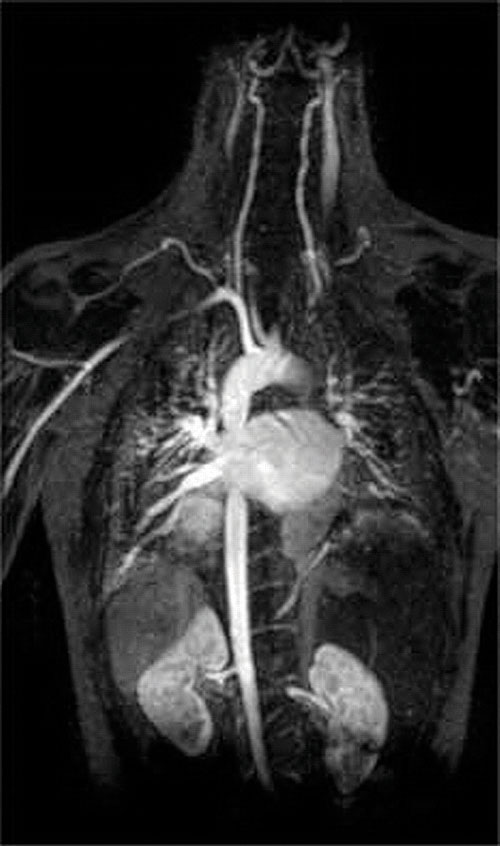
Figur \(\PageIndex{2}\): ET MR-Bilde Av Hjertet, Arteriene og Venene. Når en pasient injiseres med en paramagnetisk metallkation i form av et stabilt kompleks kjent som ET MR-kontrastmiddel, endres de magnetiske egenskapene til vann i celler. Fordi de forskjellige miljøene i forskjellige typer celler reagerer annerledes, kan en lege få detaljerte bilder av bløtvev.