2.3: Karbonmonoksid og backbonding
Generelle Egenskaper
CO ER en dativ, l-type ligand som ikke påvirker oksidasjonstilstanden til metallsenteret ved binding, men øker det totale elektronantallet med to enheter. Vi har nylig sett at det virkelig er to bindingsinteraksjoner på spill i karbonylliganden: en ligand-til-metall n → dσ interaksjon og en metall-til-ligand dn → π* interaksjon. Sistnevnte interaksjon kalles backbonding, fordi metallet donerer elektrontetthet tilbake til liganden. For å minne meg selv om eksistensen av backbonding, liker jeg å bruke høyre resonansstruktur når det er mulig; det er imidlertid viktig å huske Å behandle CO som En l-type ligand uansett hvilken resonansform som er tegnet.

Orbitale interaksjoner I M=C = O.
CO er en sterk σ-donor (eller σ-base) og en god π-akseptor (eller π). Egenskapene til ligert CO avhenger dypt på identiteten til metall sentrum. Mer spesifikt dikterer de elektroniske egenskapene til metallsenteret betydningen av backbonding i metallkarbonylkomplekser. Mest rett ut, mer elektron-rike metall sentre er bedre på backbonding TIL CO. Hvorfor er det viktig å fastslå styrken på backbonding?
Infrarød spektroskopi har kjent blitt brukt til å empirisk støtte ideen om backbonding. Tabellen nedenfor arrangerer noen metallkarbonylkomplekser i “periodisk” rekkefølge og gir frekvensen som svarer Til c=O strekkmodus. Legg merke til at uten unntak har hver complexed CO en strekkfrekvens lavere enn for free CO. Backbonding er å klandre! C – o-bindingsordren i kompleks karbonmonoksid er (nesten alltid) lavere enn for fri CO.

C = o strekkfrekvenser i metall-karbonylkomplekser. Ser det ut som om det er noe her?
figuren over viser en klar økning i frekvens (en økning i C–o-bindingsordre) når vi beveger oss fra venstre til høyre over det periodiske bordet. Dette funnet kan virke rart hvis vi vurderer at antall d-elektroner i det nøytrale metallet øker når vi beveger oss fra venstre til høyre. Skal ikke metallsentre med flere d-elektroner være bedre på backbonding (og mer “elektron rik”)? Hva skjer her? Husk den periodiske trenden i orbital energi. Når vi beveger oss fra venstre til høyre, reduseres d-orbitalenergiene og energiene til dn og π* orbitaler separeres. Som et resultat blir backbonding-orbitalinteraksjonen verre (husk at sterke orbitale interaksjoner krever godt tilpassede orbitale energier) når vi beveger oss mot de mer elektronegative sentovergangsmetaller! Vi kan tegne en analogi til enaminer og enoletere fra organisk kjemi. Jo mer elektronegative oksygenatom i enoletere er en verre elektrondonor enn enamins nitrogenatom.

betydningen av backbonding avhenger av elektronegativiteten til metallet og dens elektrontetthet.
selvfølgelig kan bidrag fra andre ligander på metallsenteret til backbonding heller ikke glemmes. Logisk vil elektrondonerende ligander ha en tendens til å gjøre backbond sterkere (de gjør metallet til en bedre elektrondonor), mens elektrondonerende ligander vil forverre backbonding. Legge elektron-rike fosfin ligander til et metall senter, for eksempel, reduserer CO strekke frekvens på grunn av forbedret backbonding.
Karbonyl ligander er kjent for å kunne bygge bro over flere metallsentre. Bonding i bro karbonyl komplekser kan være enten “tradisjonelle” eller delokalisert, avhengig av strukturen av komplekset og bygge bro modus. Mangfoldet av bromoduser stammer fra de forskjellige elektrondonorer og akseptorer som er tilstede på CO-liganden (og muligheten for delokalisert binding). Kjente bridging moduser er vist i figuren nedenfor.
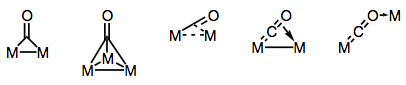
Bygge broer med karbonyl ligander!