25.6: Koenzym B12-Vitamin B12
Kobalamin, Eller Vitamin B12, er den største og mest komplekse ut av Alle Typer Vitaminer. Oppdagelsen Av Kobalamin ble gjort som forskere var ute etter å finne en kur for pernisiøs anemi, en blodfattig sykdom forårsaket av et fravær av indre faktor i magen. Kobalamin ble studert, renset og samlet i små røde krystaller, og krystalliseringsstrukturen ble bestemt under Et røntgenanalyseforsøk utført av Forsker Hodkin. En molekylstruktur Av Kobalamin er enkel, men inneholder mange forskjellige varianter og komplekser som vist i Figur 1. Undersøkelsen av vitaminets molekylære struktur hjelper forskere til å få en bedre forståelse av hvordan kroppen bruker Vitamin B12 til å bygge røde blodlegemer og forhindre skadelig anemi syndromer.
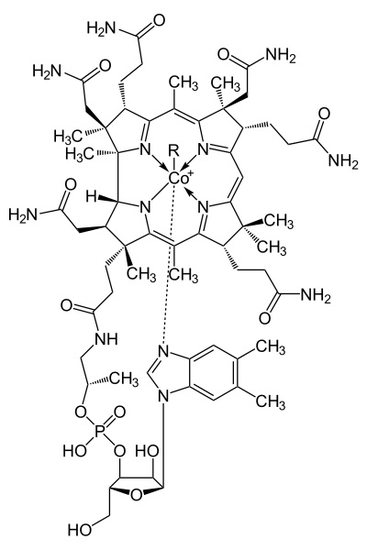
Figur 1
metalloenzymstrukturen Av Kobalamin presenterer en corrin ring Med Kobolt, det eneste metallet i molekylet, plassert midt i sentrum av strukturen av fire koordinerte bindinger av nitrogen fra fire pyrrolgrupper. Disse fire underenhetsgruppene er skilt jevnt på samme plan, rett over fra hverandre. De er også forbundet med hverandre VED en c-CH3 metylenkobling på de andre sidene, Ved En C-H på den ene siden og ved to pyrrol direkte kommer sammen. Sammen danner de en perfekt corrin ring som vist i figur 2. Den femte liganden koblet Til Kobolt er et nitrogen som kommer fra 5,6-dimethylbenzimidazol. Det presenterer seg som en aksial kjører rett ned fra kobolt rett under corrin ringen. Denne benzimidazol er også koblet til en fem karbon sukker, som til slutt fester seg til en fosfatgruppe, og deretter stropper tilbake til resten av strukturen. Siden den aksiale strekkes helt ned, er bindingen mellom Kobolt og 5,6-dimetylbenzimidazol svak og kan noen ganger erstattes av relaterte molekyler som en 5-hydrozyl-benzimidazol, en adenin eller en annen lignende gruppe. I den sjette posisjonen over Corrin-ringen kan Det aktive Stedet For Kobolt direkte koble til flere forskjellige typer ligander. Den kan koble TIL CN for å danne En Cyanokobalami, Til En Metylgruppe for å danne en metylkobalamin, til en 5 ‘ – deoksyadenosigruppe for å danne et adenosylkobalamin og OH, Hydroksykobalamin. Kobolt er alltid klar til å oksidere fra 1 + endring i 2 + og 3 + for å matche opp med Disse R-gruppene som er koblet til den. For Eksempel Inneholder Hydroksokobalamin kobolt som har en 3 + ladning mens Metyladenosyl inneholder en kobolt som har en 1 + Ladning.
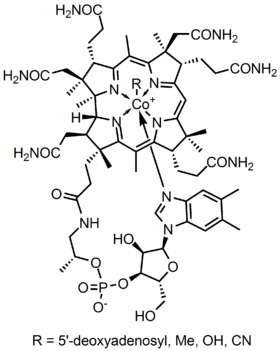
Figur 2
punktgruppekonfigurasjonen Av Kobalamin Er C4v. For å bestemme denne symmetrien må man se at strukturen er i stand til å rotere seg fire ganger og til slutt kommer tilbake til sin opprinnelige posisjon. Videre er det ingen sigma h-plan og ingen vinkelrett C2-økse. Men siden det er sigma v-fly som kutter molekylene i like deler, er Det klart å bestemme at Strukturen Av Kobalamin er En C4v. Med Kobolt som sentermetallet i molekylet, Hadde Kobalamin en forvrengt oktaedisk konfigurasjon. Den aksiale som forbinder Kobolt til 5,6 dimetylbenzimidazol, strekkes helt ned til bunnen. Avstanden er flere ganger lengre enn avstanden fra Kobolt og den vedlagte r-gruppen over den. Dette kan noen ganger også refereres til som en tetragonal struktur. Hele formen generelt ligner en oktaedisk, men de to aksiale gruppene er forskjellige og separert i ujevne avstander. Siden det bare er ett metalloenzymsenter i systemet, er punktgruppen og konfigurasjonen som nettopp er nevnt, også tilordnet strukturen som helhet. Siden metallokoenzymstrukturen er strukket ut, er den ganske svakt koordinert og kan brytes fra hverandre eller erstattes med andre grupper som nevnt ovenfor.
Forskere har vist at BÅDE IR-Og Raman-Spektroskopi ble brukt til å bestemme molekylets struktur. Dette bestemmes ved å observere tegntabellene i punktgruppe C4v, Punktgruppesymmetrien Av Kobalamin. PÅ IR-siden kan man se at det finnes grupper som drz, (x, y), (rz, ry). På Den Annen Side, På Raman-siden, er det grupper som x square + y square, z square, x square-y square, xy, xz, yz. Raman-siden indikerte at det var strekkmoduser i molekylet og relaterer seg tilbake til strekkingen av 5,6 dimetylbenzimidazolaksialet som koblet direkte under Koboltmetallet. Strekningen kan ses i Figur 3.
Figur 3
Kobalamin enzymer kan katalysere noen forskjellige typer reaksjoner. En av dem er reaksjonen Av Intramolekylære omarrangementer. Under denne omorganisering koenzym utveksles til de to gruppene festet til tilstøtende karbonatomer. En annen reaksjon innebærer overføring av metylgruppen i visse metyleringsreaksjoner, som konvertering av homocystein til metionin, biosysntese av kolin og tymin etc. Disse interaksjonene kan gi gunstige verdier til de biologiske legemene.
Kobalamin har mange gunstige effekter i forhold til biologiske eksistenser. De spiller en rolle for å opprettholde et sunt kroppssystem og bidra til å hjelpe produksjonen av kroppens genetiske materialer. Cyanokobalamin, en type kobalamin, arbeider for å generere dannelsen av røde blodlegemer og helbrede mange forskjellige skader i nervesystemet. Kobalamin tjener også som en viktig rolle i metabolismen av fettsyrer som er avgjørende for opprettholdelsen av myelin. Studier har vist at personer Med Vitamin B12-mangel vil avsløre uregelmessig ødeleggelse av myeline shealth, noe som fører til parlysis og død. Noen av de andre symptomene på mangel på kobalamin er dårlig vekst, megaloblastisk benmarg, Gi-forandringer, Leukoopeni og hypersegmenterte nutrofiller, degenerative endringer i ryggmargen og nervesystemet og utskillelse av metylmalonsyre og homocystin i urin.
Gjennom årene Har Vitamin B12 vist seg å være avgjørende for nervesystemet og produksjonen av røde blodlegemer. En studie utført av forskere Ved National Institutes Of Health, Trinity College Dublin, foreslo at mangel På Vitamin B12 kan øke risikoen for nevrale rørfeil hos barn (Miller). Derfor, ved å studere Strukturen Og funksjonen Av Kobalamin, kan forskere eksperimentere Og danne Vitamin B12 i sine laboratorier og tjene samfunnet som helhet.