3.3 Konformasjon Av Cykloheksan
Konformasjon Av Cykloheksan
en plan struktur for cykloheksan er klart usannsynlig. Obligasjonsvinklene vil nødvendigvis være 120º, 10.5 º større enn den ideelle tetrahedrale vinkelen. Også, hver karbon-karbonbinding i en slik struktur ville bli formørket. De resulterende vinkel-og formørkelsesstammene vil sterkt destabilisere denne strukturen. Hvis to karbonatomer på motsatte sider av den seksledige ringen løftes ut av ringenes plan, kan mye av vinkelspenningen elimineres.
denne båtstrukturen har fortsatt to formørkede bindinger og alvorlig sterisk trengsel av to hydrogenatomer på båtens” bue “og” akter”. Denne steriske trengsel kalles ofte sterisk hindring. Ved å vri båten konformasjon, steric hindring kan delvis lettet, men twist-båt konformator beholder fortsatt noen av stammene som karakteriserer båten konformator. Til slutt, ved å løfte ett karbon over ringplanet og det andre under flyet, dannes en relativt belastningsfri ‘stol’ konformator. Dette er den overordnede strukturen vedtatt av molekyler av cykloheksan.
Undersøkelser vedrørende konformasjoner av cykloheksan ble initiert Av H. Sachse (1890) Og E. Mohr (1918), men det var ikke før 1950 at en full behandling av de mangfoldige konsekvensene av interconverting chair conformers og de forskjellige orienteringene av hengende obligasjoner ble belyst Av D. H. R. Barton (Nobelprisen 1969 sammen Med O. Hassel). Følgende diskusjon presenterer noen av de viktigste funksjonene i denne conformational analyse.
ved nøye undersøkelse av en stolkonformasjon av cykloheksan finner vi at de tolv hydrogenene ikke er strukturelt ekvivalente. Seks av dem er plassert rundt periferien av karbonringen, og kalles ekvatorial. De andre seks er orientert over og under det omtrentlige planet av ringen (tre på hvert sted), og kalles aksial fordi de er justert parallelt med symmetriaksen til ringen.
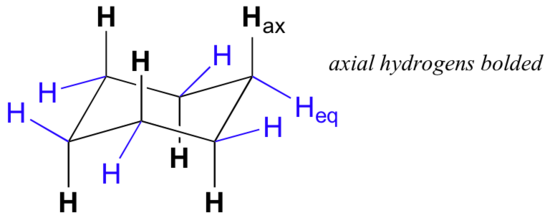
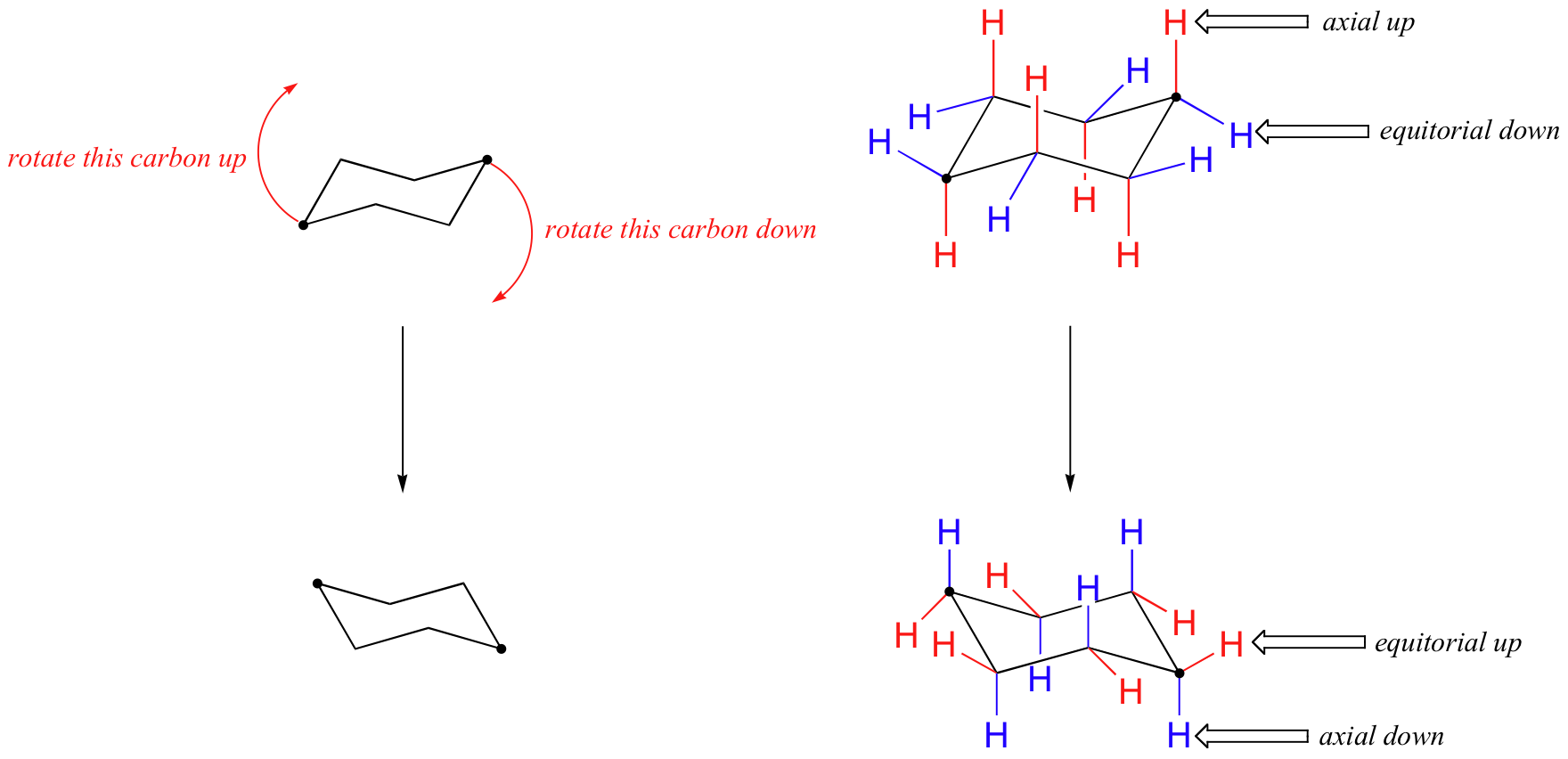
i figuren ovenfor er ekvatorialhydrogenene farget blå, og de aksiale hydrogenene er i fet skrift. Siden det er to ekvivalente stolkonformasjoner av cykloheksan i rask likevekt, har alle tolv hydrogen 50% ekvatorial og 50% aksial karakter. Figuren nedenfor illustrerer hvordan du konverterer en molekylær modell av cykloheksan mellom to forskjellige stolkonformasjoner – dette er noe du bør øve med modeller. Legg merke til at en ‘ring flip’ forårsaker ekvatorial hydrogen til å bli aksial, og vice-versa.
fordi aksiale bindinger er parallelle med hverandre, har substituenter større enn hydrogen generelt større sterisk trengsel når de er orientert aksial i stedet for ekvatorial. Følgelig vil substituerte cykloheksaner fortrinnsvis vedta konformasjoner der de større substituentene antar ekvatorial orientering.
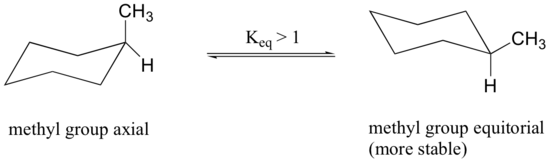
når metylgruppen i strukturen ovenfor opptar en aksial posisjon, lider den av sterisk trengsel av de to aksiale hydrogenene som ligger på samme side av ringen.

konformasjonen der metylgruppen er ekvatorial er mer stabil, og dermed ligger likevekten i denne retningen.
den relative steriske hindringen opplevd av forskjellige substituentgrupper orientert i en aksial versus ekvatorial plassering på cykloheksan kan bestemmes av konformasjons likevekt av forbindelsen. Den tilsvarende likevektskonstanten er relatert til energiforskjellen mellom konformatorene, og innsamling av slike data tillater oss å evaluere den relative tendensen til substituenter å eksistere i en ekvatorial eller aksial plassering.En tabell over disse frie energiverdiene (noen ganger referert Til som a-verdier) kan undersøkes ved å klikke her.
Ser på energiverdiene i denne tabellen, er det klart at den tilsynelatende “størrelse” av en substituent (i form av sin preferanse for ekvatorial over aksial orientering) er påvirket av dens bredde og bindingslengde til cykloheksan, noe som gjenspeiles av det faktum at en aksial vinylgruppe er mindre hindret enn etyl, og jod litt mindre enn klor.
vi bemerket tidligere at sykloalkaner med to eller flere substituenter på forskjellige karbonatomer finnes som et par (noen ganger flere) konfigurasjons stereoisomerer. Nå må vi undersøke hvordan gunstige ringkonformasjoner påvirker egenskapene til konfigurasjonsisomerer. Huske, configurational stereoisomers er stabile og ikke lett interconvert, mens, konformasjons isomerer normalt interconvert raskt. Ved undersøkelse av mulige strukturer for substituerte cykloheksaner er det nyttig å følge to prinsipper:
(I) Stolkonformasjoner er generelt mer stabile enn andre muligheter.
(ii) Substituenter på stolkonformatorer foretrekker å okkupere ekvatoriale stillinger på grunn av økt sterisk hindring av aksiale steder.
følgende ligninger og formler illustrerer hvordan tilstedeværelsen av to eller flere substituenter på en cykloheksanring forstyrrer interkonverteringen av de to stolkonformatorene på måter som kan forutsies.
i tilfelle av 1,1-disubstituerte sykloheksaner må en av substituentene nødvendigvis være aksial og den andre ekvatorial, uavhengig av hvilken stolkonformator som vurderes. Siden substituentene er de samme i 1,1-dimetylcykloheksan, er de to konformatorene identiske og tilstede i lik konsentrasjon. I 1-t-butyl-1-metylcykloheksan er t-butylgruppen mye større enn metyl, og den stolkonformatoren der den større gruppen er ekvatorial vil bli favorisert i likevekten( > 99%). Følgelig er metylgruppen i denne forbindelsen nesten utelukkende aksial i sin orientering.
i tilfeller av 1,2-, 1,3 – og 1,4-disubstituerte forbindelser er analysen litt mer kompleks. Det er alltid mulig å ha begge grupper ekvatorial, men om dette krever et cis-forhold eller et transforhold, avhenger av den relative plasseringen av substituentene. Når vi teller rundt ringen fra karbon #1 til #6, endrer den øverste bindingen på hvert karbon sin orientering fra ekvatorial (eller aksial) til aksial (eller ekvatorial) og tilbake. Det er viktig å huske at bindingene på en gitt side av en stol ring-konformasjon alltid veksler på denne måten. Derfor bør det være klart at for cis-1,2-disubstitusjon må en av substituentene være ekvatorial og den andre aksiale; i trans-isomeren kan begge være ekvatoriale. På grunn av vekselvirkningen av ekvatoriale og aksiale bindinger er det motsatte forholdet sant for 1,3-disubstitusjon (cis er alle ekvatoriale, trans er ekvatorial/aksial).
endelig går 1,4-disubstitusjon tilbake til 1,2-mønsteret:
ovennevnte analyse er ikke noe du bør prøve å huske: heller, bli komfortabel med å tegne cyclohexane i stolen konformasjon, med bindinger som peker i riktig retning for aksial og ekvator substituenter. Hvis du kan tegne en struktur riktig i stolkonformasjonen, bør du alltid kunne bestemme hvilke posisjoner som er aksiale og hvilke som er ekvatoriale.