7.4: Kompleks III
Kompleks III aksepterer elektroner fra Både Kompleks i og Kompleks II. elektronene kommer i form av ubiquinol, UQH2, som leverer to elektroner og to protoner og omdannes tilbake til ubiquinon, UQ. Ubiquinonen flyr deretter Tilbake Til Kompleks i ELLER Kompleks II for å samle flere elektroner.
- Kompleks III er målet for elektroner som kommer fra Både Kompleks i OG Kompleks II.
- Complex III bruker energi utgitt i nedoverbakke elektronoverføringer for å pumpe flere protoner over den indre mitokondriamembranen.
- protongradienten over membranen brukes til å drive ATP-dannelse Ved Kompleks V.
- Kompleks III sender deretter sine elektroner videre TIL Kompleks IV.
banen til elektroner Gjennom Kompleks III er vist nedenfor. Merk at komplekset er en dimerisk struktur, med to ekvivalente baner: en vist til venstre og den andre til høyre. Elektroner leveres FRA UQH2, ubiquinol, i midten av bildet, reiser oppover til mobil cytokrom c øverst. En annen elektronbane tillater reise nedover i bildet, mot et annet molekyl ubiquinon, som resirkulerer elektronene i en løkke.
- Kompleks III har en uvanlig, divergerende elektronbane.
- Ett elektron beveger seg mot cytokrom c.
- det andre elektronet blir til slutt resirkulert til en annen ubiquinol.
Røntgenstrukturen Til Kompleks III er vist i tegneserieform nedenfor. Den indre mitokondriamembranen ville krysse den øvre midtre delen av komplekset. Flertallet av de komplekse prosjektene nedenfor, inn i matrisen (bunnen av bildet, i denne retningen), selv om en betydelig mengde også stikker ut i intermembranrommet.
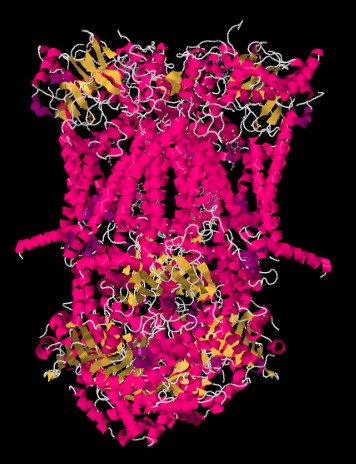
Kompleks III fortsetter elektrontransportkjeden, sender elektroner til høyere reduksjonspotensial (og lavere fri energi) og mot et møte med molekylært oksygen I Kompleks IV. Protoner pumpes også fra mitokondriamatrisen, over den indre mitokondriamembranen og inn i intermembranrommet. Samtidig resulterer en andre elektronrute i en effektiv resirkulering av halvparten av elektronene som kommer inn i komplekset, og øker antall protoner pumpet per elektron som kommer Til Kompleks III.
- det har blitt foreslått at elektrongjenvinningssløyfen gir en mekanisme for å tegne flere protoner opp fra matrisen.
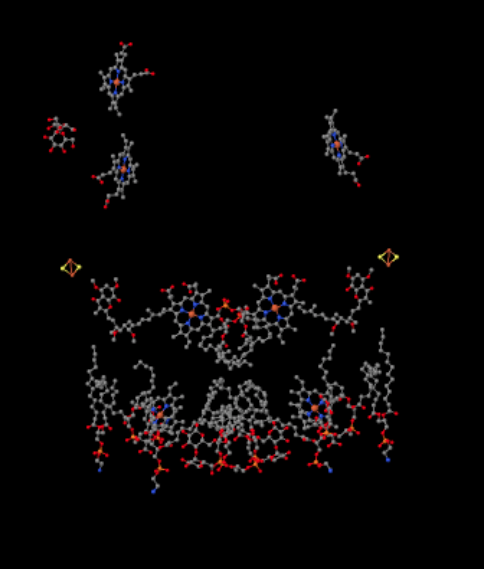
vi kan se dette uvanlige arrangementet hvis vi ignorerer proteinene for å avsløre ligandene, nedenfor. Komplekset kan tydeligere ses som en dimer; den venstre halvdelen av bildet er nøyaktig det samme som høyre, selv om det reflekteres motsatt vei. Elektroner går inn i komplekset via mobiloperatøren ubiquinol, synlig på høyre og venstre side av bildet omtrent halvveis ned; du kan se ringen og en kjede som henger fra den.
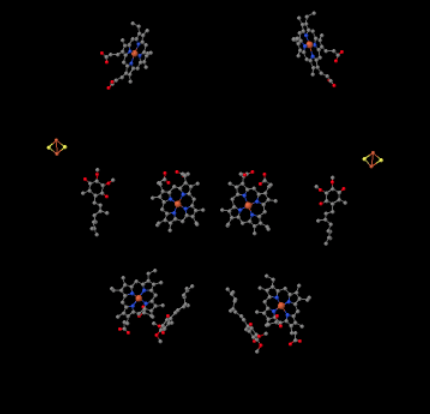
NÅR UQH2 bindes Til Kompleks III, sendes ett elektron videre til En FeS-klynge, mens den andre sendes til et jernhemesenter, kalt heme BL. FeS-klyngen er synlig like over ubiquinol og til kanten av bildet. Heme BL er mot midten av bildet.
selv om Det ikke er tydelig i Røntgenbildet som vises, er Denne FeS-klyngen annerledes enn den du så tidligere. Denne holdes på plass med forskjellige aminosyre sidekjeder. Du kan ikke se det på bildet fordi hele proteinet er utelatt, sammen med de aminosyrene som er bindende for klyngen. Mens De Fleste FeS-klynger holdes på plass utelukkende av cystein, holdes denne klyngen på plass av to cysteiener på den ene siden, men av to histidiner på den andre. Denne spesielle FeS-klyngen kalles En Rieske-klynge.
Rieske-klynger er viktige fordi de er “high potential FeS-klynger”. Det betyr at de har eksepsjonelt positive reduksjonspotensialer sammenlignet med andre FeS-klynger. Reduksjonspotensialet til enhver ligand i et protein er svært avhengig av miljøet, og så er det et bredt spekter av verdier i de fleste tilfeller. Det er sant for jern svovel klynger; normale har reduksjonspotensialer som spenner fra -1,0 V til ca +0,05 V. Rieske-klynger har potensialer som spenner FRA CA 0V til ca 0,4 v.
fra FeS-klyngen sendes elektronen videre til et annet jernhemesenter i en membranbundet enhet kalt cytokrom c1. Cytokrom c1 kan ses øverst på bildet. Fordi dette bildet er orientert på samme måte som de andre røntgenstrukturene i luftveiene, kan vi se at denne elektronen blir transportert opp mot intermembranrommet. Endelig overføres denne elektronen til en annen heme, men denne hemen er bundet i et lite, mobilt protein, kalt cytokrom c. Cytokrom c er en annen mobil elektronbærer. Det fører elektronen videre TIL KOMPLEKS IV. vi kommer tilbake til cytokrom c litt senere.
Før vi kommer til det, hvor går den andre elektronen? Fra heme BL sendes den andre elektronen til et annet jernporfyrinkompleks, heme BH. Det er mot bunnen av bildet, så denne elektronen blir faktisk sendt tilbake mot matrisen. Venter ved heme BL, men det er en annen ubiquinon, UQ. Det venter på elektronen. Det vil faktisk vente på to, deretter forlate kaien og gå tilbake til ubiquinol (UQH2) bindingsstedet for å levere elektronene igjen.
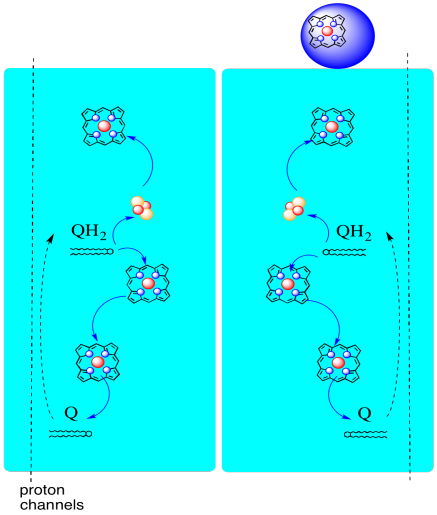
hvorfor bry seg? Hvorfor ikke bare sende elektronene på vei riktig første gang? Det ser ut til at de blir resirkulert av en eller annen grunn. Det antas at denne avledningen tillater ytterligere protoner å pumpes over mitokondriamembranen. Når den andre ubiquinonen blir redusert til ubiquinol via aksept av to elektroner, plukker den også opp to protoner fra matrisen nedenfor. Disse protonene vil etter hvert komme videre mot intermembranrommet når ubiquinol blir oksidert igjen. Denne resirkuleringen, og klemme ut et par ekstra protoner for å øke protongradienten, kalles Q-sløyfen.
fordelen Med Q-sløyfen er forklart i det følgende diagrammet. I diagrammet vises innganger til kompleks III i rødt, utganger vises i blått og resirkulerte elementer er i grønt. Hvis en ubiquinol bare leverte sine elektroner og protoner og ble gjort, ville det være to protoner levert per ubiquinol. Det er en protonutgang per elektron som var inngang.
En annen ubiquinol ville gjøre akkurat det samme. Det ville være fire protoner utgang for fire elektroner i utgangspunktet inngang. Det er fortsatt en protonutgang per elektron som var inngang.
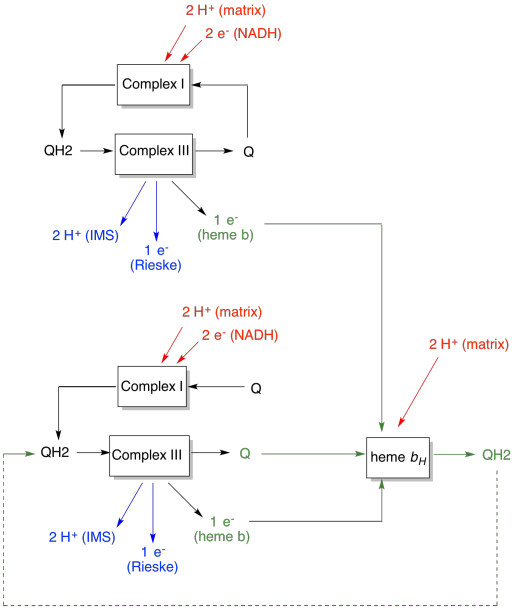
hvis i stedet en elektron resirkuleres hver gang, fører hvert sekund ubiquinol til levering av et ekstra par protoner. Det er fordi ved å plukke opp de resirkulerte elektronene, har en ubiquinon måtte reise tilbake til matrikssiden av membranen og plukke opp to protoner. Samlet sett betyr det at seks protoner leveres for fire elektron-inngang, eller 1,5 protonutgang per elektroninngang. Siden protongradienten er det som genererer ATP, øker effektiviteten ved å øke antall protoner pumpet per elektron som kommer inn.
- Q-sløyfen øker antall protoner pumpet per elektroninngang inn i systemet.
la Oss nå komme tilbake til den utgående elektronbæreren, cytokrom c, som vil frakte elektronene videre TIL Kompleks IV. På bildet nedenfor, fra en annen røntgenkrystallstruktur, Har Komplekset blitt funnet med en cyctochrome c-docking på bindingsstedet. Cytokrom c er et rosa kuleprotein festet øverst på bildet, på venstre halvdel av dimer som vi ser på det her. Det sitter på kanten av intermembranrommet, som er vandige medier. I motsetning til ubiquinon, som glir langs gjennom lipid dobbeltlag av membranen, cytokrom c ruller eller glir eller svømmer over toppen til sin destinasjon.
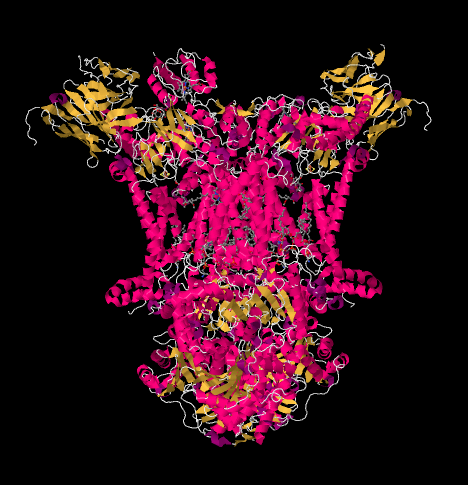
Den samme visningen er vist nedenfor uten proteinet. Den nederste delen av bildet er ganske rotete med lipider, og det er en sukker hengende rundt øverst til venstre, men helt øverst kan du se jernporfyrin som ligger inne i cytokrom c.
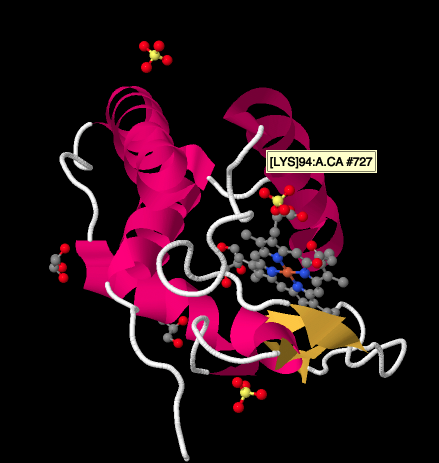
En nærmere titt på En Røntgenstruktur av en cytokrom c, under, viser et relativt enkelt bilde i forhold til kompleksene vi har sett på. Det er et par helices, et par ark, noen looper, og det jernporfyrin eller heme igjen. Noen sulfationer flyter rundt i nærheten, samt et par glycerolmolekyler, sannsynligvis introdusert under rensing eller krystallisering av proteinet. Legg merke til at heme er funnet på kanten av proteinet. Denne plasseringen kan gjøre det lettere for elektronoverføring FRA Kompleks III, Eller Til Kompleks IV.
- Cytokrom c er det endelige målet for elektroner som beveger seg GJENNOM Kompleks III.
- Cytokrom C er en mobil, en-elektronbærer.
- Cytokrom c er faktisk et lite, hydrofilt protein.
- Cytokrom c er funnet over mitokondriamembranen, ved kanten av intermembranrommet.
Hva holder cyctochrome c fra vandrende ut i intermembrane plass? Hvis det gjorde det, ville det forstyrre den effektive strømmen av elektroner. Det er mulig at cytokrom c beveger seg frem og tilbake mellom Kompleks III OG Kompleks IV via en mekanisme kalt “styring”. Ved styring styres transportøren langs en vei via komplementære kostnader. For eksempel, hvis membranen er negativt ladet på grunn av polare grupper på membranoverflaten, kan positive ladninger på overflaten av cytokrom c begrense bevegelsen til membranoverflaten. Det alene ville redusere mobiliteten fra tre dimensjoner (hvor som helst i intermembranrommet) til to dimensjoner (hvor som helst på membranoverflaten). Det er mulig at ytterligere interaksjoner reduserer mobiliteten enda lenger til et endimensjonalt spor mellom de to kompleksene.
- Styring, basert på komplementære kostnader, holder cytokrom c fra å gå tapt i intermembranrommet.
Øvelse \(\PageIndex{1}\)
Foreslå mulige aminosyrerester på overflaten av cytokrom c som kan hjelpe det å holde seg på en negativt ladet membranoverflate.
Svar
Arginin og lysin er positivt ladet ved nøytral pH.
Øvelse \(\PageIndex{2}\)
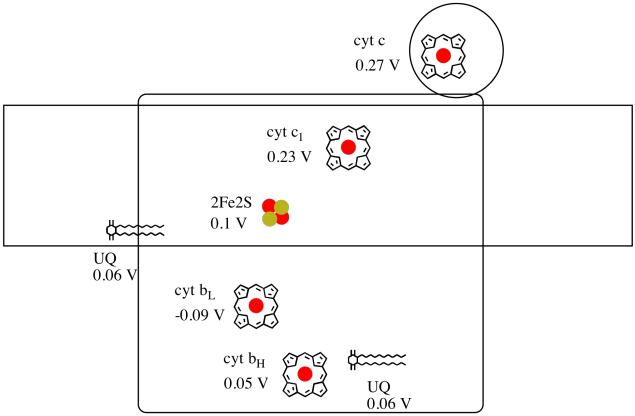
det er vanskelig å måle reduksjonspotensialet til et enkelt sted i et protein. Forskere har imidlertid kunnet estimere disse verdiene ved å måle EPR-spektra under ulike forhold. Forutsatt reduksjonspotensialene nedenfor, tegne et reaksjonsprogresjonsdiagram for transport av et elektron helt fra den første ubiquinon donor helt til cytokrom c.
 Svar
Svar
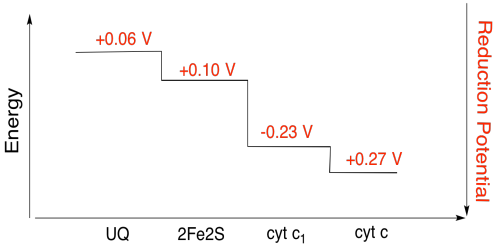
Øvelse \(\PageIndex{3}\)
bruk verdiene i figuren ovenfor, beregne energiendringen når et elektron overføres fra 2fe2s-klyngen til cytokrom c1.
Svar
Forutsatt reduksjon potensialer er:
2Fe2S(okse) + e- → 2Fe2S(red) Eored = 0.10 V
cyt c1(okse) + e- → cyt c1(red) Eored = 0.230 V
Så potensialet forskjell for reaksjon, ΔEo = 0.23 – (0.10) V = 0.13 V.
Faraday forhold ΔG = – n F ΔEo gir
ΔG = – 1 x 96,485 J V-1 mol-1 x 0.13 V = 12,543 J mol-1 = 12.5 kJ mol-1
Øvelse \(\PageIndex{4}\)
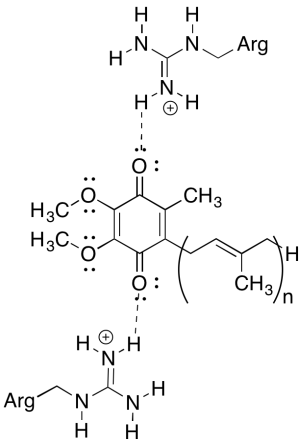
En av de forvirrende tingene om dette komplekset er at i elektrongjenvinningssløyfen ser elektronoverføring ut til å gå fra en første ubiquinon til en endelig ubiquinon, uten generell drivkraft. Reduksjonspotensialene er imidlertid svært følsomme for miljøet. Vis hvordan nærliggende argininrester kan gjøre reduksjonspotensialet til en ubiquinon mer positiv.
Svar
de positive argininrester vil gi delvis positiv ladning på ubiquinon via hydrogenbinding; ubiquinon ville ha et mer positivt reduksjonspotensial som et resultat.
Se fokus siden på strukturen Av Complex III På Biochemistry Online.
røntgenkrystallstruktur Av Kompleks III fra: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C.-A., Xia, D. Strukturelt grunnlag for kinonreduksjonen i bc1-komplekset: en komparativ analyse av krystallstrukturer av mitokondriell cytokrom bc1 med bundet substrat og hemmere På Qi-stedet. Biokjemi 2003, 4, 9067-9080. (1ntz)
RØNTGENKRYSTALLSTRUKTUR Av Kompleks III med bundet cytokrom c fra: Solmaz, Sr, Hunte, C. Struktur av kompleks III med bundet cytokrom c i redusert tilstand og definisjon av et minimalt kjernegrensesnitt for elektronoverføring. J. Biol. Chem. 2008, 283, 17542-17549. (3CXH)
røntgenkrystallstruktur av cytokrom c fra: Enguita, Fj, Pohl, E., Turner, Dl, Santos, H., Carrondo, Ma Strukturelle bevis for en protonoverføringsvei kombinert med hemreduksjon av cytokrom c” fra Methylophilus methylotrophus. J. Biol. Inorg. Chem. 2006 11, 189. (1OAE))
Navngivelse
Chris P Schaller, Ph. D., (College Of Saint Benedict / Saint John ‘ S University)