7.5: Kompleks IV
Kompleks IV Er det endelige målet i elektrontransportkjeden. Her blir elektronene som har reist gjennom de andre medlemmene av respiratorisk superkompleks endelig levert Til O2, og reduserer det til vann. Det er en imponerende prestasjon, fordi en rekke reaktive oksygenarter må dannes mellom den første tilsetningen av et elektron og den endelige frigjøringen av vann, men reaksjonen styres på en slik måte at muligheten for celleskader minimeres. Samtidig pumpes flere protoner over den indre mitokondriamembranen.
- i Kompleks IV leveres elektroner til deres endelige destinasjon, et molekyl Av O2.
- O2 er redusert til vann.
Øvelse \(\PageIndex{1}\)
Skriv en balansert redokshalvreaksjon for å vise hvor mange elektroner som trengs for å redusere et oksygenmolekyl til vann.
Svar
o2 → h2o
o2 → 2 H2O (o balansert)
O2 + 4h+ → 2 h2o (h balansert)
O2 + 4e – + 4H + → 2 H2O (kostnad balansert)
Røntgenstrukturen Av Kompleks IV er vist nedenfor. Igjen er matrisen i den nedre enden av bildet og intermembranrommet er øverst. Det er der cytokrom c dokker, øverst.
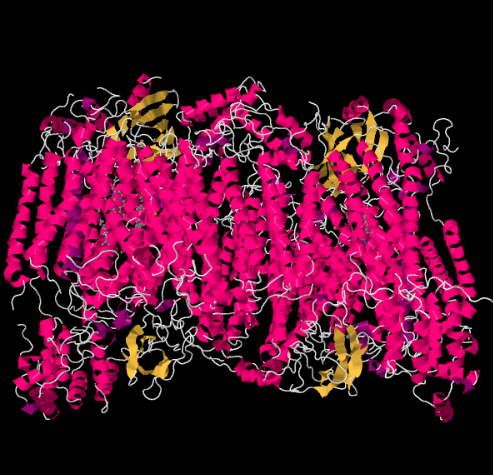
den mobile elektronbæreren, cytokrom c, binder Ved Kompleks IV og leverer et elektron til et binukleært kobbersted kalt CuA. Vi kan se at binuclear kobber området når vi ser inne i protein, nedenfor. Det er bundet bare til proteinet og ingenting annet, så vi ser bare de to kobberionene alene på toppen av bildet. Dette paret kobberatomer sender elektronen videre til en heme, cytokrom a, som du kan se nedenfor og til venstre. Derfra går elektronen videre til en annen binukleær klynge, denne gangen bestående av et hemebundet jern (cytokrom a3) og et nærliggende kobber (CuB). Dette binukleære stedet utfører reduksjonen av dioksygen til vann. I strukturen er det et karbonmonoksidmolekyl bundet i det aktive stedet mellom cytokrom a3 og CuB. Karbonatomer er festet til jern og oksygen er festet til kobber. Det er der oksygenmolekylet ville binde seg og vente på å bli redusert til vann.
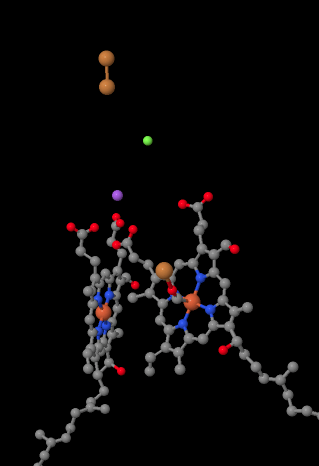
hvis du tenker på det, betyr det at elektroner reiser i motsatt retning fra det vi så i de tre første kompleksene. I Kompleksene I OG II ble elektroner levert fra mitokondriamatrisen og reist opp mot intermembranrommet, og stoppet ved en ubiquinon i mitokondriamembranen. I Kompleks III fortsatte elektroner i den “oppadgående” retningen, fra mitokondriamembranen til cytokrom c i intermembranrommet. I Kompleks IV reverserer elektroner kurs, reiser tilbake mot mitokondriell matrise. Husk at mitokondriellmatrisen er n-dopet på grunn av protonpumping, så disse elektronene reiser fra den positive siden av membranen til den negative siden. Det må være vanskelig.
- I Kompleks IV er elektrontransport i motsatt retning fra de andre kompleksene.
- Elektroner reiser fra intermembranromssiden til mitokondriell matrikssiden, mot ladningsgradienten.
La oss ta en titt på de viktige ligandene for komplekset. En tegneserie er vist nedenfor. I tegneserien vises o2-molekylet bindende i den posisjonen mellom heme a3 og CuB. Det dinukleære metallstedet er hvor oksygenmolekylet reduseres til vann.
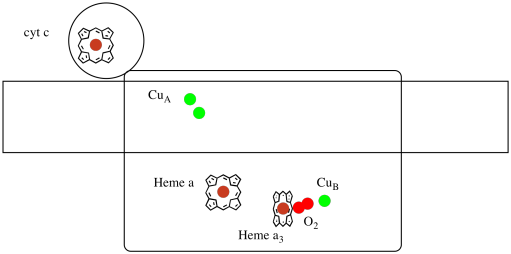
fordi fire elektroner er nødvendig for å redusere O2 TIL H2O, må fire cytokrom c-molekyler binde Ved Kompleks IV før den reduksjonen kan fortsette. Det er sannsynlig at koordinasjonsmiljøet til oksygenmolekylet-mellom to metaller, i stedet for bare bundet til en-gjør at det blir raskere redusert helt til vann i stedet for å danne reaktive oksygenarter som vedvarer i cellen, for eksempel peroksider.
Øvelse \(\PageIndex{2}\)
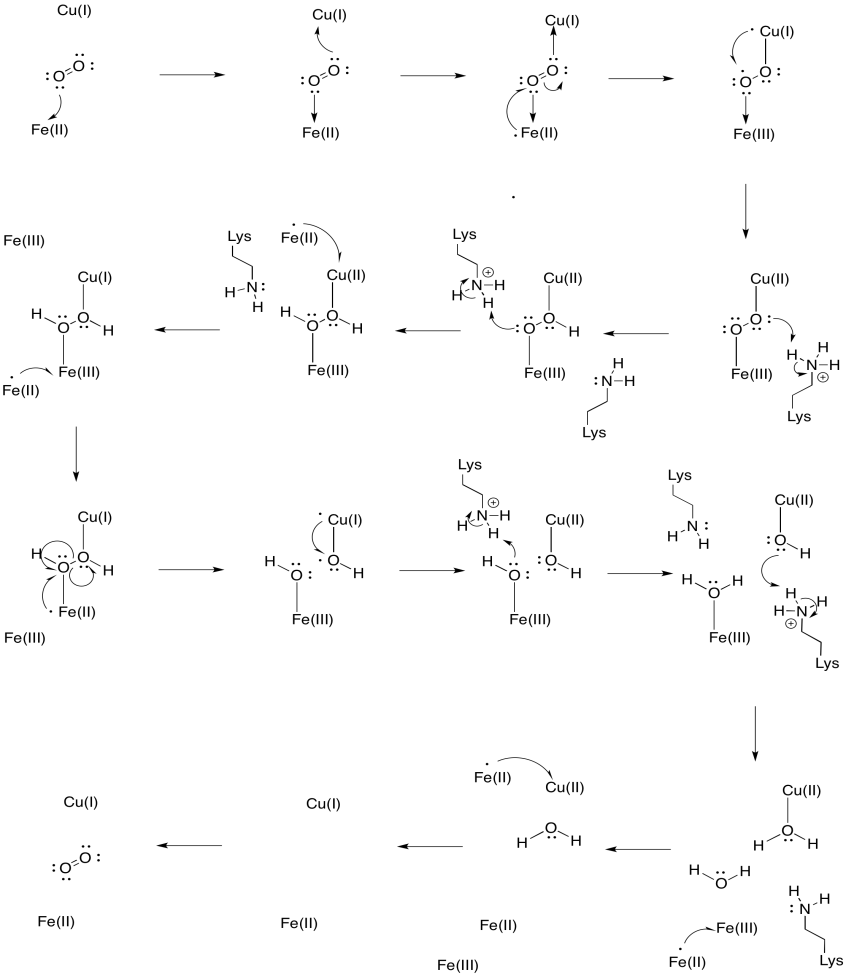
Anta at jernet i heme a3 starter i en redusert Fe (II) tilstand og CuB starter i en redusert Cu (I) tilstand. Gi en mekanisme for reduksjon av oksygen til vann, med tilsetning av fire elektroner og fire protoner. Bruk Fe (II) SOM elektrondonor og lysin som protondonor.
Svar
I tillegg til de to metallene er det også et modifisert histidin-tyrosin-konjugat bundet til CuB. Det har blitt foreslått at dette tyrosinet gir en annen kilde til umiddelbare elektroner som kan brukes i reduksjon.
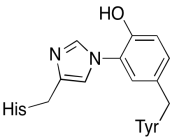
Øvelse \(\PageIndex{3}\)
Vis hvorfor et tyrosin kan være en kilde til både et proton og et elektron i biokjemiske prosesser.
Svar
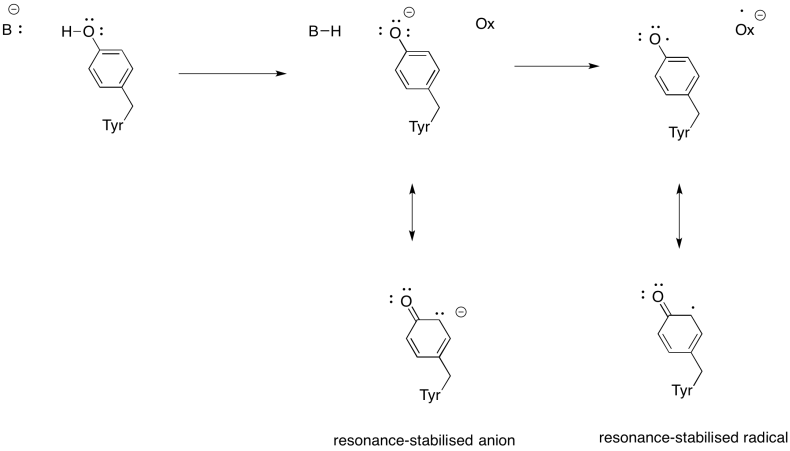
I tillegg til behovet for å redusere oksygen til vann, Bidrar Kompleks IV også til protongradienten, og pumper ytterligere protoner over mitokondriamembranen. Denne oppgaven gir ytterligere utfordringer. En enkel koblingsmekanisme er ikke mulig, fordi elektronene beveger seg i motsatt retning. Det er skjønt at mekanismen innebærer konformasjonsendringer i proteinet som oppstår når metallene endrer oksidasjonstilstander. Subtile endringer i koordinasjonsmiljøet kan føre til forskyvning av aminosyrerester i nærheten. Det er lett å forestille seg at hvis en bestemt aminosyre skifter oppover mot intermembranrommet, kan det trekke en proton med den.
- Protonpumping og elektrontransport går i motsatt retning I Kompleks IV og må kobles fra.
- Protonpumping I Kompleks IV må stole på konformasjonsendringer.
Øvelse \(\PageIndex{4}\)
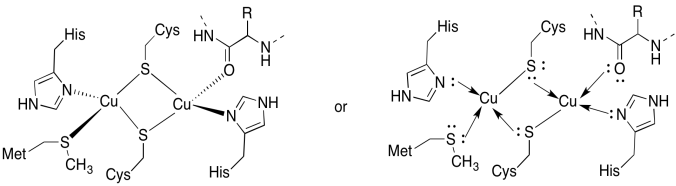
CuA området inneholder to coppers, boound av to bygge bro cysteines. Begge er bundet av terminale histidiner. I tillegg er ett kobber bundet av en ekstra metionin, mens den andre er bundet av en karbonyl fra proteinryggraden.
- Tegn kobberne på deres bindingssteder.
- Beskriv geometrien til hvert kobber.
- Hvis hvert kobber Er Cu (I), hva er koordinert elektron teller på hvert kobber i komplekset?
- hvis hver kobber Er Cu(I), hva er den totale ladningen på komplekset?
Svar a)
a)
Svar b)
b) tetrahedral
svar c)
c) Cu(I) = d10
4 donorer = 8 e –
totalt = 18e-
Svar d)
d) 2 X Cu(I) = 2+
2 x Cys-S- = 2-
alle andre nøytrale
Totalt = 0
Øvelse \(\PageIndex{5}\)
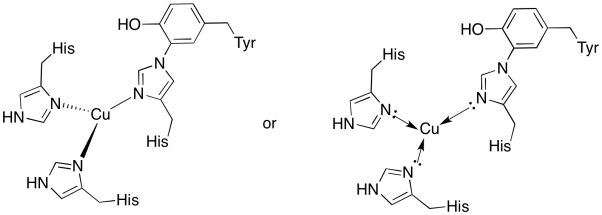
kobberet i CuB-området er bundet av to histidiner og histidin-tyrosin-konjugatet.
- Tegn kobberet på bindingsstedet.
- Beskriv geometrien til kobberet.
- hvis kobber Er Cu (I) , hva er det koordinerte elektronantallet i komplekset?
- hvis kobber er Cu (I), hva er den totale ladningen på komplekset?
Svar a)
a)
Svar b)
b) trigonalplan
Svar c)
c) Cu(I) = d10
3 donorer = 6 e-
totalt = 16 e-
Svar d)
d) Cu(I) = 1+
histidiner nøytral
Totalt = 1+
Øvelse \(\PageIndex{6}\)
det er vanskelig å måle reduksjonspotensialet til et enkelt sted i et protein. Forskere har imidlertid kunnet estimere disse verdiene ved å måle EPR-spektra under ulike forhold. Forutsatt reduksjonspotensialene nedenfor, tegne et reaksjonsprogresjonsdiagram for transport av et elektron helt fra cytokrom c til molekylært oksygen.
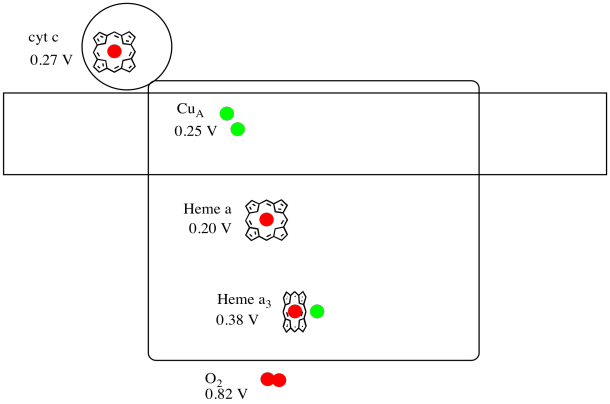 Svar
Svar
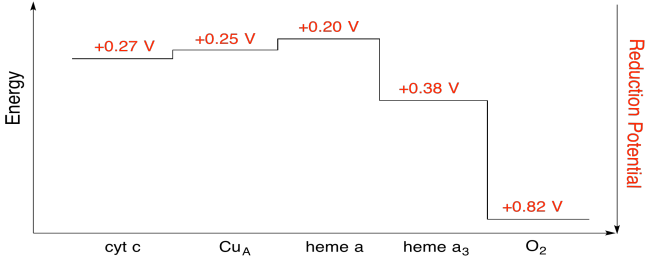
Øvelse \(\PageIndex{7}\)
bruk verdiene i figuren ovenfor, beregne energiendringen når et elektron overføres fra heme a til heme a3.
Svar
Forutsatt reduksjonspotensialene er:
heme a(okse) + e- → heme a(rød) Eored = 0,20 V
heme a3(okse) + e- → heme a3(rød) Eored = 0.38 V
så er den potensielle forskjellen for reaksjonen, Δ = 0.38 – (0.20) V = 0.18 V.
FARADAY – forholdet Δ = – N F Δ
Δ = -1 x 96,485 J V-1 mol-1 x 0.13 V = 17,367 j mol-1 = 17.4 kJ mol-1
Navngivelse
Chris P Schaller, Ph. D., (College Of Saint Benedict / Saint John ‘ S University)