Citrat antikoagulasjon under CRRT for akutt nyreskade
- Akutt Nyreskade
- Behandling AV AKI-renal erstatningsterapi for AKI
- Hemodialyse, hemofiltrering og hemodiafiltrering
- Initiering og tidspunkt FOR RRT for AKI – intermitterende versus kontinuerlig RRT
- Antikoagulasjon ved kontinuerlig renal erstatningsterapi (CRRT)
- Citrat-mekanismen for dens antikoagulerende virkning og dens anvendelse I CRRT
- Potensielle metabolske forstyrrelser under citrate-antikoagulert CRRT
- Biokjemisk overvåking av pasienter som får citrate-antikoagulert CRRT
Akutt Nyreskade
Akutt nyreskade (AKI), et klinisk syndrom med mange mulige årsaker, er ganske enkelt definert som en brå reduksjon i nyrefunksjon over en periode på timer eller dager, dokumentert av nylig økning i serumkreatininkonsentrasjon og/eller reduksjon i urinmengde .
det er forskjellig fra kronisk nyresykdom (CKD) der nedsatt nyrefunksjon er sakte, men irreversibelt progressiv, og forekommer over en periode på måneder og år. AKI kan selvsagt forekomme hos de med underliggende CKD, og en DIAGNOSE AV AKI er forbundet med større enn normal risiko for en eventuell diagnose AV CKD .
Internasjonalt avtalte retningslinjer sier at EN DIAGNOSE AV AKI kan stilles dersom:
• serumkreatinin øker med ≥ 0,3 mg/dL (26,5 µol/L) innen 48 timer; eller
• det har vært en 50% eller større økning i serumkreatinin i løpet av de siste 7 dagene; eller
• urinvolum er
AKI omfatter hele spekteret av alvorlighetsgrad fra en mild reduksjon i nyrefunksjon (stadium 1 AKI) til nyresvikt (stadium 3 Aki). Iscenesettelse avhenger av serumkreatininmåling, med eller uten urinmengde (Tabell I)
|
Scenen |
Serumkreatinin |
urinutgang |
|
1 |
1.5-1.9 ganger baseline |
i 6-12 timer |
|
2 |
2.0-2.9 ganger baseline |
⩾ 12 åpningstider |
|
3 |
3.0 ganger baseline |
til ⩾ 24 timer |
TABELL I: DE tre stadier AV AKI alvorlighetsgrad (fra ref 1)
ÅRSAKENE TIL AKI er konvensjonelt klassifisert under tre overskrifter: prerenal; nyre (indre); og postrenal, understreker det faktum AT AKI kan ha en bestemt nyre etiologi, men kan også skyldes primære problem utenfor nyrene.
enhver tilstand som reduserer blodstrømmen til nyrene (nyreperfusjon) er en potensiell årsak til prerenal AKI; disse tilstandene inkluderer: hypovolemi på grunn av oppkast, diare, blødning, brannskader eller septisk sjokk; og redusert hjerteutgang på grunn av for eksempel hjertesvikt og leversvikt (cirrhose). Hovedårsaken til intrinsic AKI er renal tubulær nekrose, som skyldes renal iskemi eller inntak av nefrotoksiske stoffer / toksiner.
Sepsis, den vanligste årsaken TIL AKI hos kritisk syke, skyldes delvis dårlig definert indre nyreskade som er lik renal tubulær nekrose . Til slutt kommer postrenal AKI fra enhver tilstand som hindrer urinstrømmen distal til nyrene; disse inkluderer: nyrestein( calculi); prostata sykdom (tumor/hypertrofi); blære dysfunksjon; og urinrørstriktur.
Behandling AV AKI-renal erstatningsterapi for AKI
det er ingen spesifikk behandling FOR AKI, og behandlingen er i stor grad støttende med behandling rettet mot den underliggende årsaken. Tilbaketrekking av nefrotoksiske legemidler, væskeopplivning og korrigering av elektrolytt-og syrebaseforstyrrelser er alle en del av denne generelle støttebehandlingen . Administrasjon av vasopressor eller inotrope legemidler for å gjenopprette normalt blodtrykk og hjerteutgang kan være nødvendig.
Renal replacement therapy (RRT), fokuset i denne artikkelen, representerer siste utvei behandling for pasienter med alvorlig AKI som ikke reagerer på konservativ støttende behandling. Rundt 23 % AV ICU pasienter med AKI (dvs .rundt 13% av ALLE ICU pasienter) får RRT.
Renal replacement therapy (RRT) Er den generiske termen for alle behandlinger som søker å erstatte nyrefunksjon. Transplantasjon av donor nyre til de med sluttstadiet nyresykdom kan betraktes som den ultimate RRT, men begrepet er oftere reservert for de terapiene som erstatter blodfiltrering og homeostatiske funksjoner av nyrene ved dialyse, en prosess som benytter en semi-permeabel membran som blodfilteret. To brede typer dialytisk RRT er tilgjengelig for behandling AV AKI( og for den saks skyld, sluttstadiet CKD): peritonealdialyse og hemodialyse.
derimot innebærer hemodialyse filtrering av blod i en maskin utenfor kroppen (ekstrakorporeal). Blod pumpes til filteret / dialysatoren, hvor avfallsprodukter og overflødig væske fjernes, og deretter returneres til kroppen. Denne ekstrakorporale kretsen (dialysemaskinen og dens tilkoblingsrør fra og tilbake til pasienten) er et prokoagulantmiljø.
Hemodialyse, hemofiltrering og hemodiafiltrering
Moderne dialysemaskiner har mulighet for hemofiltrering (HF) samt hemodialyse (HD), noe som gir mulighet for tre forskjellige dialytiske modaliteter for behandling AV AKI: hemodialyse (HD); hemofiltrering (HF); og hemodiafiltrering (HDF).
kjernen i alle tre modaliteter er den semi-permeable membranen som utgjør et blodfilter. Som blod pumpet fra pasienten flyter på den ene siden av denne membranen, overflødig vann og avfall oppløser passere over membranen. Filtratet eller avløpet pumpes til avfall når det filtrerte blodet returneres til pasienten.
prosessen med hemodialyse (HD) innebærer bruk av et dialysevæske som strømmer kontinuerlig og motstrøm til blod på den andre siden av membranen. Sammensetningen og strømningshastigheten av dialysevæske sikrer en konstant konsentrasjonsgradient over den semi-permeable membranen med hensyn til blodoppløsninger. Disse konsentrasjonsgradienter i sin tur lette kontrollert diffusjon av løsningsmolekyler over membranen.
for oppløsninger som urea og kreatinin, som må fjernes fra blod, er konsentrasjonsgradienten slik at diffusjonsretningen er fra blod til dialysevæske, mens for oppløsninger som bikarbonat, som ofte må legges til blod for å korrigere acidosen forbundet med alvorlig AKI, sikrer dialysevæske med høy bikarbonatkonsentrasjon i forhold til blod at diffusjonen er i motsatt retning, fra dialysevæske til blod. Justering av dialysevæskesammensetning og strømningshastighet tillater dermed pasientspesifikk metabolsk korreksjon.
væskeoverskudd er ofte en funksjon AV AKI som korrigeres under hemodialyse. Dette oppnås ved ultrafiltrering, som avhenger av den hydrostatiske trykkgradienten som eksisterer over den halvgjennomtrengelige membranen. Det relative positive hydrostatiske trykket på blodsiden av membranen effektivt “skyver” vann fra blod til dialysevæske.
denne ultrafiltreringen letter også passasje av løsningsmolekyler, som dras sammen med vann under ultrafiltrering av en mekanisme som kalles løsningskonveksjon (eller løsningsmiddeldrag). Den kombinerte effekten av løsningsdiffusjon, løsningskonveksjon og ultrafiltrering under hemodialyse tar sikte på å sikre at væskevolum og sammensetning i både ekstracellulært og intracellulært rom gjenopprettes, så nært som mulig, til det som gjelder blant de med normalt fungerende nyrer.
Hemodiafiltrering (Hdf) er kombinasjonen AV HF og HD. Det tillater optimal klaring av lavmolekylære oppløsninger ved diffusjon til dialysevæske, kombinert med optimal klaring av høymolekylære oppløsninger ved konveksjon og ultrafiltrering. Som MED HF krever HDF kontinuerlig erstatningsvæske; og SOM MED HD krever hdf dialysevæske.
Initiering og tidspunkt FOR RRT for AKI – intermitterende versus kontinuerlig RRT
alle renale erstatningsterapier (PD, HD, HF og HDF) kan gis intermitterende (dvs. typisk i 3-4 timers økter) eller kontinuerlig inntil nyrefunksjonen er gjenopprettet. For pasienter med nyresvikt i sluttstadiet, som krever livslang (kronisk) RRT, er behandlingen utelukkende intermitterende hemodialyse (IHD), nesten alltid levert i fire timers økter, tre ganger i uken .
Pasienter med AKI har bare et midlertidig behov FOR RRT for å støtte nyrefunksjonen under oppløsning av den kritiske / akutte sykdommen SOM fremskyndet AKI. Gjennomsnittlig VARIGHET av RRT hos PASIENTER med AKI er rundt 13 dager , men i spesielle tilfeller kan DET bare være nødvendig i noen dager, eller forlenge i mange uker.
Tradisjonelle (absolutte) indikatorer for initiering AV RRT i AKI inkluderer:
• hyperkalemi (plasmakalium> 6,0-6,5 mmol/L)
• alvorlig uremi (plasma urea > 30 mmol/L)
• tegn på uremisk encefalopati
• acidose (pH • akutt lungeødem
det kan være gunstig å starte behandlingen før disse ekstreme effektene AV AKI er tydelige, men optimal timing for å starte (og stoppe) rrt er FOR TIDEN UKLART og gjenstand for pågående forskning . Det er for tiden ingen pålitelige data som støtter en bestemt TYPE RRT for AKI, og derfor har alle typer RRT blitt ansatt.
Gjeldende retningslinjer gjenspeiler imidlertid en enighet om at rrt, uansett modalitet, skal leveres kontinuerlig i stedet for intermittent til de mest kritisk syke (hemodynamisk ustabile) pasientene. Nyere undersøkelser indikerer at i dag brukes kontinuerlig renal erstatningsterapi (CRRTs) mye oftere enn intermitterende terapier for AKI, og at DEN mest brukte CRRT er kontinuerlig venøs venøs hemofiltrering (CVVHF), etterfulgt av kontinuerlig venøs venøs hemodiafiltrering (CVVHDF).
Antikoagulasjon ved kontinuerlig renal erstatningsterapi (CRRT)
CRRT, til felles med alle andre renale erstatningsterapier unntatt peritonealdialyse, involverer pumping av blod gjennom en ikke-fysiologisk, ekstrakorporal krets. Blodets iboende egenskap til å koagulere (koagulere) ved kontakt med ikke-fysiologiske overflater bestemmer at for å opprettholde en “koagulasjonsfri” pasient ekstrakorporeal krets, må blod antikoaguleres.
CRRT har et spesielt behov for antikoagulasjon, sammenlignet med intermitterende modaliteter, på grunn av de langvarige behandlingssesjonene, og den relativt sakte hastigheten der blod pumpes gjennom kretsen . I tillegg er blodet til pasienter som trenger CRRT ofte allerede i en relativ prokoagulant tilstand på grunn av underliggende kritisk sykdom (f .eks. sepsis) eller traumer.
i mange år var heparin, enten ufraksjonert heparin (UF) eller lavmolekylært heparin (lmwh), den eneste antikoagulanten som ble brukt i dialytiske prosedyrer, inkludert CRRT. Heparin fortsetter å bli brukt; det er en billig og generelt trygt middel for antikoagulasjon for de fleste pasienter som krever RRT.
systemisk heparin antikoagulasjon, som ikke kan unngås, medfører imidlertid uunngåelig økt blødningsrisiko, slik at heparin antikoagulasjon under dialytiske prosedyrer er absolutt kontraindisert for de som for tiden bløder eller har høyere blødningsrisiko enn normalt.
I tillegg kan heparin i et lite mindretall (
den potensielle blødnings-og HIT-II-risikoen forbundet med heparinbruk fremhevet behovet for et alternativt antikoagulant for noen pasienter som krever RRT. Citrate ga et slikt alternativ. Regional citrat antikoagulasjon av dialysekretsen, først brukt med hell i begynnelsen av 1980-tallet , var opprinnelig reservert for den lille minoriteten av pasienter for hvem heparin er kontraindisert. Det endret seg med resultater fra randomiserte kontrollerte studier som sammenlignet heparin-antikoagulert CRRT med citrat-antikoagulert CRRT; disse viste at citrat er både en mer effektiv og sikrere antikoagulant enn heparin .
Citrat har følgelig dukket opp de siste årene som antikoagulant av valget for ALLE AKI pasienter som krever CRRT . Intensivavdelinger rundt om i verden rapporterer nå bytte fra heparin til regional citrat antikoagulasjon for CRRT . Noen myndigheter er selv anbefale bruk av citrat i stedet for heparin antikoagulasjon for intermitterende (kronisk) hemodialyse (IHD).
Citrat-mekanismen for dens antikoagulerende virkning og dens anvendelse I CRRT
Citrat , som har blitt brukt til å antikoagulere/bevare donert blod for transfusjon i godt over et århundre, forhindrer blod i å koagulere gjennom sin evne til å binde (chelat) ionisert kalsium (iCa) som sirkulerer i blodplasma. Denne iCa er en nødvendig kofaktor for både blodplateaggregering og flere viktige trinn i de indre og ytre koagulasjonsveiene som er ansvarlige for fibrinproduksjon, og dermed fibrinklumpdannelse.
blodkoagulasjon forhindres ved reduksjon av plasmakonsentrasjonen av iCa til rundt 0,35 mmol / L (normalt ref-område 1,15-1,30 mmol / L). Denne ikke-fysiologiske, alvorlig hypokalsemiske tilstanden oppnås ved å øke plasmacitratkonsentrasjonen til rundt 3 mmol / L (normal plasmacitratkonsentrasjon ~0,1 mmol / L).
selv om det er forskjeller i detalj skissert Av Morabito et al, involverer alle protokoller for citrat antikoagulasjon under CRRT kontinuerlig infusjon av citratholdig løsning (vanligvis enten trisodiumsitrat eller acd-citrat-dekstrose (ACD) – løsning) til forfilter/dialyselinjen, nær hvor den forlater pasienten, enten som en separat løsning eller kombinert med predilusjons erstatningsvæske. Infusjonshastigheten justeres for å oppnå en konsentrasjon av blodsitrat på ~3 mmol / L, og dermed en plasma iCa på rundt 0,35 mmol / L.
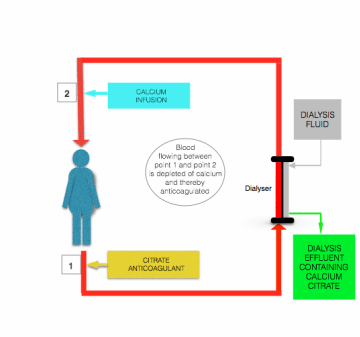
hypokalsemi indusert av citratinfusjon korrigeres før blodet returnerer til pasienten, ved infusjon av kalsiumholdig oppløsning (kalsiumklorid eller kalsiumglukonat) til postfilterlinjen nær der den kommer inn i pasienten (se figuren over).
den største sikkerhetsfordelen ved citrat antikoagulasjon over heparin antikoagulasjon er at antikoagulasjon er begrenset til ekstrakorporeal krets. Denne såkalte “regionale antikoagulasjonen” oppnås fordi det meste av det infuserte citratet fjernes (som enten citratanioner eller kalsiumsitratchelat) fra blod under passasje gjennom filteret/dialysatoren .
eventuelt gjenværende citrat i postfilterblod fortynnes i systemisk sirkulasjon og metaboliseres raskt til karbondioksid og vann via den oksygenavhengige Krebs-syklusen i mitokondrion i vevsceller (hovedsakelig leverceller ).
Metabolisme av citrat er forbundet med produksjon av bikarbonat: for hvert 1 mmol-citrat som metaboliseres, genereres 3 mmol bikarbonat. Den raske clearance av citrat (halveringstiden av citrat i blod er normalt ca. 5 minutter ) via denne hovedsakelig leverveien sikrer normalt fravær av systemisk antikoagulasjon under CRRT, og dermed ingen ytterligere risiko for blødning.
Potensielle metabolske forstyrrelser under citrate-antikoagulert CRRT
den tilsynelatende motviljen mot å fullt ut omfavne citrate-antikoagulert CRRT for ALLE AKI-pasienter til nylig har blitt tilskrevet bekymring for syre-base – og elektrolyttforstyrrelser som kan oppstå hos pasienter som får behandlingen .
følgende elektrolytt-og syrebaseforstyrrelser er rapportert hos pasienter som får citrat-antikoagulert CRRT :
* hypokalsemi / hyperkalsemi
* hypomagnesi / hypermagnesi
* hyponatremi / hypernatremi
* metabolsk alkalose
* metabolsk acidose
disse forstyrrelsene kan oppstå av flere årsaker, men akkumulering av citrat i perifer sirkulasjon (citrattoksisitet) kan være sentralt for de fleste av disse forstyrrelsene. Årsaker til at citrat kan akkumuleres under CRRT inkluderer:
• Nedsatt metabolisme av citrat på grunn av leversykdom og/eller redusert oksygentilførsel på grunn av utilstrekkelig perfusjon (f. eks. I dialyse med påfølgende redusert filtrering av citrat og samtidig økning i citrat levering til systemisk sirkulasjon
• blodprodukttransfusjon – citrat konserveringsmiddel til stede i blodprodukter legger til citrat belastning i systemisk sirkulasjon som følge AV CRRT
uavhengig av årsaken, akkumulering av citrat i perifer sirkulasjon kan resultere i citratkelering av sirkulerende ionisert kalsium, med påfølgende redusert plasmaionisert kalsiumkonsentrasjon (hypokalsemi). Hvis tilstrekkelig alvorlig hypokalsemi kan forårsake hjertearytmi og til slutt hjertestans .
selv om plasmaionisert kalsium reduseres under citratakkumulering (toksisitet), øker total kalsium (indikerer hyperkalsemi) fordi kalsium bundet til citrat er inkludert i målt total kalsium. En økning i forholdet mellom total til ionisert kalsium (normalt 2,0) til > 2.1 har vist seg å være det mest pålitelige signalet på citrattoksisitet i fravær av rutinemessig tilgjengelig plasmacitratestimering .
risikoen for økt plasmanatremi (hypernatremi) forbundet med citrat antikoagulasjon skyldes det høye natriuminnholdet (hypertoni) i enkelte citratløsninger som brukes I CRRT. For eksempel inneholder 4% – løsningen av trisodiumsitrat som brukes i noen protokoller natrium i en konsentrasjon på 420 mmol / L. i praksis kan bruk av hypotonisk dialyse / erstatningsvæsker redusere denne risikoen, og hypernatremi er for all del en sjelden komplikasjon av citrat antikoagulasjon .
risikoen for hypomagnesi (redusert serummagnesium) under citrat antikoagulasjon gjenspeiler det faktum at magnesium, i likhet med kalsium, er et divalent ion som også kan binde seg til (chelat) citrat. Hvis magnesiumtap på grunn av chelateringseffekten av citrat ikke kompenseres fullt ut av magnesium i dialyse/erstatningsvæsker, kan hypomagnesi forekomme .
Biokjemisk overvåking av pasienter som får citrate-antikoagulert CRRT
Pasientnær testing ved hjelp av en blodgassanalysator plassert i intensivavdelingen tillater rask og praktisk måling av de fleste parametere (ionisert kalsium, pH, bikarbonat, baseoverskudd, natrium og laktat), men serum total kalsium-og magnesiumestimering er vanligvis ikke tilgjengelig på disse plattformene, og prøver må sendes til laboratoriet for disse målingene.
To nyere studier gir bevis på at noen blodgassanalysatorer kanskje ikke er pålitelige ved måling av ionisert kalsium ved ekstremt lave, ikke-fysiologiske konsentrasjoner (~0.3 mmol/L) tilstede i postfilterblod, selv om deres evne til nøyaktig å måle plasma ionisert kalsium i systemisk sirkulasjon (hvor konsentrasjonen er mye høyere) ikke er i tvil.
|
Parameter målt |
Overvåkingsintervall |
Målverdier eller ca. referanseområder |
Formål med måling |
Korrigerende tiltak hvis utenfor mål |
|
Postfilter ionisert kalsium (Ica) konsentrasjon, dvs. blod samplet fra postfilter port. |
Innen 1 time etter start og etter noen citratdoseendring, deretter hver 4-6 timer |
0.25-0.35 mmol / L |
|
justering av citratdosen: øk hvis iCa > 0,35, reduser hvis ica |
|
Systemisk ionisert kalsium (Ica), dvs. blodprøvetaking fra pasient |
Baseline (før start), deretter 1 time etter start, deretter minst hver 4-6 timer |
1.15-1.30 mmol / L |
|
Justering av kalsium infusjonshastighet; øke hvis iCa 1.30 |
|
Systemisk total kalsium (TotCa), dvs. blodprøvet fra pasient (TotCa = ica + kalsium bundet til albumin + kalsium bundet til sitrat) |
Minst hver 12-24 timer (må være samtidig med systemisk ionisert kalsiumestimering) |
bare nødvendig for bestemmelse av totCa: ica-forhold (se nedenfor) |
||
|
Forholdet mellom totalt og ionisert kalsium (TotCa:iCa) |
Minst hver 12-24 timer |
for å oppdage citratakkumulering / toksisitet, noen ganger kalt “citratlås” |
Alternativene inkluderer:
|
|
|
Analyse Av Arteriell blodgass
|
Baseline (før start). Innen 1 time etter start, deretter minst hver 4-6 timer. |
pH 7,35-7,45 bikarb 23-28 mmol/L BE–2-+3 mmol / L |
å oppdage syre-base forstyrrelser:metabolsk alkalose metabolsk acidose |
Alternativer i tilfelle av metabolsk alkalose inkluderer:
|
|
Serum natrium |
En gang daglig |
135-145 mmol / L |
å oppdage hypernatremi / hyponatremi |
Sjeldne tilfeller-verifiser riktig dialyse / erstatningsvæske |
|
Serum laktat |
Baseline (før start), deretter i henhold til kliniske behov |
for å bidra til å identifisere de som er i fare for citrattoksisitet |
Vurder, Sammen Med TotCa:Ica-forhold, risiko for citrattoksisitet |
|
|
Serum magnesium |
Minst en gang daglig |
å oppdage hypomagnesi |
Korreksjon med magnesiuminfusjon |
TABELL II: Biokjemisk overvåking under citrat-antikoagulert CRRT (Ref 24)