Cytomegalovirus (CMV) infeksjon Hos HIV/AIDS-pasienter og diagnostiske verdier AV CMV-DNA-deteksjon på tvers av ulike prøvetyper
- Innledning
- Metoder
- Fag
- Inklusjon og eksklusjon
- Reagenser og utstyr
- HIV-RNA-kvantifisering
- CD4 + t lymfocyttelling
- CMV-DNA-kvantifisering
- CMV antistofftest
- Studiemetoder
- nukleinsyredeteksjon
- Påvisning av undergrupper Av t-lymfocytter
- Påvisning av immunantistoffer
- Statistisk analyse
- Resultater
- Generelle data
- Positive rater AV CMV-DNA, CMV-IgG Og CMV-IgM
- Korrelasjon MELLOM CMV-infeksjon ogcd4 + t lymfocyttall
- Påvisning AV CMV-DNA i forskjellige prøver
- Diskusjon
- Konklusjoner
- Bekreftelser
- Fotnote
Innledning
Cytomegalovirus (CMV) Er et vanlig herpesvirus som er utbredt på tvers av humane populasjoner. CMV-infeksjon forårsaker vanligvis ikke symptomer og påvirker hovedsakelig spyttkjertlene, nyrene og andre organer. Viral replikasjon kan imidlertid forekomme hos immunkompromitterte pasienter og kan bidra til skade på organer og deres funksjoner. Opportunistiske infeksjoner er hyppigere og mer alvorlige HOS HIV / AIDS-pasienter. CMV – virusinfeksjon er vanlig hos disse pasientene og kan påvirke flere organer/systemer, inkludert øyne, lunger, nervesystem og fordøyelsessystem. Mange studier har undersøkt de virologiske og immunologiske egenskapene ved enkel CMV-infeksjon (1), spesielt de som finnes hos kvinner og barn. De immunologiske egenskapene TIL CMV-infeksjon er imidlertid ganske unike hos ALLEREDE immunkompromitterte HIV / AIDS-pasienter. Det er forskjeller i kliniske karakteristika, behandlingstiltak, prognostiske faktorer mellom HIV-pasienter med CMV-infeksjon og DE med CMV-infeksjon alene (2). Retningslinjen I Kina anbefalte at umiddelbart antiviral terapi AV CMV og ART er nødvendig hos DE HIV / AIDS-pasientene med komplikasjoner (retinitt, lungebetennelse, CMV encefalitt, enteritt, etc.) NÅR CMV-infeksjon er identifisert. På grunn av ikke-spesifisitet av kliniske symptomer forårsaket AV CMV-infeksjon, er laboratorieundersøkelse hovedgrunnlaget for diagnosen CMV-infeksjon. DE to mest brukte kliniske metodene ER CMV – virusreplikasjon og serumimmunologiske metoder, inkludert deteksjon AV CMV IgG, CMV IgM og CMV antigen PP65 (2) hos pasienter med nedsatt immunfunksjon, er produksjonen AV CMV-antistoff svekket eller forsinket, noe som kan føre til falsk negativ og øke frekvensen av savnet diagnose, DERFOR HAR PCR-deteksjon AV CMV-DNA i stor grad blitt standardmetoden for diagnose AV CMV-infeksjon og overvåking av behandling (3). Daisuke Mizushima et al. rapportert at plasma CMV-DNA PCR har viktig verdi i diagnosen FOR BÅDE CMV retinitt og all CMV-EOD hos pasienter med fremskreden HIV-1-infeksjon(4). CMV-DNA PCR kan påvises i en rekke prøvetyper som plasma, urin, cerebrospinalvæske, vandig humor, avføring, etc. (5). Imidlertid har få artikler analysert og diskutert betydningen og verdien AV CMV-DNA PCR-deteksjon i andre prøver enn plasma. I denne studien analyserte vi i ettertid laboratorietester (INKLUDERT CMV-DNA, CMV antistoff, CD4 + T lymfocyttall, HIV virusmengde, etc.) i 808 HIV / AIDS-pasienter som ble behandlet i vårt senter fra 2017 til 2019 for å forstå CMV-koinfeksjonen og styrken og svakhetene i flere deteksjonsmetoder. Vi presenterer følgende artikkel/sak i henhold TIL MDAR reporting checklist (tilgjengelig på http://dx.doi.org/10.21037/apm-20-1352).
Metoder
Fag
totalt 808 HIV/AIDS-pasienter innlagt på vårt senter mellom januar 2017 og oktober 2019 ble registrert. HIV-RNA, CD4 + t lymfocyttall, CMV-DNA OG relaterte antistoffer ble målt i hver pasient. DIAGNOSEN AV HIV-infeksjon var basert PÅ HIV / AIDS Diagnose Og Behandlingsretningslinjer (tredje utgave) (6), og alle pasienter ble bekreftet SOM HIV-infeksjon av Fuzhou Kommunale Sentre FOR Sykdomskontroll (CDC) eller den lokale CDC som behandlet pasienten. DIAGNOSE AV CMV-infeksjon var basert på følgende kriterier: (I) CMV-DNA-positiv i plasma, alveolær skyllevæske, urin, cerebrospinalvæske (CSF) og/eller andre kroppsvæsker; (II) serum CMV-immunoglobulin m (IgM) positiv; (III) en oftalmologisk diagnose AV CMV retinitt; (IV) CMV lungebetennelse hovedsakelig manifestert som feber, hoste, slim, og tetthet i brystet; CMV-DNA positiv i alveolar lavage væske; (V) CMV enteritt eller øsofagitt hovedsakelig manifestert som dysfagi/svelge smerte, diare, eller magesmerter, og effektiv diagnostisk anti-CMV behandling; (VI) CMV encefalitt manifestert som nervesystemet symptomer og CMV-DNA positiv I CSF eller hjernevev; (VII) CMV hepatitt manifestert som feber, unormal leverfunksjon, og ubehag i leveren området, OG CMV-DNA positiv i LEVEREN.biopsi. EN DIAGNOSE AV CMV-infeksjon ble gjort dersom noen av de ovennevnte kriteriene unntatt punkt (II) var oppfylt, eller hvis punkt (II) pluss et annet kriterium var oppfylt (7).
alle prosedyrer utført i denne studien som involverte menneskelige deltakere var i samsvar Med Helsinkideklarasjonen (som revidert i 2013). Studien ble godkjent av medical ethics committee i vårt senter (godkjenning Nr. KS2019-070-01). Dataene er anonyme, og kravet om informert samtykke ble derfor frafalt.
Inklusjon og eksklusjon
Inklusjonskriterier: PASIENTER MED HIV / AIDS som først besøkte Mengchao Hepatobiliary Hospital Of Fujian Medical University og fullførte deteksjon AV HIV-RNA, CMV-DNA, CMV-IgG antistoff, CMV-IgM antistoff og CD4+ t-lymfocytter innen 14 dager. Ekskluder HIV / AIDS-tilfeller som ikke kan fullføre de ovennevnte testelementene på grunn av utilstrekkelig prøvestørrelse.
Reagenser og utstyr
HIV-RNA-kvantifisering
Fluorescerende kvantitativ sanntidspolymerasekjedereaksjon (PCR) (FQ-PCR) ble utført På Mx3000p QPCR-systemet (Agilent, USA) ved hjelp AV HIV-RNA-kvantifiseringssettet produsert Av QiaGen (Shenzhen, Kina).
CD4 + t lymfocyttelling
instrumentet som ble brukt var FACSCalibur flow cytometer (BD Biosciences, USA), og reagenssettet som ble brukt VAR Bd Multitest CD3/CD4 / CD8 / CD45 (BD Biosciences, USA).
CMV-DNA-kvantifisering
FQ-PCR ble utført På Mx3000p QPCR-systemet (Agilent, USA) for å oppdage CMV-DNA-nivåene i plasma, urin og CSF. Kittet som ble brukt ble produsert Av Sansure Biotech (Hunan, Kina).
CMV antistofftest
Kjemiluminescens immunoassay ble utført for å oppdage anti-CMV-IgG og IgM antistoffer På Cobas e601 analyzer (Roche Diagnostics, Tyskland) med støttesett (Roche Diagnostics, Tyskland).
Studiemetoder
nukleinsyredeteksjon
etter AT HIV/AIDS-pasientene ble innlagt på vårt sykehus, ble 3 mL fastende etylendiamintetraeddiksyre (EDTA)-antikoagulert fullblodprøve samlet og deretter sentrifugert ved 3000 r/min i 5 minutter for å høste 200 µ plasma for HIV-RNA og CMV-DNA-deteksjon. Hos alle pasienter ble 5 mL urinprøve samlet om morgenen og blandet grundig, og deretter ble 200 µ høstet FOR cmv-DNA-deteksjon. For pasienter med nevrologiske symptomer ble 1 mL CSF oppnådd FOR CMV-DNA-deteksjon. I henhold til deteksjonsgrensen og positiv bedømmelsesstandard FOR CMV-DNA-sett og HIV-RNA-sett. Prøvene ble vurdert som positive hvis CMV-DNA-verdien var over 400 kopier / mL, ELLER HVIS HIV-RNA-nivået var over 500 kopier / mL.
Påvisning av undergrupper Av t-lymfocytter
HOS HIV/AIDS-pasientene ble 3 mL EDTA-antikoagulert fastende fullblodprøve samlet ved opptak og deretter blandet grundig for deteksjon Av undergrupper Av t-lymfocytter på ET Bd FACSCalibur-flowcytometer ved bruk av tilleggsreagensene.
Påvisning av immunantistoffer
HOS HIV / AIDS-pasientene ble 3 mL fastende blodprøve samlet ved opptak, sentrifugert ved 3000 r / min i 5 minutter i et serumrør med gel separator, og deretter testet på maskinen.
Alle ovennevnte tester ble utført strengt i samsvar med reagensinstruksjonene i produsentens håndbok og standard driftsprosedyrer for instrumentene.
Statistisk analyse
Statistisk analyse ble utført VED HJELP AV spss 21.0 programvare. Normalfordelte måledata presenteres ved bruk av gjennomsnittlig ± standardavvik (x ±SD), og ikke-normalfordelte data uttrykkes som median (25-75 persentiler). Telledataene er uttrykt i prosenter og satser. Sammenligningen av de ikke-normalfordelte måledataene mellom to grupper ble utført ved å bruke en ikke-parametrisk rang sum test, mens telledataene ble sammenlignet ved Hjelp Av Chi-kvadrat testen. En p-verdi på < 0,05 ble ansett som statistisk signifikant.
Resultater
Generelle data
generelle data fra 808 HIV/AIDS-pasienter er oppsummert I Tabell 1. Kjønn og alder viste ingen signifikant forskjell MELLOM CMV-gruppen og ikke-CMV-gruppen. Det absolutte CD4-antallet I DEN CMV-infiserte gruppen var signifikant lavere enn I DEN CMV-uinfiserte gruppen (Z=-8,87, P < 0,001), OG HIV-RNA-nivået var signifikant høyere i DEN CMV-infiserte gruppen enn i den ikke-CMV-infiserte gruppen (Z=-3,207, P < 0,05) (Tabell 1).
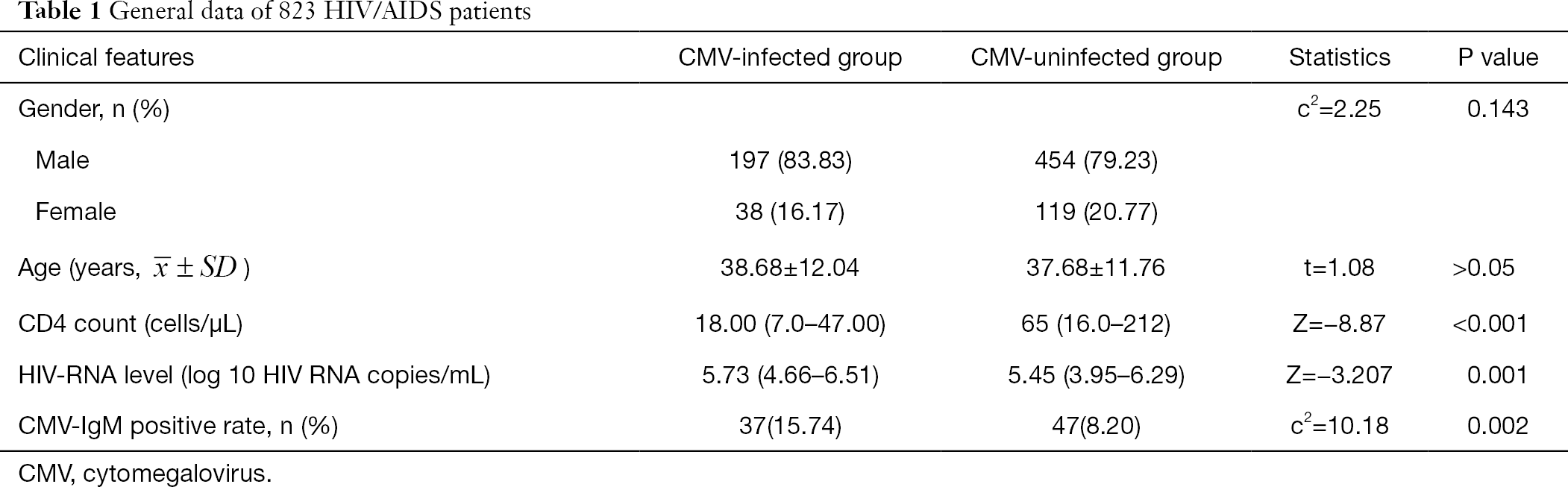
Full tabell
Positive rater AV CMV-DNA, CMV-IgG Og CMV-IgM
DEN totale positive raten AV CMV-DNA var 29,08% (235/808); spesielt var Det 5,70% (13/228) I Csf 26,01% (77/296) i plasma og 25,75% (180/699) i urin. DEN positive frekvensen AV CMV-IgG var 99,8% (806/808), OG den positive frekvensen AV CMV-IgM var 10,40% (84/808).
Korrelasjon MELLOM CMV-infeksjon ogcd4 + t lymfocyttall
etter gruppering AV CD4 + T lymfocyttall, fant vi at andelen pasienter infisert med cytomegalovirus ved lav frekvens AV CD4 + T lymfocytt var større enn for ikke-CMV infiserte pasienter. Forekomsten AV CMV-infeksjon økte med nedgangen I CD4-antallet (Tabell 2).
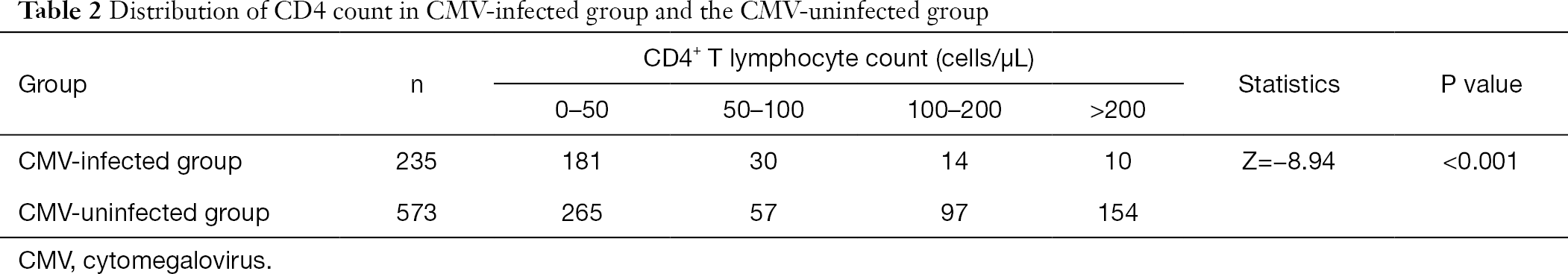
Full tabell
Påvisning AV CMV-DNA i forskjellige prøver
av disse 808 pasientene fikk 198 pasienter også tester for plasma-OG urin CMV-DNA OG plasmaantistoffer.-cmv-igg og cmv-igm antistoffer. Ved Å bruke Chi-kvadratisk analyse for sammenkoblede data, utførte vi parvise sammenligninger av URIN CMV-DNA og plasma CMV-DNA med plasma CMV-IgM antistoff, henholdsvis. Det ble funnet at resultatene av URIN-OG plasma-cmv-DNA-deteksjon var signifikant forskjellig fra resultatene av plasma-CMV-IgG-antistoffanalyse (P< 0,001), mens resultatet av plasma-CMV-DNA-deteksjon ikke var signifikant forskjellig fra RESULTATENE av URIN-cmv-DNA-deteksjon (P>0,05) (Tabell 3,4).

Full tabell
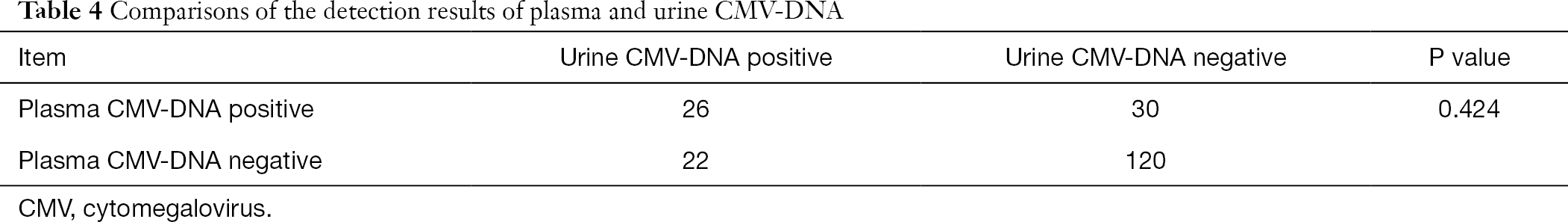
Full tabell
Diskusjon
CMV er medlem av gruppen som tilhører β-herpesvirus og er karakterisert ved sin strenge artsspesifisitet og utbredt forekomst i humane populasjoner. CMV seroprevalens er ca 85% hos barn og opptil 95% hos voksne. I vår nåværende studie nådde den positive frekvensen AV CMV-IgG 99,8%. CMV er latent i de fleste tilfeller, men hos immunkompromitterte individer replikerer viruset eksponentielt og sprer seg gjennom hele kroppen med blodet, forårsaker CMV viremi og til og med organisk CMV sykdom (8). CMV-infeksjon er en av de vanligste opportunistiske infeksjonene HOS HIV / AIDS-pasienter. CD4 + t-lymfocytter er MÅLCELLENE TIL HIV-viruset, og deres teller kan ofte gjenspeile AIDS og kan også brukes som indikator for å evaluere IMMUNSTATUS HOS AIDS-pasienter. DENNE studien analyserte CMV-infeksjon, CD4-tall og HIV-RNA-nivå hos 808 pasienter MED HIV / AIDS. Vi fant at DEN positive frekvensen AV CMV hos AIDS-pasienter økte med reduksjonen AV CD4-tall og med økningen AV HIV-virusmengde. Også i vår nåværende studie hadde opptil 77,02% AV CMV-positive pasienter ET CD4-tall på <50 celler / µ, noe som tyder på AT CD4 < 50 celler/µ er en risikofaktor FOR HIV-CMV-koinfeksjon, noe som er i samsvar med funn Av Deng et al. (9). Det kvantitative NIVÅET AV HIV-RNA i CMV-infisert gruppe var høyere enn DET I CMV uinfisert gruppe, noe som indirekte antydet at høye NIVÅER AV HIV – rna virusmengde var en annen risikofaktor FOR CMV-infeksjon HOS HIV / AIDS-pasienter .Det anbefales derfor at PASIENTER med HIV/AIDS starter ART-behandling så snart som mulig for å fremme immunrekonstituering for å forhindre opportunistiske infeksjoner, og screening for HCMV er avgjørende for HIV / AIDS-pasienter med CD4-tall på <50 celler / µ (2).
vi evaluerte også verdiene av virale nukleinsyreanalyser og immunologiske metoder ved klinisk påvisning AV CMV-infeksjon. Studier I Kina og internasjonalt har vist AT CMV-DNA vises tidligere enn de kliniske symptomene og serologiske reaksjonene AV CMV-infeksjoner. FQ-PCR er for tiden den mest nøyaktige og raske mikrobielle kvantifiseringsmetoden og er i stand til å overvinne noen problemer med tradisjonell PCR (f.eks. I vår nåværende studie var den positive frekvensen AV CMV-DNA 5.70% (13/228) I CSF-prøvene av 228 pasienter med nevrologiske symptomer, som var mye lavere enn i plasma-og urinprøver, noe som kan forklares av blod-hjernebarrieren og organfølsomhet. Anti-CMV-IgM-antistoffet brukes ofte som en markør for aktiv virusinfeksjon; den positive frekvensen av ANTI-CMV-IgM-antistoffet var imidlertid bare 10,40% (84/808) hos VÅRE HIV/AIDS-pasienter, som var lavere enn den positive frekvensen AV CMV-infeksjon rapportert i ikke-HIV/AIDS-populasjonen (11). I tillegg hadde den positive frekvensen dårlig avtale med resultatene av nukleinsyredeteksjon, noe som kan skyldes svekket immunforsvar eller på grunn av forsinket generering Av IgM-antistoffer HOS HIV/AIDS-pasienter. Påvisning AV CMV-IgM-antistoff har derfor en begrenset rolle i HCMV-screening hos HIV / AIDS-pasienter. Videre var den positive frekvensen AV CMV-infeksjon hos 808 pasienter 29,05% (235/808) i vår nåværende studie, noe som er litt høyere enn 21,85% rapportert Av Li et al., og kan skyldes større utvalg av prøver (inkludert plasma, urin og CSF) samlet i denne studien (12). DEN positive frekvensen AV CMV-DNA var 25,57% i urin og 26,01% i plasma, forskjellen var ikke statistisk signifikant. VI anbefaler DERFOR AT cmv-DNA-screening i plasma og urin utføres når CD4 + T-lymfocyttallet er mindre enn 200 celler / µ, spesielt når <50 celler / ④l; i tillegg er det nødvendig å påvise CMV-DNA i CSF hvis åpenbare nevrologiske symptomer er tilstede.
Konklusjoner
som konklusjon er lavt CD4+ t lymfocyttall og høy HIV-1 virusmengde risikofaktorer FOR CMV-infeksjon HOS HIV / AIDS-pasienter. Påvisning av CMV-DNA i urin eller plasma ved FQ-PCR er svært verdifullt ved screening AV CMV-infeksjon HOS HIV / AIDS-pasienter, mens påvisning av CMV-IgG-og CMV-IgM-nivåer i blod har begrenset klinisk verdi. BLOD ELLER urin CMV-DNA-screening anbefales FOR AIDS-pasienter for å forebygge OG diagnostisere CMV-infeksjon tidlig og forbedre livskvaliteten.
Bekreftelser
Finansiering: Sponset Av Nøkkel Klinisk Spesialitet Disiplin Konstruksjon Program Av Fujian, Prc
Fotnote
Rapportering Sjekkliste: forfatterne har fullført MDAR rapportering sjekkliste. Tilgjengelig på http://dx.doi.org/10.21037/apm-20-1352
Data Sharing Statement: Tilgjengelig på http://dx.doi.org/10.21037/apm-20-1352
Interessekonflikter: alle forfattere har fylt UT ICMJE uniform disclosure form (tilgjengelig på http://dx.doi.org/10.21037/apm-20-1352). Forfatterne har ingen interessekonflikter å erklære.
Etisk Erklæring: forfatterne er ansvarlige for alle aspekter av arbeidet for å sikre at spørsmål knyttet til nøyaktigheten eller integriteten til noen del av arbeidet er hensiktsmessig undersøkt og løst. Alle prosedyrer utført i denne studien som involverte menneskelige deltakere var i samsvar med Helsinkideklarasjonen (som revidert i 2013). Studien ble godkjent av medical ethics committee i vårt senter (godkjenning Nr. KS2019-070-01). Dataene er anonyme, og kravet om informert samtykke ble derfor frafalt.
Open Access-Erklæring: dette er En open Access-artikkel distribuert i samsvar Med Creative Commons Attribution – NonCommercial-NoDerivs 4.0 International License (CC BY-NC-nd 4.0), som tillater ikke-kommersiell replikering og distribusjon av artikkelen med det strenge forbehold at det ikke gjøres endringer eller redigeringer, og det opprinnelige arbeidet er korrekt sitert(inkludert lenker til både den formelle publikasjonen gjennom den relevante DOI og lisensen). Se: https://creativecommons.org/licenses/by-nc-nd/4.0/.
- Yu X, Tong M, Han G. Effekter av cytomegalovirus infeksjon på regulatoriske immunceller hos gravide Kvinner Kinesisk. Tidsskrift For rettsvitenskap. 2017;27:2103-6.
- Det Nasjonale Vitenskaps-Og Teknologiprosjektet AIDS opportunistisk infeksjonsforskningsgruppe under den 13. femårsplanen. Ekspert konsensus om klinisk diagnose og behandling av AIDS komplisert med cytomegalovirus sykdom . Tidsskrift For Den Norske Legeforening: 1-17 .
- Hodowanec AC, Pikis A, Komatsu TE, Et al. Behandling OG Forebygging AV CMV-Sykdom Hos Transplantatmottakere: Nåværende Kunnskap og Fremtidige Perspektiver. J Clin Pharmacol 2019;59:784-98.
- Mizushima D, Nishijima T, Yashiro S, et al. Diagnostisk nytte av kvantitativ plasma cytomegalovirus DNA PCR for cytomegalovirus endorganiske sykdommer hos pasienter MED HIV-1-infeksjon. J Acquir Immun Defic Syndr 2015; 68:140-6.
- Michaelides A, Liolios L, Glare EM, Et al. Økt humant cytomegalovirus (HCMV) DNA-belastning i perifere blodleukocytter etter lungetransplantasjon korrelerer med HCMV pneumonitt. Transplantasjon 2001; 72: 141-7.
- infeksjon av nevrologi, AIDS gruppe Av Kinesisk medisinsk forening. HIV / AIDS diagnose og behandling retningslinjer (tredje utgave). Kinesisk Tidsskrift For Smittsomme Sykdommer 2015; (10): 577-93.
- Corrales I, Gim@nez E, Solano C, Et al. Forekomst og dynamikk av aktiv cytomegalovirusinfeksjon hos allogene stamcelletransplanterte pasienter i henhold til enkeltnukleotidpolymorfismer i DONOR og mottaker CCR5 -, MCP-1 -, IL-10-og TLR9-gener. J Med Virol 2015; 87: 248-55.
- Tagarro A, Del Valle R, Dominguez-Rodrí S, et al. Vekstmønstre Hos Barn Med Medfødt Cytomegalovirusinfeksjon. Pediatr Infiserer Dis J 2019; 38: 1230-5.
- Deng X, Liu J, Zhang M, Et al. Analyse av virologiske og immunologiske egenskaper VED HIV / AIDS kombinert med cytomegalovirusinfeksjon. Kinesisk Journal For Sykehusinfeksjon 2019;29: 2241-6.
- Kawano Y, Kawada J, Kamya Y, et al. Analyse av sirkulerende humane og virale mikrorna synd pasienter med medfødt cytomegalovirus infeksjon. J Perinatol 2016;36: 1101-5.
- Li L, Gao S, Zhang T, et al. Sammenligning AV DNA-deteksjon Og IgM-deteksjon av human cytomegalovirusinfeksjon og diskusjon av deres kombinerte applikasjonsverdi. Kinesisk Tidsskrift For Eksperimentell Diagnostikk 2015; (1): 78-80.
- Li X, Cao L, Yu C, et al. Studie om infeksjon av cytomegalovirus hos AIDS-pasienter. Moderne Forebyggende Medisin 2012;39:2278-9.
(English Language Editor: J. Gray)