Frontiers In Medicine
- Introduksjon
- Pasienter Og Metoder
- Pasientvalg I Overvåkings -, Epidemiologi-Og Sluttresultatdatabasen
- Statistisk Analyse
- Resultater
- Pasientkarakteristika
- Forbedret Risiko For T1 Stadium Sammenlignet Med Andre T Stadier I Sammenheng Med Serum Cea Elevasjon
- Effekt Av Preoperativ Serum Cea-Elevasjon I T-Trinn
- Diskusjon
- Datatilgjengelighetserklæring
- Etikkerklæring
- Forfatterbidrag
- Interessekonflikter
- Takk
Introduksjon
Rektal kreft er en av de vanligste malignitetene i verden (1). IFØLGE AMERICAN Joint Committee On Cancer (AJCC) staging system, er den anatomiske omfanget av primær tumor (T-stadium) en av de viktigste prognostiske prediktorene. Pasienter med samme T-stadium av rektal kreft kan imidlertid vise betydelig forskjellige kliniske utfall.
først rapportert i 1965 er karsinoembryonisk antigen (CEA) et 180-200 kDa glykoprotein og medlem av immunglobulin superfamilien (2). CEA utskilles av en rekke faste svulster, inkludert 90% av kolorektal kreft (3). Som den viktigste og mest pålitelige serumprognostiske biomarkøren i kolorektal kreft, er forhøyede preoperative CEA-nivåer funnet å være assosiert med dårligere prognose for kolorektal kreft (4-9).
Tidligere studier har vist AT CEA var assosiert med kreftcelleadhesjon og medfødt immunitet i kolorektal kreft. I TILLEGG ble CEA også rapportert å lette vedlegg av kolorektale kreftceller til steder med metastase og støtte tumorprogresjon (10-12).
Tradisjonelt har den fjerne spredningen av tumorceller vært ansett som en sen hendelse, men funn fra flere tidligere studier indikerte at oppkjøp av metastatisk potensial kunne forekomme i svært tidlig stadium av tumorprogresjon (13-16). Wo et al. (17) rapportert at en svært liten tumorstørrelse involvert i lymfeknudepositivitet kan være en surrogat for aggressiv biologi. Vi mistenker da at veldig tidlig stadium rektal kreft med serum CEA høyde kan foreslå tidlig oppkjøp av metastatisk potensial og forutsi en svært dårlig overlevelse av rektal kreft.
det ble imidlertid rapportert få studier for å undersøke sammenhengen Mellom t-stadium og serum CEA-nivåer (C0 Og C1) for å bestemme prognosen for rektal kreft. Derfor gjennomfører vi denne store populasjonsbaserte studien for å undersøke om svært tidlig T-stadium i sammenheng med serum CEA-høyde kan være et surrogat for biologisk aggressiv sykdom og forutsi for dårlig årsaksspesifikk overlevelse (CSS) av rektal kreft. For å fjerne effekten av lymfeknutepositivitet på vår forskning, ekskluderte vi lymfeknutepositive pasienter og fokuserte analysen på stadium I-II-pasienter.
Pasienter Og Metoder
Pasientvalg I Overvåkings -, Epidemiologi-Og Sluttresultatdatabasen
SOM en autoritativ kilde til informasjon om kreftforekomst Og overlevelse i USA og en omfattende kilde til befolkningsbasert informasjon, inkludert alle nylig diagnostiserte krefttilfeller som forekommer I Overvåkings -, Epidemiologi-og Sluttresultat (SEER) – deltakende områder, omfatter seer-databasen ~28% av Den Amerikanske befolkningen. SEER-databasen inneholdt ingen identifikatorer og var offentlig tilgjengelig for forskere. Seer * Stat er en programvare levert AV SEER program for å få pasientinformasjon ved hjelp av elektronisk tilgang. I begynnelsen ble saksoppføringssesjonen TIL SEER*Stat software (SEER*Stat 8.3.5) brukt til å liste all pasientrelatert informasjon, og pasienter diagnostisert med stadium i-II (node-negativ) endetarmskreft mellom 1. januar 2004 og 31. desember 2015 ble identifisert fra seer-databasen (Figur 1). Pasienter med endetarmskreft ble identifisert MED icd-O-3-områdekodene C199 Og C209 og adferdskode 3 (Naaccr-Punktene 522 og 523) (9). Vi valgte å inkludere disse årene fordi informasjonen om preoperativt serum CEA ble registrert fra 2004 og SEEROPPFØLGING avsluttet i 2015.

Figur 1. Flytskjema for pasientkohortdefinisjoner.
deretter ble de som fikk neoadjuvant strålebehandling, mangel på positiv histologisk bekreftelse, med ukjent rase, ikke-adenokarsinom histologier eller ikke aktiv oppfølging ekskludert fra vår studie. Pasienter med preoperativt serum CEA nivå tilgjengelig ble inkludert i vår studie, og vi grupperte “positiv / forhøyet” og ” negativ / normal; innenfor normale grenser ” Som C1 Og C0 (c-trinns informasjon). Cutoff-verdiene FOR CEA var henholdsvis 2,5 ng/ml for ikke-røykere og 5 ng/ml for røykere. I tillegg ble følgende pasientklinikkopatologiske variabler hentet fra seer-databasen: t-stadium, rase, kjønn, tumorplassering, alder ved diagnose, diagnoseår, grad og histologi.
Statistisk Analyse
I denne studien Ble Pearsons chi-squared test brukt til å sammenligne alle pasientenes klinikopatologiske variabler hentet fra seer-databasen mellom normale og forhøyede preoperative serum CEA nivåer. Noen multivariable cox proporsjonal fare modeller ble bygget for å identifisere uavhengige prognostiske variabler av endetarmskreft i våre analyser. Overlevelseskurver ble generert Ved Hjelp Av Kaplan-Meier-metoden, og forskjeller mellom kurvene ble analysert ved log-rank test. De primære utfallene av interesse i denne studien var CSS og total overlevelse (OS). CSS ble beregnet fra diagnosedagen til datoen for kreftspesifikk død. Dødsfall knyttet til endetarmskreft ble behandlet som hendelser, og dødsfall fra andre årsaker ble behandlet som sensurerte observasjoner på dødsdato. For å avgjøre om det var en signifikant interaksjon mellom preoperativt serum CEA-nivå og T-stadium i å forutsi CSS, definerte vi også en interaksjonsvariabel (T-stadium og serum CEA-nivå). Tosidig P < 0,05 ble ansett som statistisk signifikant. Statistiske analyser ble hovedsakelig utført MED SPSS versjon 22 (IBM Corporation, Armonk, NY, USA).
Resultater
Pasientkarakteristika
Totalt ble 19 184 pasienter diagnostisert med rektalkreftpasienter i stadium I–II identifisert fra seer-databasen mellom 1.januar 2004 og 31. desember 2015 (Figur 1). Av disse pasientene ble 13.007 (67.8%) pasienter tildelt C0 stadium, og 6.177 (32.2%) pasienter ble tildelt C1 stadium. AJCC staging system foreslo at 6,077 pasienter var I t1-scenen, 4,783 pasienter I T2-scenen, 7,021 I T3-scenen og 1,303 var I T4-scenen. Totalt 2560 (13,3%) pasienter døde av endetarmskreft ved slutten av oppfølgingstiden. Median oppfølgingstid for hele kohorten var 44 måneder (0-143 måneder). Pasientenes baseline karakteristika er oppsummert I Tabell 1.
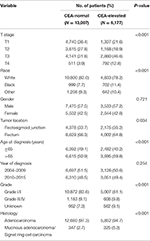
Tabell 1. Sammenligning av baseline karakteristika for stadium i–II rektal kreft med serumkarcinoembryonisk antigen (CEA) nivå.
Forbedret Risiko For T1 Stadium Sammenlignet Med Andre T Stadier I Sammenheng Med Serum Cea Elevasjon
Det ble funnet At c1 stadium var mer sannsynlig å korrelere med høyere T stadium, svart, rektosigmoid veikryss, eldre alder, høyere grad,og mucinous adenokarsinom / Signet ringcellekarsinom (Tabell 1, P < 0,05). Som vist i Tabell 2 ble rase, kjønn, tumorplassering, diagnosealder, diagnoseår, grad, histologi, t-stadium og serum CEA-nivå inkludert i den multivariate cox-analysen. Når multivariat Cox-analyse ble utført, overbeviste vi følgende kliniske karakteristika som uavhengige prognostiske faktorer i stadium I–II rektal kreft; disse inkluderte rase, kjønn, tumorplassering, alder ved diagnose, tumorgrad, T-stadium og serum CEA-nivå, mens risikoen Mellom T2, C0 og T1,C0 ikke var statistisk forskjell (P = 0,925). Det ble vist at, i sammenheng med serum cea høyde, t1 stadium presentert uventet høyere risiko for rektal-kreft – spesifikk dødelighet sammenlignet med stadier T2 Og T3. Ved Stadium T1-sykdom var forhøyet nivå av serum CEA forbundet med 227,6% økt risiko for dødelighet sammenlignet med normalt nivå av serum cea.

Tabell 2. Multivariate cox regresjonsanalyser av årsaksspesifikk overlevelse (CSS) i stadium I-II endetarmskreft.
kaplan-Meier overlevelseskurver er tegnet inn I Figur 2, 3. DEN 5-årige CSS-frekvensen var 92,2% I T1C0, 75,2% I T1C1, 93,1% I T2C0, 86,7% I T2C1, 84,6% I T3C0, 76,3% I T3C1, 62,9% I T4C0 og 43,6% I T4C1 (Figur 2, P < 0,001). DERFOR presenterte T1C1 en lignende 5-årig CSS-rate sammenlignet med T3C1 (75.2 vs 76.3%, P = 0.238). I TILLEGG var funnet enda mer uttalt I OS. 5-års OS rate var 78.6% I T1C0, 48.3% I T1C1, 77.1% I T2C0, 62.3% I T2C1, 68.5% I T3C0, 54.5% I T3C1, 45.3% I T4C0, og 30.0% I T4C1 (Figur 3, P < 0.001). T1C1 presentert betydelig lavere 5-års CSS rate sammenlignet MED T3C1 (48.3 vs. 54.5%, P < 0.001).
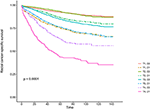
Figur 2. Kaplan-Meier cause-specific survival (CSS) kurver av T stadium kombinert med serum carcinoembryonic antigen (CEA) nivå.
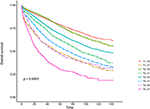
Figur 3. Kaplan-Meier total overlevelse (OS) kurver Av T stadium kombinert med serum carcinoembryonic antigen (CEA) nivå.
Effekt Av Preoperativ Serum Cea-Elevasjon I T-Trinn
skogplottet ble tegnet for å vise fareforholdet (HRs) for å sammenligne CSS mellom normal – OG forhøyet-CEA-grupper i respektive t-trinn (Figur 4). Sammenlignet med normalt nivå av serum CEA, i stadium T2, var forhøyet nivå av serum CEA assosiert med 69,0% økt risiko for rektal-kreft-spesifikk dødelighet ; i stadium T3 var forhøyet nivå av serum cea assosiert med 67,2% økt risiko FOR rektal-kreft-spesifikk dødelighet (HR = 1,672, 95% CI = 1,486–1,882, P < 0,001); i stadium T4 var forhøyet nivå av serum cea assosiert med 81,3% økt risiko for rektal-kreft-spesifikk dødelighet.risiko for rektal–kreft-SPESIFIKK DØDELIGHET (hr = 1,813, 95% ki = 1,485-2,213, p < 0,001); DERIMOT, i fase t1, forhøyet nivå av serum cea presentert selv OPP TIL 211.6% økt risiko for rektal-kreft-spesifikk dødelighet (HR = 3,116, 95% KI = 2,639-3,679, P < 0,001).
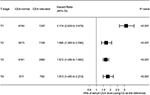
Figur 4. Hazard ratio (HRs) av årsaksspesifikk overlevelse (CSS) mellom normalt og forhøyet nivå av serumkarsinoembryonisk antigen (CEA) i Henhold Til t-stadiet.
Diskusjon
vi hadde som mål å undersøke foreningen Av t-stadium og serum CEA nivåer for å bestemme CSS av rektal kreft. Vi antydet at rektal kreft med svært tidlig T-stadium (stadium T1) og serum CEA-høyde kan være en biologisk surrogat for aggressiv sykdom, og dermed forutsi et dårlig onkologisk utfall. Med ~20.000 pasienter diagnostisert med stadium I-II rektal kreft inkludert i vår studie.
i denne studien ble det funnet at serum CEA-forhøyelse var mer sannsynlig å korrelere med høyere T-stadium, svart, rektosigmoid kryss, eldre alder og høyere grad og mucinøst adenokarsinom/Signet ringcellekarsinom. Kaplan-Meier overlevelsesanalyser viste at i sammenheng med serum CEA-økning var 5-årig CSS-rate av stadium T1 75,2%, som ikke oppnådde statistisk forskjell fra stadium T3 (76,3%). Når det gjelder total overlevelse, VAR 5-års OS-hastighet på stadium T1 med preoperativ serum CEA-høyde (48,3%) enda lavere enn stadium T3 involvert I CEA-høyde (54,5%) og oppnådde ikke statistisk forskjell fra stadium T4(45 .3%), noe som betyr forhøyet preoperativt serumnivå AV CEA, kunne identifisere en undergruppe av stadium T1 rektal kreft med lignende CSS sammenlignet med noen stadium T3 sykdommer og med lignende OS sammenlignet med noen stadium T4 sykdommer.
etter justering for kjente prognostiske faktorer for endetarmskreft (rase, kjønn, tumorplassering, diagnosealder, diagnoseår, grad og histologi), ble interaksjonsvariabelen (t-stadium og serumcea-nivå) vi definerte vist å være en uavhengig prognostisk faktor for endetarmskreft. Multivariat cox analyse viste at, i sammenheng med serum cea høyde, t1 stadium presentert uventet høyere risiko for rektal-kreft – spesifikk dødelighet sammenlignet med stadier T2 og T3. Ved Stadium T1-sykdom var forhøyet nivå av serum CEA forbundet med 227,6% økt risiko for dødelighet sammenlignet med normalt nivå av serum cea. I tillegg ble rase, kjønn, tumorplassering, alder ved diagnose og tumorgrad også identifisert som uavhengige prognostiske faktorer for stadium I-II rektal kreft. Bortsett Fra T1 ble det funnet at preoperativ serum CEA-høyde presenterte ~75% høyere risiko for rektal-kreft – spesifikk dødelighet i respektive T-stadium, men tallet økte kraftig til 211.6% I T1-stadium.
I 2000 foreslo Den Kolorektale Arbeidsgruppen I AJCC inkluderingen av serumnivå AV CEA (c-stadium) i det konvensjonelle AJCC TNM-staging-systemet for kolorektal kreft (18). Videre Har American Society Of Clinical Oncology og European Group On Tumor Markers begge støttet inkludering av preoperativt serum CEA nivå som et prognostisk verktøy i kolorektal kreft (19-21).
Flere tidligere undersøkelser rapporterte serumcea-nivået som en sterk prognostisk rolle i tykktarmskreft (4-7, 22-26). I 2011 Ble Thirunavukarasu et al. (25) rapporterte at preoperativt serum CEA-nivå var en uavhengig prognostisk biomarkør av kolonkreft, og prognosen var verre hos høye CEA-pasienter med lavere stadium sammenlignet med lave CEA-pasienter med høyere stadium. I den studien ble høy CEA til og med ansett som sterk som node positivitet for å forutsi dårlige onkologiske utfall av tykktarmskreft.
likevel fokuserer få studier på å belyse prognostisk rolle av serum CEA nivå i rektal kreft. I 2016, også ved hjelp AV seer database, Tarantino et al. (9, 27) gjennomførte de to store befolkningsbaserte undersøkelsene, som ga overbevisende bevis på at forhøyet nivå av preoperativ serum CEA var en sterk prediktor for verre total og kreftspesifikk overlevelse i rektal kreft. I 2018, Liu Et al. (8) viste at preoperativ serum CEA var en uavhengig prognostisk faktor for rektal kreft, og forhøyet serum CEA-nivå presenterte tydeligvis dårligere overlevelse sammenlignet med normalt serum cea-nivå i trinn I-IV. de eneste to tidligere studiene fokuserte Imidlertid på å undersøke prognostisk rolle av preoperativt serum cea-nivå, undersøkte ikke sammenhengen MELLOM CEA-nivå og T-stadium for å forutsi tumorutfall av rektal kreft.
selv om det konvensjonelle viser at kreft får metastatisk potensial trinnvis etter hvert som de vokser til en stor størrelse (28), indikerte noen tidligere studier at oppkjøp av metastatisk potensial kunne oppstå veldig tidlig i tumorprogresjon. En tidligere forskning viste den ekstremt dårlige overlevelsen av svært liten tumorstørrelse når involvert i lymfeknutepositivitet (17). I tillegg viser funn av vår forskning at forhøyelse av preoperativt serum CEA-nivå i svært tidlig stadium (stadium T1) rektal kreft er forbundet med svært dårlig OS og CSS og kan være en surrogat av aggressiv biologi. Vi tror at både lymfeknute involvering og serum cea elevasjon anses som oppkjøpet av metastatisk evne. Vår studie, kombinert Med At Av Wo et al. konsekvent støtte den nevnte ideen om at oppkjøp av metastatisk potensial kan forekomme veldig tidlig i tumorprogresjon, og dermed forbundet med dårlige onkologiske utfall, og den første biologiske funksjonen er mer sannsynlig å bestemme potensialet for fjern metastase under kreftprogresjon, snarere enn den akkumulerte metastasiske evnen (29).
videre er funnene i vår studie av klinisk betydning. For tiden behandles stadium i rektal kreft med radikal kirurgisk reseksjon alene på grunn av relativt gunstige onkologiske utfall. Imidlertid vil ca. 10-15% av pasientene utvikle tumorresept etter radikal reseksjon (30, 31). I denne studien, vi tilfeldigvis identifisere en undergruppe av stadium T1 endetarmskreft med svært dårlig prognose sammenlignet med resten av stadium i endetarmskreft, noe som betyr at de stadium T1 endetarmskreft med involvering av preoperativ serum CEA høyde bør fange mer oppmerksomhet av onkologer.
det er imidlertid to begrensninger i vår studie. På den ene siden inkluderte denne studien ikke noen kjente prognostiske faktorer for rektal kreft i våre analyser, inkludert mikrosatellittstabilitetsstatus og postoperative komplikasjoner, som ikke var tilgjengelige FRA seer-databasen og kan innføre forstyrrelser i noen grad. Vi kan ikke gi områder og middelverdier FOR CEA i begge grupper. På den annen side var den nåværende studien retrospektiv i stedet for basert på prospektive data. Derfor må våre funn fortsatt valideres i andre kohorter, spesielt i store prospektive kliniske studier.
Til slutt viser vår studie at Stadium T1 rektal kreft, når den er involvert i preoperativ serum CEA-høyde, kan være en surrogat av biologisk aggressiv sykdom og korrelere med ugunstig OS og CSS. Videre fortjener denne undergruppen av rektal kreft mer klinisk oppmerksomhet hos onkologer. Våre funn, hvis validert i fremtidige databasestudier, ville gi en ny terapi ide for tidlig stadium rektal kreft.
Datatilgjengelighetserklæring
datasettene som genereres for denne studien, er tilgjengelige på forespørsel til den tilsvarende forfatteren.
Etikkerklæring
Pasienter i denne studien ble identifisert fra seerdatabasen, og godkjenningen for bruk av dataene ble innhentet gjennom en forespørsel sendt TIL SEER-programmet. Godkjenning av institutional review board var ikke nødvendig fordi seer database er offentlig tilgjengelig.
Forfatterbidrag
SW og WG har gitt et betydelig og direkte bidrag til denne studien, og godkjent den for innlevering.
Interessekonflikter
forfatterne erklærer at forskningen ble utført i fravær av kommersielle eller økonomiske forhold som kan tolkes som en potensiell interessekonflikt.
Takk
dette arbeidet ble støttet delvis Av Medisinsk Vitenskap Og Teknologi Utviklingsplan Prosjekt Av Yancheng (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global kreftstatistikk 2018: GLOBOCAN estimater av forekomst og dødelighet over hele verden for 36 kreftformer i 185 land. CA Kreft J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
2. Gull P, Freedman SÅ. Demonstrasjon av tumorspesifikke antigener i human colonic carcinomata ved immunologisk toleranse og absorpsjonsteknikker. J Exp Med. (1965) 121:439–62. doi: 10.1084 / jem.121.3.439
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
3. Goldstein MJ, Mitchell EP. Karsinoembryonisk antigen ved oppstart og oppfølging av pasienter med kolorektal kreft. Kreft Investere. (2005) 23:338–51. doi: 10.1081 / CNV-58878
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
4. Becerra AZ, Probst CP, Tejani MA, Aquina CT, Gonz@lez MG, Hensley BJ, et al. Evaluering av prognostisk rolle av forhøyede preoperative karsinoembryoniske antigennivåer hos kolonkreftpasienter: resultater fra national cancer database. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245 / s10434-015-5014-1
PubMed Abstrakt / Fulltekst / Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori S, Ushijima M, et al. Forhøyet preoperativt serumkarsinoembrionisk antigennivå kan være en effektiv indikator for behov for adjuvant kjemoterapi etter potensielt kurativ reseksjon av stadium II tykktarmskreft. J Surg Oncol. (2010) 99:65–70. doi: 10.1002 / jso.21161
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
6. Hm, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, et al. Identifikasjon av pasienter med høyrisiko stadium II kolonkreft for adjuvant behandling. Dis Kolon Endetarm. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-z
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
7. Spindler BA, Bergquist JR., Thiels CA, Habermann EB, Kelley SR, Larson DW, et al. Inkorporering av CEA forbedrer risiko lagdeling i stadium II tykktarmskreft. J Gastrointest Surg. (2017) 21: 770-7. doi: 10.1007 / s11605-017-3391-4
PubMed Abstrakt / Fulltekst / Google Scholar
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Kombinasjon av carcinoembryonisk antigen Med American Joint Committee on Cancer TNM staging system i rektal kreft: en reell og stor populasjonsbasert studie. Onco Mål Ther. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
9. Tarantino I, Warschkow R, Schmied BM, G ④ller U, Mieth M, Cerny T, et al. Prediktiv verdi AV CEA for overlevelse i stadium i rektal kreft: en populasjonsbasert tilbøyelighet score-matchet analyse. J Gastrointest Surg. (2016) 20: 1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Onkogen. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
12. Cai Z, Xiao J, Han X, Ke J, Zou Y, Chen Y, et al. Tilgang til ny prognostisk betydning av preoperativt karsinoembryonisk antigen i kolorektal kreft som mottar tumorreseksjon: mer enn positiv og negativ. Kreft Biomark. (2017) 19:161–8. doi: 10.3233 / CBM-160287
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, F ③stenberger G, Richter R, Et al. Prosessen med metastasering for brystkreft. Eur J Kreft. (2003) 39:1794–806. doi: 10.1016 / S0959-8049(03)00422-2
PubMed Abstrakt / Fulltekst / Google Scholar
14. H hryvnasemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. Systemisk spredning er et tidlig skritt i brystkreft. kreftceller. (2008) 13:58–68. doi: 10.1016 / j.ccr.2007.12.003
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
15. Podsypanina K, Du YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus H. Seeding og forplantning av untransformed mus mammary celler i lungen. Science. (2008) 321:1841–4. doi: 10.1126 / vitenskap.1161621
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ, et al. Fra latente disseminerte celler til åpen metastase: genetisk analyse av systemisk brystkreftprogresjon. Proc Natl Acad Sci usa. (2003) 100:7737–42. doi: 10.1073 / pnas.1331931100
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
17. Wo JY, Chen K, Neville BA, Lin NU, Punglia RS. Effekt av svært liten tumorstørrelse på kreftspesifikk dødelighet ved lymfeknutepositiv brystkreft. J Clin Oncol. (2012) 23:32–3. doi: 10.1016 / j. breastdis.2012.01.026
CrossRef Fulltekst | Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. American joint committee on cancer prognostiske faktorer konsensus konferanse: kolorektal arbeidsgruppe. Kreft. (2015) 88:1739–57. doi: 10.1002 / (SICI)1097-0142(20000401)88:7<1739::HJELP-CNCR30 >3.0.CO;2-T
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
19. Duffy MJ, van Dalen A, Haglund C, Hansson L, Holinski-Feder E, Klapdor R, et al. Tumormarkører ved kolorektal kreft: European Group on Tumor Markers (EGTM) retningslinjer for klinisk bruk. Eur J Kreft. (2007) 43:1348–60. doi: 10.1016 / j.ejca.2007.03.021
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
20. Gy, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, et al. ASCO 2006 oppdatering av anbefalinger for bruk av tumormarkører i gastrointestinal kreft. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
21. Duffy Mj, Lamerz R, Haglund C, Nicolini A, Kalousová M, Holubec L, Et al. Tumormarkører i kolorektal kreft, magekreft og gastrointestinal stromal kreft: European group on tumor markers 2014 retningslinjer oppdatering. Int J Kreft. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. Preoperativt karsinoembryonisk antigen forutsier utfall hos node-negative kolonkreftpasienter: en multivariat analyse av 572 pasienter. J Am Coll Surg. (1997) 185: 55-9. doi: 10.1016 / S1072-7515(97)00012-4
PubMed Abstrakt / Fulltekst / Google Scholar
23. Hei JW, OH BR, Kim HR, Kim YJ. Preoperativt karsinoembryonisk antigennivå som en uavhengig prognostisk faktor ved potensielt kurativ tykktarmskreft. J Surg Oncol. (2010) 101:396–400. doi: 10.1002 / jso.21495
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
24. G, G, G, g, g, G, g, G, g, g, Et al. Inkorporering av serumkarsinoembryoniske antigennivåer i prognostisk grupperingssystem for tykktarmskreft. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007 / s00384-017-2772-1
PubMed Abstrakt / Fulltekst / Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, et al. C-stadium i kolonkreft: implikasjoner av carcinoembryonic antigen biomarker i staging, prognose og ledelse. J Natl Kreft Inst. (2011) 103:689–97. doi: 10.1093 | jnci / djr078
PubMed Abstrakt / Kryssref Full Tekst / Google Scholar
26. Margalit O, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern N, et al. Vurdering av prognostisk verdi av karsinoembryoniske antigennivåer i stadium i og II tykktarmskreft. Eur J Kreft. (2018) 94:1–5. doi: 10.1016 / j.ejca.2018.01.112
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
27. Tarantino I, Warschkow R, Worni M, Merati-Kashani K, Kö D, Schmied BM, et al. Forhøyet preoperativ CEA er assosiert med dårligere overlevelse hos pasienter med endetarmskreft I stadium I-III. Br J Kreft. (2012) 107:266. doi: 10.1038 / bjc.2012.267
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
28. Norton L, Massague J. er kreft en sykdom med selvsåing? Nat Med. (2006) 12:875–8. doi: 10.1038 / nm0806-875
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
29. Yu KD, Jiang YZ, Chen S, Cao ZG, Wu J, Shen ZZ, et al. Effekt av stor tumorstørrelse på kreftspesifikk dødelighet i node-negativ brystkreft. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / j.mayocp.2012.07.023
PubMed Abstrakt | CrossRef Fulltekst | Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Stage i rektal kreft: identifisering av høyrisikopasienter. J Am Coll Surg. (1998) 186:574-9; diskusjon: 579-80. doi: 10.1016 / S1072-7515(98)00018-0
PubMed Abstrakt / Fulltekst / Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O ‘ Connell MJ, Begovic M, et al. Effekt Av T-og N-stadium og behandling på overlevelse og tilbakefall ved adjuvant endetarmskreft: en samlet analyse. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
PubMed Abstrakt | CrossRef Fulltekst / Google Scholar