Hva er colony PCR?
Colony PCR Er en rask PCR-METODE med HØY gjennomstrømning for å bestemme tilstedeværelsen eller fraværet av det innsatte DNA i plasmid direkte fra bakteriekoloniene.
Molekylær kloning er en AV DE mest populære metodene for DNA-transformasjon siden lenge. For å bestemme TILSTEDEVÆRELSEN ELLER fraværet AV DNA-innsatsen må vi imidlertid utføre transformasjonseksperimenter.
Colony PCR er en ny metode der ved å designe de innsatte DNA-spesifikke primerne, kan vi identifisere om VÅRT DNA av interesse er satt inn i plasmidet eller ikke.
det er imidlertid ikke så enkelt som vi diskuterer.
i denne artikkelen vil vi fokusere på Kolonien PCR spesielt, Prinsippet Om Kolonien PCR, dens fordeler og begrensninger.
For det må vi forstå flere begreper og emner. Vi starter vårt emne fra det grunnleggende. Innholdet i artikkelen er,
Viktige Emner:
“et plasmid er det bakterielle sirkulære DNA som replikerer uavhengig av bakteriekromosomet og brukes i genmanipulering og genoverføring.”
Genetisk kloning Er et tradisjonelt molekylærgenetisk verktøy brukt siden lenge i laboratoriene. Kort sagt, i genkloningen, er genet av vår interesse satt inn i plasmidet gjennom kunstige midler. DETTE DNA replikeres uavhengig av bakteriekromosomet.
Plasmider er faktisk brukt til å generere mange kopier av korte segmenter AV DNA. Fordi bakterier replikerer raskere enn noen andre organismer, kan vi generere mange kopier av genet av interesse ved å sette det inn i bakterieplasmidet.
F-plasmid, Col-plasmid, nedbrytende plasmid og resistens plasmid er flere vanlige typer plasmider som finnes i bakterier.
videre kan plasmidet fungere som en molekylær bærer som overfører korte DNA-segmenter fra en celle til en annen celle.
Vi har dekket en fantastisk grundig artikkel om plasmid DNA. Les det her: Plasmid DNA-Struktur, Funksjon, Isolasjon Og Applikasjoner.
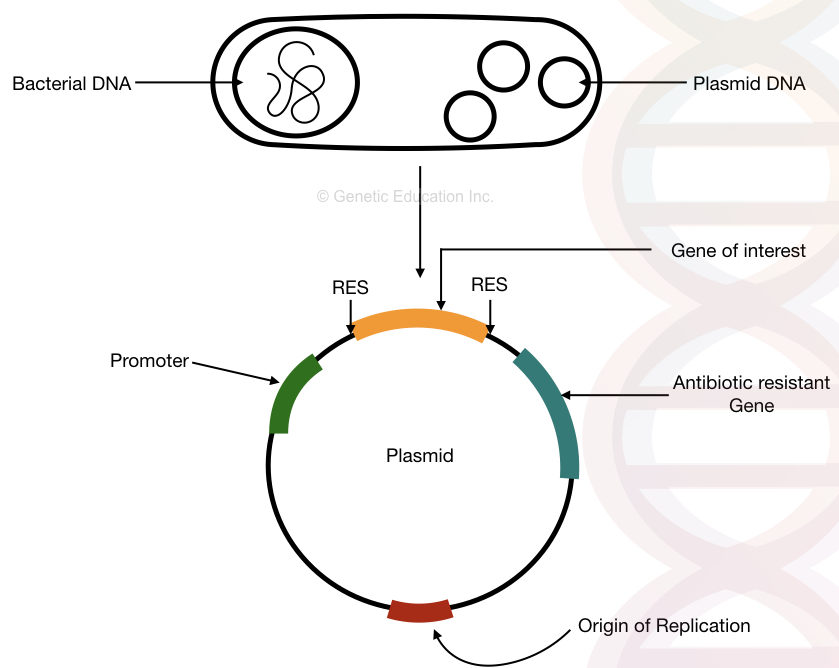
strukturen av bakteriell plasmid DNA MED, opprinnelsen til replikasjon, antibiotikaresistens gen, promoter og gen av interesse.
bortsett fra bakterier inneholder flere andre prokaryoter også plasmid-DNA. Plasmidets hovedfunksjon i bakterier er for overlevelse i de tøffe forholdene.
som plasmid overfører genet av vår interesse, er det svært viktig å avgjøre om vårt gen av interesse er satt inn eller ikke i plasmidet.
for det kan vi bruke FLERE metoder som PCR og mikrobiell dyrking.
Platting koloniene tar mer tid og følsomheten til metoden er heller ikke bra også. Sjansen for forurensning er alltid høy i bakteriekulturmetoder.
så resultatene er ikke nøyaktige.
VÅR PCR hjelper også her. Ved hjelp av colony PCR-metoden kan EN DNA-innsats bestemmes eller identifiseres.
- hvordan sette OPP ET DNA extraction lab: en omfattende guide(kjemikalier, instrumenter og andre verktøy).
- Kromosom 6p sletting: en grunn til ingen smerte, ingen sult og ingen søvn
Hva Er Colony PCR?
Colony PCR er modifikasjonen av den konvensjonelle PCR der bakteriekoloniene brukes direkte som EN PCR-mal.
plasmid-DNA som inneholder DNA av vår interesse, forsterkes i de sykliske temperaturavhengige forholdene.
den grafiske representasjon av kolonien PCR er vist i figuren nedenfor,
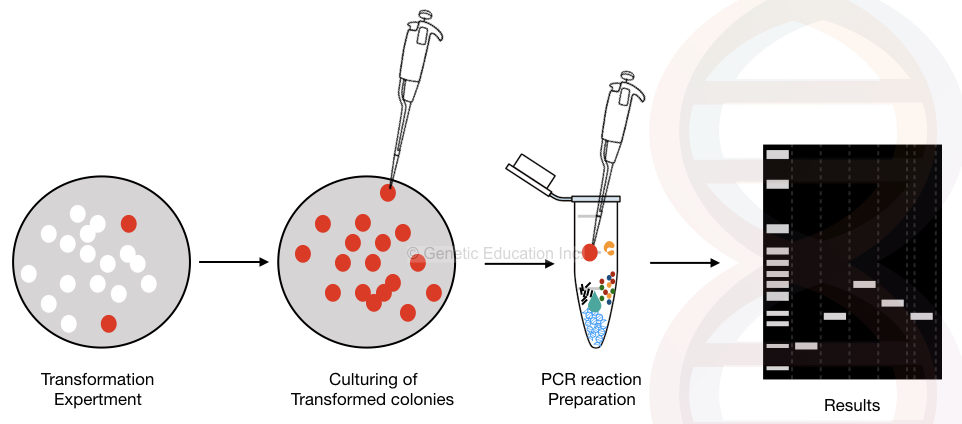
den generelle oversikten over colony PCR-metoden.
Prinsipp For Koloni PCR:
bakteriekolonien som inneholder plasmidet kan forsterkes direkte ved hjelp av to sett med primere. Sett inn spesifikke primere som forsterker innsettingssekvensen og vektorspesifikke flankeprimere, som forsterker plasmid-DNA annet enn det innsatte DNA (flankeregioner på begge sider av innsatsen).
ved å bruke innsatsen flankerende primere (som forsterker resten AV DNA) størrelsen PÅ VÅR DNA-innsats kan bestemmes.
en bakteriekoloni plukkes og tilsettes direkte i mastermixen som inneholder ALLE PCR-reagensene. I TILLEGG, ved å legge til et innledende oppvarmingstrinn TIL PCR, kommer plasmid-DNA ut fra bakteriecellen og forsterkes i reaksjonen.
dette er det grunnleggende prinsippet i colony PCR, men det kan endres avhengig av kravene.
protokollen av colony PCR:
colony PCR er en av de utmerkede modifikasjonene av den konvensjonelle PCR. I stedet for mal-DNA blir bakteriekoloniene direkte tilsatt reaksjonen. I TILLEGG til Dette blir Taq DNA-polymerase, primere, PCR-reaksjonsbuffer og DD/W tilsatt I PCR-reaksjonen også.
HER I kolonien PCR er valget av primere svært viktig. Også valget av primere avhenger av målet med eksperimentet vårt.
Hvilken type informasjon ønsker VI fra vårt colony PCR-eksperiment?
-
-
- Informasjon om tilstedeværelse eller fravær av innsatsen bare.
- Informasjon om størrelsen på innsatsen.
- Informasjon om retningen på innsatsen.
-
Avhengig av at FORSKJELLIGE PCR primere er utformet for kolonien PCR.
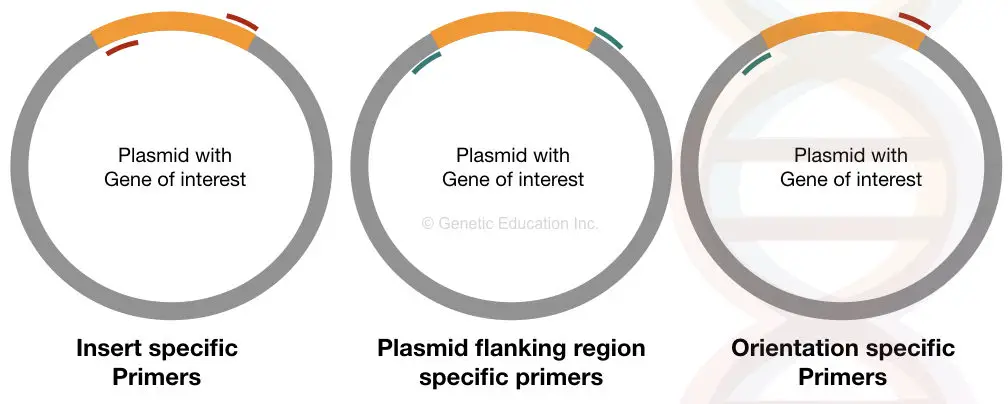
innsatsspesifikke primere binder seg til det spesifikke stedet på begge sider av det innsatte DNA av vår interesse. Hvis det overføres riktig inn i plasmidet, kan disse primerne binde seg til det ellers kan det ikke binde seg.
dette primersettet gir informasjon om tilstedeværelsen eller fraværet av innsatsen.
Orienteringsspesifikke primere er unike primere der en primer binder seg inne i innsatsen og en annen primer binder seg til plasmid-DNA-sekvensen(sekvens annet enn innsatsen DNA).
denne typen primersett gir informasjon om orienteringen av innsatt DNA av vår interesse. HVIS vår innsats DNA ikke er riktig ligert i vektoren, kan primeren spesifikk for den siden av sekvensen ikke binde, og vi vil ikke få forsterkningen.
Plasmid-spesifikke primere er også like viktige som orienteringsspesifikke primere. Dette settet av primere er utformet fra flankeområdet av innsatsen som binder seg til utsiden AV DNA av vår interesse.
dette settet med primer bidrar til å bestemme størrelsen på innsatsen. Det utvider regioner annet ENN innsatsen DNA.
PCR-reaksjonen for å utføre kolonien PCR er som følger,
| Komponent | Konsentrasjon | Antall |
| Master mix (Spesiell
For Kolonien PCR) |
1X | 12µ |
| PCR reaksjon buffer
med 2mM MgCl2* |
1X | 5µ |
| fremover primer | 10pM | 1µ |
| Omvendt primer | 10pM | 1µ |
| Supernatant | 3µ | |
| Vann | 3µ | |
| Totalt | ——— | 25µ |
prosedyren for koloni PCR:
vel, kolonien PCR trenger ikke ekstrahert DNA.
VI trekker ikke UT DNA her. I stedet brukes flere andre metoder for å øke reaksjonens følsomhet.
Ok, Hvorfor trekker vi IKKE UT DNA for plasmid-DNA?
fordi årsaken er enkel, er cellemembranen til bakteriecellen veldig jevn.
vi hadde allerede diskutert cellemembranen i bakteriecellen. Les det her: ULIKE TYPER DNA-ekstraksjonsmetoder
a bakterier inneholder myk cellemembran som lett kan lyses ved oppvarming eller sentrifugering i høy hastighet.
vi trenger heller Ikke bakteriens EGET DNA. Det sirkulerende sirkulære plasmidet er tilstede i bakteriens cytoplasma, derfor er det ikke nødvendig med ytterligere rensingstrinn. Ved å bryte cellemembranen er vårt mal-DNA klar for forsterkningen.
Ok, kan raskt gå gjennom metoden for å oppnå god plasmid DNA.
ved hjelp av den sterile plukkeren, velg flere bakteriekolonier og overfør den til eppendorf-røret.
legg NÅ TE buffer i det og bland det godt. Du kan også bruke D/W.
Varm prøven i kokende vannbad i 20 minutter.
forsiktig toppunktet det.
Sentrifuger prøven med høy hastighet i 2 minutter.
Overfør supernatanten til et annet rør og bruk det som et mal-DNA.
En 20µ prøve tilsettes i reaksjonen.
Tilleggsinformasjon:
hvorfor supernatant og ikke pellet?
DNA er et biomolekyl av livet. Plasmid-DNA er enda mindre enn det bakterielle nukleare DNA. Den inneholder bare flere gener på opptil 1000bp til 20.000 bp.
Derfor ved å bare sentrifugere det, kommer det lettere plasmid-DNA ut fra cellen og avgjøres i supernatanten mens pellet inneholder proteiner og nukleært DNA, slik at vi ikke bruker det.
nå kommer til poenget.
vår plasmid er klar for forsterkning.
I en annen metode,
bruk bakteriekolonien direkte.
denne metoden er en kombinasjon Av Hotstart PCR og colony PCR.
bakteriekoloniene plukkes og legges til PCR-reaksjonsrøret.
rørene plasseres i PCR-maskinen. Ett ekstra oppvarmingstrinn er lagt til.
ved å varme det 5 til 7 minutter kommer plasmid-DNA ut fra cellen.
nå forsterker de innsatsspesifikke primerne DNA-et vi har satt inn. Og de flankerende primerne forsterker RESTEN AV DNA-ET.
forsterkningen gjøres i 20 til 25 sykluser. Sykkelforholdene for colony PCR er oppført nedenfor,
| PCR-Trinn | Innledende Denaturering | Denaturering | Glødning | Forlengelse | Endelig forlengelse |
| Temperatur | 95 C | 95 C | 55-65 C | 72 C | 72 C |
| Tid | 3min | 10 sek | 45 sek | 50 sek | 5 min |
| ——- | ——- | 25 sykler | —– | ——- |
Les den interessante artikkelen om konvensjonell PCR: En Komplett Guide Til Polymerasekjedereaksjonen
tips For forbedring:
Bruk bare noen få kolonier, da mange kolonier øker sjansen for de ikke-spesifikke bindingene.
Bruk positiv kontroll og negativ kontol.
som en positiv kontroll brukes flankeprimeren selv om innsatsen ikke er tilstede, GIR PCR-reaksjonen DNA-bånd av plasmid-DNA som indikerer at reaksjonen vi forberedte er riktig.
som en negativ kontroll, bruk det transformerte plasmidet (plasmid uten innsats DNA), dette plasmid DNA forsterkes bare hvis innsatsen er tilstede.
som en innsats bruker korte DNA-sekvenser, lengre DNA-sekvenser øker sjansen for ikke-spesifikke bindinger og PCR-reaksjonssvikt.
bruk også kortere PCR-programmer.
den viktigste anvendelsen av koloni PCR er i identifisering av korrekt ligering og innsetting av sette DNA inn i bakterier samt gjær plasmid.
ETTER fullføring av colony PCR-reaksjonen kjøres PCR-produktene på 2% agarosegel. Resultatene av forsøket er vist i figuren under,
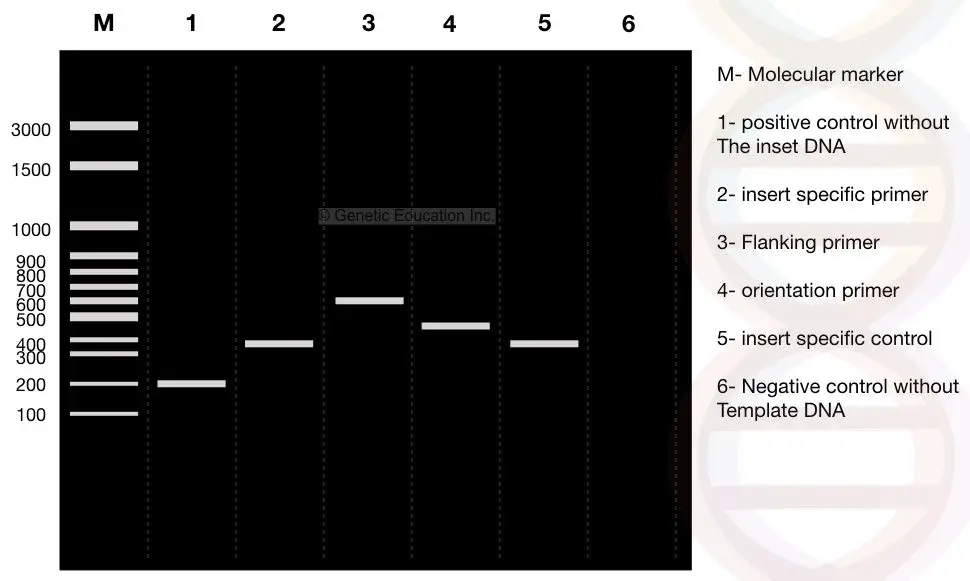
følg nå nøye resultatene, M er 3000bp molekylær DNA-markør. Anta AT DNA av vår interesse,” sett inn ” er et 400bp-fragment som settes inn i plasmidet.
Se lane 2: 400 bp-fragmentet av vår innsats.
vi designet flankerende primere 100bp vekk fra begge sider av innsatsen. Hvis flankeprimeren forsterker DNA sammen med innsatsen, er produktet 600 bp, se lane 3 (400 bp av innsats DNA + 200 bp flankeområde).
nå, se lane 1, det er en positiv kontroll uten innsatsen eller et normalt plasmid uten det transformerte DNA. Derfor forsterker flankerende primere bare 200 bp DNA.
Se lane 1, 200bp fragment AV DNA uten innsats(positiv kontroll).
nå, observere lane 4. Lane 4 er resultatene av orienteringsspesifikke primere. Orienteringsspesifikk primer er en kombinasjon av innsatsspesifikk primer og flankerende regionspesifikk primer.
En primer fra insert DNA og en primer fra den flankerende regionspesifikke primeren velges for orienteringsspesifikk primerforsterkning.
derfor forsterkes 100 bp fragment fra flankeområdet primer og 400bp FRA innsatsen DNA og 500 bp fragment AV DNA observeres i lane 4.
Lane 5 er den innsatsspesifikke kontrollen som gir 400 bp DNA-fragmentet.
Lane 6 er den negative kontrollen uten malen. Ved å bruke negativ kontroll kan forurensning identifiseres. Reaksjonsrøret inneholder alle ingrediensene unntatt malen. Så ideelt SETT ER DET ingen DNA-bånd i denne banen.
hvis ET DNA-bånd blir observert, er prøven forurenset.
Fordeler med colony PCR:
- teknikken er rask og kostnadseffektiv.
- videre er nøyaktigheten og spesifisiteten til teknikken høyere.
- oppsettet er enkelt akkurat som den konvensjonelle PCR, DNA-ekstraksjon og plasmid rensing som arbeidskrevende trinn er ikke nødvendig.
- ingen behov for begrensning fordøyelse for identifisering AV innsatsen DNA.
- hele eksperimentet kan fullføres innen 90 minutter.
Ulemper ved colony PCR:
- metoden er kostnadseffektiv, rask og pålitelig, men enhver mutasjon i innsatsen kan ikke oppdages.
- videre kan sekvensinformasjonen ikke oppnås av kolonien PCR. vi må gjøre sekvensering for bekreftelse AV DNA-transformasjonen.
- sjansen for falske positive resultater er høy.
Les mer;
- Hva er en multiplex PCR?
etter at forsøket er fullført, sendes prøven til sekvenseringen der DNA-sekvensen av vår interesse kan bestemmes.
vi kan til og med gjøre multiplex PCR ved å kombinere både sett inn spesifikke primere og plasmid-spesifikke primere.
Konklusjon:
selv om colony PCR er det beste valget for identifisering av genoverføring, er den eneste colony PCR-teknikken ikke tilstrekkelig til å tolke resultatene. Det kan mulig at noen av mutasjonene tilstede i innsatsen, som ikke kan oppdages AV PCR.
FOR å bekrefte resultatene KREVES DNA-sekvensering. Etter å ha bestemt sekvensrekkefølgen kan vi si om vårt gen av interesse er satt inn riktig eller ikke.