Kognat antigen-inngrep på parenkymceller stimulerer CD8 + T-celleproliferasjon in situ
- Kognat CD8+ T-celler finnes i ln og betent vev
- CD8 + t-celler ekspanderer på inflammasjonsstedet
- Kognat interaksjon med holmer fremmer ekspansjon
- Kognat interaksjon med residente leukocytter er ikke nødvendig
- Kognat interaksjon med parenkymceller er viktig
- T-celler sprer seg på stedet for betennelse
- Kognat interaksjon med parenkymceller driver spredning
- IL-2 er viktigere på inflammasjonsstedet
Kognat CD8+ T-celler finnes i ln og betent vev
i første forsøk (Fig. 1) vi etablerte en modell DER CD8 T-cellerespons på et parenkymalt antigen, ovalbumin (OVA), kunne analyseres. Ot-i-mus uttrykker en transgen TCR som medierer CD8 + T-cellegjenkjenning AV OVA257 – 264 peptid presentert På MHC klasse I-molekylet H-2kb. CD8 t-celler ble beriket FRA ot-I/CD45.1 mus, CFSE fargestoff-merket og adoptert overført av i. v. Til b6 (CD45.2+) vertsmus. Adoptivt overførte T-celler kunne skilles fra vertsceller VED CD45. 1-farging (SÅ VEL SOM CD8 og Va2-kjeden AV OT-I TCR) mens CFSE-fargestofffortynning ble brukt til å identifisere celler som hadde proliferert(For Eksempel Fig. 1a, Supplerende Fig. 1). Parenkymalt antigen ble introdusert Ved podning B6.ß holmer (slike holmer uttrykker ROGN i parenkymale β-celler under rotteinsulinpromotoren, Supplerende Tabell 1) under nyrekapselen til vertsmus som allerede hadde fått ot-i/CD45.1 t-celler. Alle tre kilder (vert, t-celle donor og holme donor) har En B6 bakgrunn og dermed uttrykke H-2kb. Selv OM EKSPRESJON AV ova-antigen var begrenset til podede hryvnias celler, antok vi derfor at presentasjon av β-cellederivert OVA ved ikke-parenkymal APC som DC via krysspresentasjon ville være nødvendig FOR ln-priming og kanskje lokale t-cellerespons17,18.

Delt OT-i celler (levedyktig CD45.1+CD8+Va2+ gate) i drenering nyre LN og pode 3 eller 6 dager etter mottak av en enkelt pode på 400 B6.ß holmer. (A) Representative flyt cytometri tomter. Posisjonen til den udelte OT – i-toppen ble bestemt ved bruk av’ no antigen ‘ – kontroll av et b6-øyetransplantat. (B) Totalt antall delt OT-I i renal ln og graft hvor hvert punkt representerer en individuell mus. Samlet data fra syv uavhengige eksperimenter: n = 8 transplantatmottakere på dag 3 og n=14 transplantatmottakere på dag 6. En dag 6 graft gikk tapt på grunn av en flowcytometer feil. Horisontale barer er midler, p-verdier ble beregnet ved uparget, to-tailed t-test med Welchs korreksjon.
CD8 + t-celler ekspanderer på inflammasjonsstedet
som forventet ble det først påvist en potent ot-I-respons i renal LN som drenerer transplantasjonsstedet, og dette var avhengig av TILSTEDEVÆRELSEN AV OVA-antigen (Fig. 1a, b). På 3 dager etter graft kunne delt OT – i detekteres i LNs drenering Av B6.ß holme grafts (Fig. 1a) og var rikelig (Fig. 1b, gjennomsnittlig=9.2 × 104). Derimot kunne 100 ganger færre delte OT-i-celler detekteres innenfor B6.ß grafts (Fig. 1a, b, mener = 6.6 × 102). Antallet delte ot-i-celler økte 300 ganger på graftstedet fra dag 3 til dag 6(Fig. 1b, gjennomsnitt=6.6 × 102 på dag 3 til 2.1 × 105 på dag 6, P< 0.0001, uparret to-tailed t-test med Welchs korreksjon) mens DET ikke var noen økning I LN (Fig . 1b). OT-i-svaret I B6.ß transplantater kan forklares ved infiltrasjon AV OT-i-celler som hadde proliferated I LN. MEN CFSE profiler var forskjellig mellom pode og LN områder SOM OT-i celler i grafts var mer høyt delt enn DE I LN på dag 6 (Fig . 1a). Det er minst to mulige forklaringer på denne forskjellen. Bare celler som hadde delt mange ganger infiltrert graftet. Alternativt kan cellene nå pode raskere delt, muligens på grunn av overflod av tilgjengelig antigen. Økningen i absolutte celle tall i graft sammenlignet MED LN på dag 6 førte oss til å undersøke denne sistnevnte forklaringen.
Kognat interaksjon med holmer fremmer ekspansjon
for å bestemme mulig BIDRAG av kognat MHC i pode til lokal ekspansjon vi brukte holmer avledet fra bm1.ß mus (Supplerende Tabell 1). I bm1.ß mus, h-2kbm1 molekylet er ikke i stand til å presentere OVA257 – 264 peptid på grunn av tre mutasjoner Til H-2kb (ref. 19). En sammenligning av svar På B6.ß og bm1.ß holm grafts viste at til tross for lignende ot-I svar i drenering renal LN, utvidelse AV OT – I ble redusert seks ganger i bm1.ß sammenlignet Med B6.ß grafts (gjennomsnitt=4.7 × 104 sammenlignet med 2.6 × 105 delt OT – I; P=0.0153 uparret to-tailed t-test med Welchs korreksjon; Fig. 2a). Denne mindre effektive utvidelsen av ot-i-celler infiltrerer bm1.ß transplantater antydet at beslektede interaksjoner med podede øyeceller bidro til lokal t-celleutvidelse.

Flowcytometri analyse AV ot-i celler (levedyktig CD45.1+CD8+Va2+ gate) 6 dager etter graft. (A) Total delt OT-I i drenering nyre ln og pode etter mottak av en enkelt pode på 400 B6.ß eller bm1.ß holmer. Data for B6.ß podede mus er en delmengde av det som er vist I Fig. 1b. Hvert punkt representerer en individuell mus. Samlede data fra to uavhengige eksperimenter vises i hvert panel: n = 5 mottakere Av B6.ß transplantater, og n = 6 mottakere av bm1.ß grafts. Horisontale barer er midler, p-verdier ble beregnet ved uparget, to-tailed t-test med Welchs korreksjon. (b) Skjematisk av bipolar pode modell der grafts av 200 holmer er plassert på motsatte poler av samme nyre og dele en felles drenering renal LN. Totalt delt OT-I i (c) B6.ß og KbKO.ß bipolare transplantater og (d) B6.ß og b6 bipolare transplantater (n=5 mottakermus samlet fra to uavhengige eksperimenter i hver av c og d) Data for samme mus er forbundet med stiplede linjer: p-verdier ble beregnet ved forholdet parret t-test.
for å eliminere ethvert bidrag Fra H-2kbm1 alloantigen genererte Vi KbKO.ß mus som uttrykker OVA-antigen i betaceller, men mangler alloantigen Eller H-2kb (Supplerende Tabell 1). Vi brukte deretter en bipolar graftmodell for å sammenligne svar På B6.ß og KbKO.ß øyetransplantater plassert på motsatte poler av samme nyre i En b6 vertsmus, slik at graftinfiltrerende T-celler ble avledet fra T-celler primet i samme LN (Fig. 2b). Det var 10-100 ganger Flere T-celler tilstede I B6.ß Enn KbKO.ß grafts (Fig. 2c). Ved å bruke forholdet mellom delt OT – I ved motsatte poler av nyrene beregnet for individuelle mus, avledet Vi Et Relativ Responsforhold (Rrr). RRR indikerte at lokal t-celleutvidelse var 26 ganger større når beslektet inngrep med transplantatceller forekom (RRR=26,4±14,1 i B6.ß: KbKO.ß transplantater, P=0,0025, forholdet parret t-test, Fig. 2c).
vi sammenlignet også svarene på bipolar B6.ß og b6 (ingen antigen) transplantater (Fig. 2d). Svært få OT – i kunne oppdages innenfor B6 grafts(Fig. 2d) og vi anser det sannsynlig at mange av disse var sirkulerende OT-I avledet fra blodforurensning. Dermed fører ikke-spesifikk betennelse forbundet med transplantasjon av transplantater som mangler antigen ikke til effektiv t-celleutvidelse i det betente vevet. I motsetning til svaret På B6.ß grafts var igjen veldig potente og mer enn 900 ganger større enn For B6 grafts (RRR=950±252 For B6.ß: b6 grafts, P< 0.0001, forholdet parret t-test, Fig. 2d).
Sammen indikerte disse forsøkene AT CD8 T-celleutvidelse i det betente målvevet ble signifikant fremmet ved lokal antigenpresentasjon. Dette utelukker ikke nødvendigvis andre bidrag Til t-celleutvidelse, for eksempel ved krysspresenterende verts-DC i transplantatet. Vi bare aver som beslektet interaksjon Mellom T-celler og holme celler resulterer i betydelig t-celle ekspansjon.
Kognat interaksjon med residente leukocytter er ikke nødvendig
Holmer er komplekse klynger av celler som inkluderer β celler, endotelceller og holme residente leukocytter (IRL). Derfor søkte vi neste å avklare hvilke øyeceller som presenterte antigen for å infiltrere T-celler for å drive t-celleutvidelse. DEN mest åpenbare kandidaten VILLE VÆRE IRL. DISSE CD45 + – cellene har forskjellig blitt definert SOM DC eller makrofager, co-express CD11c Og F4/80, og har vist seg å behandle og presentere antigener20,21,22,23. Vi undersøkte derfor rollen som donor IRL i å drive lokal CD8 T – celleutvidelse. B6.ß mus ble krysset Til CD11c. DTR.GFP mus for Å oppnå CD11c. DTR.GFP.ß mus som har β celler som uttrykker EGG og Som Har CD11c+ celler som kan ableres av difteritoksin (DT) injeksjon8. Vi først testet AV FACS at holmer isolert Fra CD11c. DTR.GFP-mus behandlet MED DT var utarmet Av CD11c + – celler (Fig. 3a, b). CD11c + IRL i ubehandlede kontrollmus ble identifisert ved farging FOR CD45 Og CD11c, så vel som deres uttrykk FOR GFP-reporteren og ble tydelig utarmet ved DT-behandling (Fig. 3a, b,P = 0,0002, uparget to-tailed t-test med Welchs korreksjon). Vi har også bekreftet At CD11c + IRL co-uttrykt F4 / 80 OG H-2 Kb MHC KLASSE I (Supplerende Fig. 2a) og Følgelig Ble f4/80+ – celler også utarmet fra holmer av dt-behandlede mus (Supplerende Fig. 2b). CD11c. DTR.GFP.ß øyer isolert fra ubehandlede og dt-behandlede mus ble podet ved motsatte poler av samme nyre. Delt OT – i-nummer var lik mellom graftene, noe som indikerer AT IRL-uttømming ikke hadde noen effekt PÅ CD8 + T-celleutvidelse på graftstedet (Fig. 3c). FOR å bekrefte AT IRL ikke var viktig for lokal CD8 T – celleutvidelse, utførte vi et annet sett med eksperimenter. KbKO.ß mus ble bestrålt og rekonstituert med Enten kbko eller b6 benmarg (BM)for å generere en kilde til ß øyer hvor H-2Kb-ekspresjon var fraværende fra alle celler eller selektivt gjenopprettet TIL IRL (Fig . 3d). Sammenligning av slike holmer i bipolar pode modellen viste lignende nivåer AV ot-i celleutvidelse i begge grafts(Fig. 3e). DERFOR ER IRL ikke store drivere for lokal CD8 T – celleutvidelse.

Flowcytometri analyse som viser uttømming Av CD11c + IRL I CD11c. DTR.GFP-mus behandlet MED DT: (A) Representative plott som viser gating Av CD11c + IRL i holmer fra ubehandlede kontrollmus og deres uttømming dagen etter en enkelt DT-behandling, og (b) opptelling Av CD11c+IRL i ubehandlede og DT-behandlede mus. Hvert punkt representerer et individuelt holm-preparat som inneholder samlede holmer fra 1 til 8 mus, n=5 ubehandlede holm-preparater og 6 dt-behandlede holm-preparater samlet fra fire uavhengige eksperimenter. P-verdi beregnet ved uparret, to-tailed t-test med Welchs korreksjon. (c) Totalt delt OT-I på 6 dager etter bipolar pode av holmer hentet Fra CD11c. DTR.GFP.ß mus som ble ubehandlet eller behandlet MED DT (n=6 mottakermus samlet fra to uavhengige eksperimenter). Data for samme mus er forbundet med stiplede linjer; p verdier beregnet ved forholdet paret t-test. (D) Representative plott som viser fravær Eller tilstedeværelse Av H-2kb-uttrykk På CD11c + IRL Av KbKO-mus rekonstituert med Henholdsvis kbko eller b6 BM. Pregated på levedyktige celler. (e) total delt OT-I på 6 dager etter bipolar pode av holmer hentet fra kimær mus (n=3 mottakermus fra et enkelt eksperiment). Data for samme mus er forbundet med stiplede linjer; P verdier beregnet av forholdet paret t-test.
Kognat interaksjon med parenkymceller er viktig
B6.RIP-Kb-mus uttrykker transgenisk H-2kb i β celler under kontroll av rotteinsulin promoter24. Ved å krysse disse musene Til KbKO.ß mus vi genererte KbKO.ß.ß mus der H-2kb-uttrykk var begrenset til β celler (Supplerende Tabell 1). Ekspresjon Av H-2kb på β celler ble bekreftet VED FACS analyse av holmer (Fig. 4a). Vi gated på holme hematopoetiske celler (CD45+) og endotelceller (CD31+) og viste At H-2Kb ikke ble uttrykt på disse cellene i Enten KbKO.ß eller KbKO.ß.ß mus sammenlignet med sterkt uttrykk i b6 mus (Fig. 4a). DE resterende CD45-CD31-cellene er autofluorescerende positive og beriket i endokrine celler. FACS analyse av holmer Fra KbKO.ß.ß – celleberikte autofluorescerende mus viste H-2Kb-uttrykk innenfor den β-celleberikte autofluorescerende populasjonen på nivåer som ligner det som er sett I b6-øyer (Fig. 4a). Sammenligning i den bipolare transplantatmodellen indikerte at utvidelse AV OT-I var 14 ganger større når kognat antigen ble uttrykt på β celler (RRR=14,0±4,1 For KbKO.ß.ß: KbKO.ß transplantater, P=0,0008, forholdet parret t-test, Fig. 4b).

(A) Flowcytometri plott (gated på levedyktige celler) viser selektiv restaurering Av H-2Kb uttrykk på parenkymceller. Histogrammer representerer øyer Fra KbKO (skyggelagt), B6 (stiplet) eller KbKO.ß (fet) mus. (B) Totalt delt OT-I på 6 dager etter bipolar pode Av KbKO.ß og KbKO. ß.ß holmer (n = 6 mottakermus samlet fra tre uavhengige eksperimenter). Data for samme mus er forbundet med stiplede linjer; p verdier beregnet ved forholdet paret t-test.
T-celler sprer seg på stedet for betennelse
våre ovennevnte funn indikerer at det var lokal spredning på målstedet. For å oppdage aktivt prolifererende celler krysset VI ot-I /CD45.1-mus til FucciRG-mus for å generere FucciRG/OT-I/CD45.1 mus(forkortet FucciOT-I). I slike mus fluorescerer celler rødt (FucciR) Under G0/G1 og grønt (FucciG) under s/G2/M cellesyklusfaser25, 26. Gradvis nedbrytning og akkumulering Av FucciR-og FucciG-reportere under overgang mellom syklusfaser gjør det mulig å skille ytterligere: mer intens FucciR-uttrykk i hvilende G0 versus syklusg1−celler, dobbelt negative FucciR− G-celler i svært tidlig G1 og svakt doble positive FucciR+G+ – celler I G1/S (refs 26, 27). Hvilende FucciOT-i celler fra ungodde mus Var FucciG – (Fig. 5a, øvre panel, podet). For å unngå interferens Med Fucci fargestoffer vi erstattet CFSE MED CTV. I mus som hadde fått B6.ß transplantater, analyse AV ctv-fortynning indikerte at delt FucciOT-I var tilstede i drenerende renal LN, og noen av disse var FucciG+ som tyder på aktiv celledeling (Fig. 5a, øvre panel, drenering LN). På graftstedet oppdaget Vi FucciOT-I som hadde gjennomgått mange divisjoner (CTV ikke lenger detekterbar), og mange av disse var FucciG+ støttende for pågående spredning(Fig. 5a, øvre panel, fersk pode). Sammenligning av andelen FucciG + celler innenfor den delte ot-i-populasjonen (Fig. 5c) indikerte at pågående spredning innen ferske transplantater (26,8±8,8% FucciG+) oversteg det i enten den drenerende renale LN (7,3±1,6%, P=0,008, uparret to-tailed t-test med Welchs korreksjon) eller ikke-drenerende renal LN (2,1±2,1%, P=0,003, uparret to-tailed t-test med Welchs korreksjon). Faktisk viste undersøkelse av Både FucciG og FucciR-uttrykk at de fleste graftinfiltrerende OT-I aktivt delte seg, det vil si at svært få celler viste høyt uttrykk For FucciR som var karakteristisk for hvilende celler I LN av ungoderte mus(Fig . 5a, nedre paneler). Selv om vi antok at denne spredning på stedet for betennelse ble generert in situ, kunne vi ikke helt rabatt muligheten for at dette bare reflekterte nylig ankomst av prolifererende celler. For å klargjøre dette, høstet vi de bipolare graftene Av B6.ß holmer for å analysere en graft umiddelbart etter excision, og kultur den andre graft i 1 dag (Fig. 5a). Mens antall OT – i ikke økte over kulturperioden(Fig. 5b), som antagelig reflekterer celledød under suboptimale ex-vivo-forhold, fortsatte Mange FucciG + OT-i-celler å bli detektert (14,2±4,2% FucciG+, Fig. 5c). Profilen til det dyrkede graftet, uten mulig rekruttering for en dag, ville tyde på at det var høy de novo-spredning i graftet.

(A) Skjematiske og representative flowcytometri-plott (gated på levedyktige CD45. 1 + CD8 + Va2 + lymfocytter) som viser Respons Fra FucciOT-i-celler i renal LNs eller bipolar B6.ß grafts. LNs og pode fra en pol ble undersøkt umiddelbart (fersk på 6 dager etter pode) mens pode fra motsatt pol ble dyrket for 1 dag før analyse. LN fra en ungrafted mus ble inkludert for å vise fravær av divisjon og FucciG uttrykk (øvre panel) og overvekt Av FucciR høye celler (nedre panel) i hvilende FucciOT-I. (B) Totalt delt FucciOT-I i friske og kultiverte transplantater. Gjennomsnitt + s. d., n=5, p verdier beregnet av to-tailed forholdet paret t-test. (c) % FucciG + delt OT – I i frisk ikke-drenering og pode drenering nyre ln samt friske og kultiverte grafts. Mean + s. d., n=5 med unntak AV ikke-drenering LN som n = 4 på grunn av tap av EN LN under behandlingen. P-verdier ble beregnet ved to-tailed uparret t-test med Welchs korreksjon. Data er samlet fra to uavhengige eksperimenter.
Kognat interaksjon med parenkymceller driver spredning
vi tok neste fordel av FucciOT-i-modellen for å vurdere rollen til en annen potensiell lokal driver Av t-celleproliferasjon i graft, vert-avledet APC som inflammatorisk DC. For å eliminere ethvert bidrag fra verten APC vi først avledet En KbKO bakgrunn. Som KbKO-mus avviste OT-i-celler, skapte Vi KbKO BM til B6-kimærer for å bruke som verter; dermed manglet hematopoietiske celler H-2Kb, men var permissive FOR OT-i-celler. Disse kimærene ble gitt FucciOT-I t-celler og bipolare transplantater Av KbKO.ß holmer (mangler H-2Kb uttrykk og dermed evnen til å presentere OVA antigen) og KbKO.ß.ß holmer (Både H-2kb og OVA antigen var begrenset til β celler). Da kimæraen manglet h-2kb positiv APC, var det nødvendig å administrere OVA257 – 264 peptidbelagte miltceller for å initiere OT – i-responsen. Suksessen til denne priming ble vist VED CTV-fortynning I FucciOT – i-celler i renal LN, selv om disse på tidspunktet for høsting var FucciG – og ikke syntes å være aktivt delt (0,1±0,0% FucciG+, Fig. 6a, d). Svært få OT-jeg infiltrerte KbKO.ß grafts men ble tydelig utvidet Innen KbKO.ß.ß grafts (RRR av 61.4±26.6 Til KbKO.ß.ß: KbKO.ß, Fig. 6b, P = 0,0008, to-tailed forhold paret t-test). Selv i fravær av kognat antigen på host APC var derfor kognat antigen på parenkymale β-celler tilstrekkelig til å drive CD8 T-celleutvidelse på transplantasjonsstedet. De få FucciOT-I t-cellene som er tilstede I KbKO.ß grafts lignet DE I LN både når det gjelder deres ineffektive progresjon til den svært delte fraksjonen(Fig. 6a, c, 7.5±0.9% sterkt delt i LN og 19.3±3.3% sterkt delt i KbKO.ß grafts) og mangel På FucciG uttrykk (Fig. 6a, d, 0.1±0.0% i LN og 0.1±0.1% i KbKO.ß transplantater) som tyder på at liten ot-I-spredning oppstod på transplantasjonsstedet i fravær av kognat antigen. I motsetning TIL OT-i innen KbKO.ß.ß grafts var overveiende sterkt delt (92.3±1.0%, Fig. 6a, c) og noen av disse Var FucciG+ og dermed aktivt prolifererende (Fig. 6a, d, 5.0±1.2% FucciG+). Kognat antigen-presentasjon av parenkymceller fra holmer var derfor i stand til å drive de novo-proliferasjonen Av FucciOT-i in situ.

FucciOT-i respons til grafts I KbKO BM I b6 vert mus der verts hematopoetiske celler mangler H-2Kb uttrykk. Podede mus mottok peptidbelagte miltceller på dagen for podning for å initiere ot-I-priming. (A) Representative flowcytometri plott (gated på levedyktige CD45. 1 + CD8 + Va2 + lymfocytter). Øvre panel viser mangel på divisjon og FucciG uttrykk i hvilende OT-I i LN av en mus som ikke ble podet eller primet. Nedre tre paneler viser reponses i en bipolar podet og primet mus: drenering nyre LN, KbKO.ß og KbKO.ß.ß grafts. Delte celler i podede mus ble delt inn i to sektorer med de svært delte cellene som faller inn i sektoren DER CTV ble fortynnet utover deteksjonsgrensen. (B) Totalt delt FucciOT-I i KbKO.ß og KbKO.ß.ß bipolare transplantater, p-verdier beregnet ved to-tailed ratio parret t-test. (c) % svært delt og (d) % FucciG+ OT-I i drenering nyre LN og grafts av bipolar podet mus. P-verdier ble beregnet ved to-tailed parret t-test. Resultater for individuelle mus er forbundet med stiplede linjer, n = 6 mottakermus samlet fra to uavhengige eksperimenter.
IL-2 er viktigere på inflammasjonsstedet
VI viser AT IL-2RA-ekspresjon var viktigere for CD8 + t-celleproliferasjon og akkumulering innen perifer parenchyma (øyetransplantater) sammenlignet med i stedet for priming i drenerende LN (Fig . 7a). I tillegg analyserte vi responsen på et annet sted fjernt fra stedet for priming, det vil si ikke-drenerende LN. CTV-merkede CD8 + T-celler fra ot-I. IL-2RAKO (IL−2RA-CD45.2+) og OT-I/Ly5.1 (IL-2RA+, CD45.1+CD45.2+) mus ble samtidig overført til b6.CD45.1 vertsmus (CD45.1+) før du mottar en enkelt graft Av B6.ß holmer. De distinkte CD45 alleliske signaturene til hver av de overførte t-cellepopulasjonene (i kombinasjon med farging FOR CD8 Og Va2) gjorde det mulig for OSS å kvantifisere og sammenligne forholdet mellom delt WT:IL-2RAKO OT-I (Fig. 7a, Supplerende Fig. 3). IL-2RA WT klart utkonkurrert IL-2RA KO OT-i på pode stedet sammenlignet med enten drenering (P=0,025, to-tailed paret t-test) ELLER ikke-drenering (P=0,044, to-tailed paret t-test) LN. DETTE er i samsvar med økt avhengighet AV CD8+ T-celler PÅ IL-2 ved sekundært møte med antigen på inflammasjonsstedet sammenlignet med under initial priming i drenerende LN.
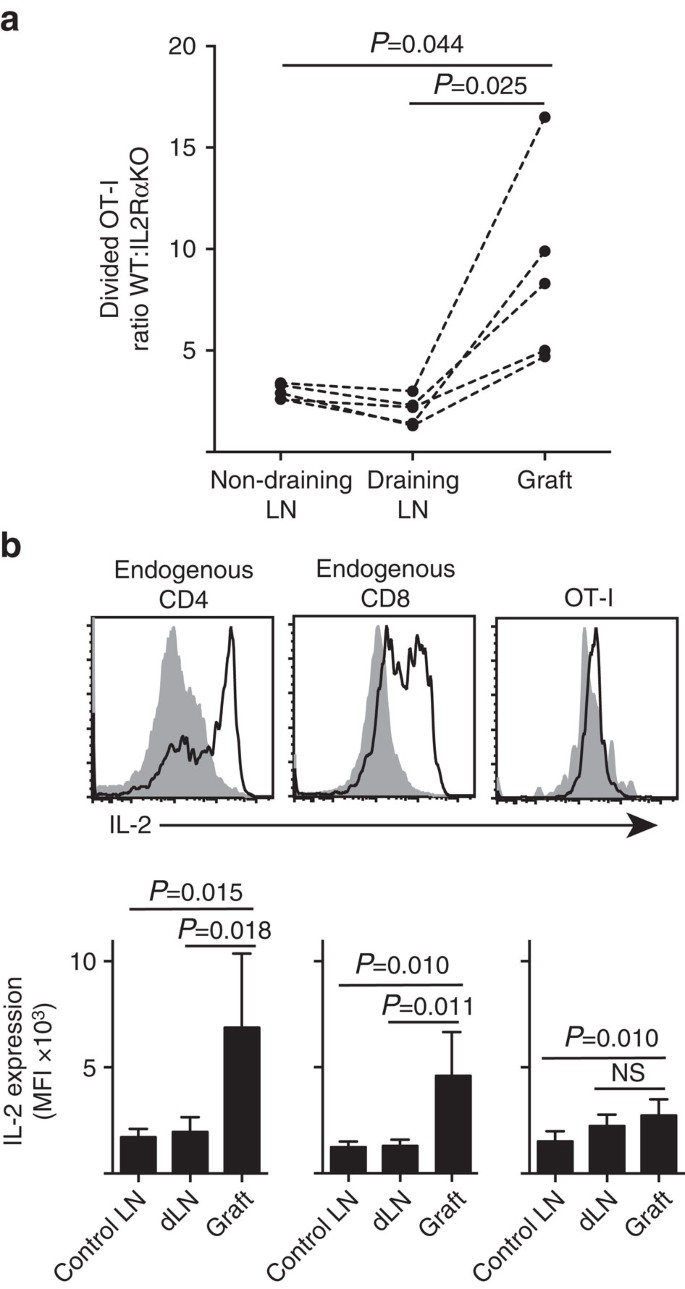
(A) Forholdet MELLOM delt IL-2RA WT: IL-2RA KO ot-i celler gjenvunnet Fra B6.ß øygraft, drenering av renal ln og ikke-drenerende inguinal LN etter samtidig overføring (106 av hver) Til b6.CD45.1 vertsmus. Ratioer ble beregnet for individuelle organer med resultater for individuelle mus forbundet med stiplede linjer og sammenlignet med to-tailed parret t-test. Resultater vist for n = 5 mottakermus og representant for tre uavhengige eksperimenter. (B) IL-2-uttrykk i endogene CD4+ – og CD8 + – celler og overførte OT-i-celler i b6-mottakere Av B6.ß holme grafts. Øvre paneler viser representative flowcytometri plott for pode drenering renal ln (solid grå) og pode (svart linje). Lavere paneler oppsummere gjennomsnittlig fluorescerende intensitet (mfi) AV IL-2 uttrykk for nyre LNs tatt fra ufruktbar (Kontroll LN), samt pode og drenering nyre LN (dLN) av podet mus. Resultater vist som gjennomsnitt+s. d., n = 6 samlet fra to uavhengige eksperimenter og sammenlignet med to-tailed uparret t-test Med Welchs korreksjon.
den økte avhengigheten AV IL – 2 for CD8+ t-celleproliferasjon på inflammasjonsstedet førte til et krav for lokal IL-2-produksjon. Derfor undersøkte vi potensialet til forskjellige T-celler (endogene vertsavledede CD4+ OG CD8+ samt overførte OT-I CD8+ T-celler) for kapasiteten til å produsere IL-2 (Fig. 7b). Cellesuspensjoner fremstilt fra transplantater eller LN ble kort (4 h) restimulert med PMA og ionomycin før farging for ekspresjon av intracellulær IL-2. Undersøkelse av ENDOGENE vertsavledede CD4+ – og CD8+ – t-celler ga overbevisende bevis på IL-2-produksjon på stedet for graftbetennelse med en klar økning I MFI AV IL-2-farging i forhold til enten drenering ELLER ikke-drenering AV LN. IL – 2 nivåer I OT-I CD8+ T-celler på stedet av betennelse ble moderat økt over de i ikke-drenering LN, men skilte seg ikke vesentlig fra de i drenering LN. En tolkning av disse dataene er at beslektet interaksjon MELLOM OT-I og parenkymceller induserer rask proliferasjon, men dårlig IL-2-produksjon, slik at OT-I er avhengig av parakrin IL-2 avledet fra endogene CD4+ OG CD8+ T-celler i det lokale graftmiljøet. Et ytterligere eksperiment indikerte imidlertid at eksogent IL – 2 i fravær av parenkymalt antigen ikke kunne drive OT-I CD8+ celleutvidelse. IL-2 (rekombinant hIL-2, 25 000 IE) ble administrert intraperitonealt Til b6-mus som fikk bipolare transplantater Av B6.ß og b6 holmer. Sammenligning av ot-I-restitusjon i organer gjenfunnet FRA IL-2 eller mus behandlet MED kjøretøy ved dag 6 etter transplantasjonen viste ingen signifikant økning i akkumulering av delte OT – i-celler på to steder som mangler parenkymalt antigen, Nemlig b6 øyetransplantater (3±3 hos mus behandlet med kjøretøy sammenlignet med 49±64 hos MUS behandlet MED IL-2, P = 0.342) OG ikke-drenerende inguinal LN (1648 + 633 i kjøretøy behandlet sammenlignet med 1660+1023 I IL-2 behandlede mus, p=0,987, gjennomsnittlig±s. d., n=3, to-tailed uparret t-test med Welchs korreksjon).