Prognostisk verdi av tumorstørrelse I STADIUM II og III kolorektal kreft i Tunisisk befolkning
-
Tumorstørrelse (TuS) ble rapportert å være prognostisk ved kolorektal kreft.
-
I vår studie studerte Vi TuS ‘ prognostiske rolle og identifiserte en cutoff-verdi med høyest prediksjonsytelse.
-
En størrelse på 4 cm hadde en prognostisk effekt og forstyrret andre prognostiske faktorer.
-
vi observerte at alder ≥65 år, stadium III, venøs invasjon og pn+ større enn 3 var signifikante dårlige prognostiske faktorer hos pasienter Med tus ≥4, men bare stadium III var en uavhengig prognostisk faktor i multivariate analyser.
-
Administrasjon av kjemoterapi var den eneste faktoren med signifikant innvirkning på overlevelse i univariate og multivariate analyser hos pasienter med TuS mindre enn 4 cm.
Kolorektal kreft (CRC) er den tredje vanligste kreften over hele verden og den nest vanligste årsaken til kreftrelatert død I Vestlige land . I Tunisia representerer Det et folkehelseproblem. Forekomsten økte de siste 15 årene . Til tross for forbedring av diagnostiske og opparbeidingsprosedyrer og også på grunn av mangel på screeningsprogrammer, forblir DE fleste CRC–tilfellene i Tunisia detektert på et lokalt avansert (pT3-T4, knutepositiv) eller metastatisk stadium . Prognosen har blitt forbedret de siste årene, med tverrfaglig ledelse; 5-års total overlevelse (OS) anslås å være rundt 70% I STADIUM II og 50% stadium III . Det er gjort mange forsøk på å finjustere risikovurderingsfaktorene i CRC for å identifisere pasienter som mest sannsynlig vil ha nytte av adjuvant behandling. Disse faktorene er hovedsakelig kliniske, patologiske og nylig molekylære (mikrosatellitt ustabilitet / mikrosatellitt stabilitet, cDNA), noen av dem er fortsatt utenfor rekkevidde i mange land. Tumorstørrelse (TuS) er en surrogatmarkør for overlevelse i mange gastrointestinale kreftformer: gastrisk kreft, gastro-intestinal stromal tumor, karcinoide svulster . Dens relevans I CRC er uklar, med motstridende resultater i flere rapporterte serier . Tus integrerte ikke internasjonale retningslinjer som en av markørene å vurdere når man vurderer risiko og indikerer adjuvant kjemoterapi . I en fersk studie med patologisk vurdering av 1443 NYE TILFELLER AV CRC I Det sentrale Tunisia, 67,5% av pasientene Hadde En TuS større enn 5 cm, er dette funnet helt forskjellig fra tilfeller I Vestlige land . I vår nåværende studie forsøkte Vi å studere Ytelsen Til TuS ved å forutsi overlevelse I trinn II OG III CRC og å undersøke forholdet Mellom TuS og kjente prognostiske faktorer.
Pasienter & metoder
vi gjennomgikk i ettertid en kohort på 257 pasienter diagnostisert med kolon og / eller rektal adenokarsinom, behandlet i To onkologiske sentre: Abderrahmen Mami Hospital og Clinique Taoufik Hospital mellom 2003 og 2014. Vi inkluderte stadium II-III tilfeller, ifølge American Joint Committee On Cancer (AJCC)/Union Internationale Contre Le Cancer (UICC) 7. utgave, behandlet med kurativ hensikt. Vi vurderte kun pasienter med komplett utredning og tilgjengelige patologidata inkludert TuS og oppfølgingsdata. I studietiden ble oppfølging programmert etter fullført kurativ terapi, hver 3-4 måneder i de første 2 årene, hver 6. måned fra år 3 til 5 og deretter årlig. Ved hvert besøk hadde pasientene fysisk undersøkelse og ble sjekket for symptomer og terapitoksisitet. Abdominal ultralyd og brystrøntgen ble utført hver 6. måned, fra og med 2012 ble thorakoabdominal CT-skanning og tumormarkører (carcinoembryonisk antigen, CA19–9) utført hver 6. måned.
TuS ble definert som horisontal tumorutvidelse målt ved maksimal tumordiameter. Vi brukte receiver-operating characteristic (ROC) for å bestemme TuS-ytelse ved å forutsi overlevelse og å identifisere en cutoff-verdi korrelert med overlevelse. Vi sammenlignet også egenskapene til de to gruppene med cutoff-verdien, og undersøkte prognostiske faktorer i univariate og multivariate analyser i hver gruppe.
Statistisk analyse
alle analyser ble utført MED spss 20-programvare. VI analyserte ROC-kurver og analyserte området under kurven (AUC) for å bestemme nøyaktigheten Av TuS ved å forutsi overlevelse. EN AUC på 1,0 var feilfri prediksjon av kreft hos pasienter, MENS EN AUC på 0,50 representerer en halv sannsynlighet for en nøyaktig prediksjon av kreftstatus. Jo høyere AUC-ROC, jo større er den diskriminerende kraften Til TuS for utfallet. OS ble definert som tiden fra diagnosedato til død av en hvilken som helst årsak eller tap til oppfølging eller siste nyheter. OS ble evaluert i Henhold Til Kaplan-Meier-metoden. Prognostiske faktorer ble vurdert ved en univariat analyse ved hjelp av log-rank test og med en multivariat analyse ved Hjelp Av en cox proporsjonal risiko modell. En p-verdi mindre enn 0,05 ble ansett som statistisk signifikant.
Resultater
for den samlede populasjonen var gjennomsnittsalderen 59 år gammel (25-85 år), 57.2% var menn. Vi observerte EN FASE III sykdom hos 53% av pasientene blant dem 37,5% var pN2. Adjuvant kjemoterapi ble gitt til alle pasienter MED STADIUM III sykdom (97,7% inneholdende oksaliplatin). I stadium II sykdom 53% av tilfellene fikk kjemoterapi, de var pT4 stadium i 22,5%, mindre enn 12 fjernet lymfeknuter i 28% og hadde akutt kirurgi i 15% av tilfellene. Gjennomsnittlig TuS var 7 cm .
I ROC-analyse ble AUC for TuS i prediksjon av overlevelse vist I Figur 1. TuS ytelse i å forutsi overlevelse ble sammenlignet med ytelsen til antall involverte lymfeknuter. AUC var 0.62 ± 0.048 for TuS og 0.60 ± 0.56 for positive lymfeknuter.

en størrelse på 4 cm ble identifisert som en prediktor for overlevelse med en sensitivitet på 88,2% og en spesifisitet på 59,2%. Vi observerte 98 pasienter med tus ≤4 cm og 159 pasienter med TuS større enn 4 cm. Pasienter med TuS større enn 4 cm var mer sannsynlig å ha kreft i tykktarmen (81,1 vs 70,4%, p = 0,002) og vanligvis pT4 (44 vs 22.4%, p = 0,0001). Vi observerte ingen signifikant forskjell i forhold til kjønn, akutt kirurgi, mindre enn 12 fjernede lymfeknuter, antall positive lymfeknuter, stadium og oksaliplatinadministrasjon mellom pasienter tus ≤4 cm og pasienter med tus større enn 4 cm (Tabell 1).
| Variabler | tumorstørrelse ≤4 cm, % (n = 89) | Tumorstørrelse > 4 cm, % (n = 159) | p-verdi |
|---|---|---|---|
| Alder: | |||
| – Median (gjennomsnitt) alder – ≥65 år | 56 73.4 (72) 22.6 (26) |
62.8 (100) 38.2 (59) |
0.32 0.07 |
| Kjønn: | |||
| – Mann – Kvinne |
50 (49) 50 (49) |
57.2 (91) 43.8 (68) |
0.25 |
| BMI†: | |||
| – <30 – ≥30 |
91.3 (63) 8.7 (6) |
85.8 (85) 14.2 (14) |
0.28 |
| Beliggenhet: | |||
| – Kolon – Endetarm |
70.4 (69) 29.6 (29) |
81.1 (129) 8.9 (30) |
0.002* |
| Kirurgisk nødsituasjon: | |||
| – Ja – Nei |
(14) (84) |
11.3 (18) 88.7 (141) |
0.52 |
| <12 lymfeknuter undersøkt§: | |||
| – Ja – Nei |
34.6 (34) 65.4 (64) |
44.6 (71) 55.3 (88) |
0.11 |
| pN+: | |||
| – 1–3 – >3 |
83.6 (82) 16.4 (16) |
77.9 (124) 22.1 (35) |
0.26 |
| pT: | |||
| pT1–pT3 pT4 |
77.6 (76) 22.4 (22) |
55.9 (89) 44.1 (70) |
<0.01* |
| Stage: | |||
| – Stage II – Stage III |
47.9 (47) 52.1 (51) |
47.1 (75) 42.9 (84) |
0.9 |
| Adjuvant therapy: | |||
| – Yes – No |
76.6 (75) 23.4 (23) |
79.2 (126) 20.8 (33) |
0.6 |
| Oxaliplatine: | 0.48 | ||
| – Yes – No |
48.9 (48) 51.1 (50) |
53.4 (85) 46.6 (74) |
|
| Relapse rate (%) | 35.2 | 37.1 | 0.75 |
| ttr‡ (måneder) | 26 | 34 | 0.13 |
†Kun Tilgjengelig hos 168 pasienter.
‡på tide å slappe av.
§i begge trinn II OG III.
*Vesentlige p-verdier.
Gjengitt med tillatelse Fra © Oxford University Press (2017).
OS var signifikant bedre I tus ≤4 cm sammenlignet med TuS større enn 4 cm, gjennomsnittlig overlevelse var 158 versus 106 måneder, hazard ratio = 2.92 (95% KI: 1,27-6,75, p = 0,01). 5-års overlevelse av pasienter var 84% hos pasienter med tus ≤4 cm og 76% hos pasienter med TuS større enn 4 cm (p = 0,008, Se Figur 2).
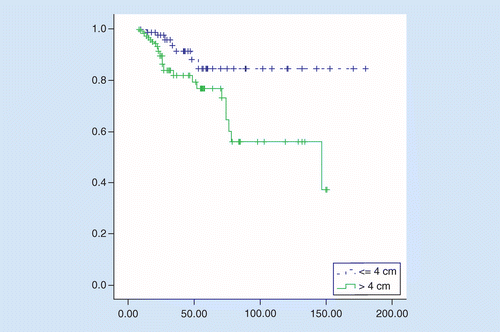
Prognostiske faktorer ble undersøkt i begge gruppene. I univariate analyser observerte vi en signifikant dårlig effekt av alder ≥65 år, stadium III, venøs invasjon og pN + større enn 3 på overlevelse hos pasienter med TuS større enn 4 cm. Bare i multivariat analyse var fase III en uavhengig prognostisk faktor. Hos pasienter Med tus ≤4 cm var kjemoterapi i adjuvant setting hovedfaktorene med signifikant innvirkning på overlevelse i univariate og multivariate analyser, det var ingen prognostisk effekt av de andre testede faktorene (Tabell 2).
| Variabler | Tumorstørrelse < 4 cm (n = 159) | tumorstørrelse ≥4 cm (n = 89) | ||
|---|---|---|---|---|
| 5-ÅR OS (%) | TIME (95% KI) | 5-års OS (%) | TIME (95% KI) | |
| Alder: | ||||
| – <65 år | 87 78 |
1.07 (0.208−5.531) | 82 60 |
2.47 (1.35–5.88)* |
| pN+: | ||||
| – 1-3 – >3 |
78 82 |
2.14 (0.41–11.08) | 79 65 |
2.838 (1.25–6.41)* |
| pT: | ||||
| – pT1–pT3 – pT4 |
84 82 |
1.51 (0.29–7.79) | 84 74 |
1.44 (0.67–3.09) |
| Venous invasion: | ||||
| – Yes – No |
80 81 |
0.97 (0.189–5.08) | 63 84 |
2.94 (1.14–7.78)* |
| Stage: | ||||
| – Stage II – Stage III |
77 86 |
0.651 (0.148–2.955) | 85 58 |
0.285 (0.123–0.66)* |
| Adjuvant therapy: | ||||
| – Yes – No |
94 58 |
0.135 (0.025–0.696)* | 78 67 |
0.641 (0.257–1.6) |
| Oxaliplatine: | ||||
| – Yes – No |
92 83 |
0.28 (0.034–2.39) | 78 70 |
0.441 (0.19–1.02) |
| Tumor location: | ||||
| – Colon – Rectum |
90 75 |
0.428 (0.095-1.931) | 75 80 |
2.699 (0.806–9.03) |
*Vesentlige HR-verdier.
Hr: Hazard ratio; OS: total overlevelse.
Diskusjon
i Dag, I Vestlige land, førte integrering av okkulte screeningsprogrammer til diagnosen CRC i tidligere stadier . I en nylig seer-databasert studie mellom 2006 og 2012 ble 38% av tykktarmskreft tilfeller og 43% av endetarmskreft tilfeller diagnostisert på et tidlig stadium . I lav-mellominntektsland er et slikt screeningprogram ikke tilgjengelig; og de fleste tilfeller diagnostiseres på et regionalt eller avansert stadium med høy TuS . Identifisering av prognostiske faktorer er et viktig verktøy for å forbedre utfallet i slike land. Vår studie undersøkte den prognostiske rollen TIL TS i fase II OG III CRC i Tunisisk befolkning. Vi observerte at TuS ikke bare hadde innvirkning på overlevelse, men også forstyrret andre prognostiske faktorer. Stadium III var en uavhengig prognostisk faktor i høyvolumtumorer, mens mange ‘klassiske’ prognostiske faktorer ikke hadde noen innvirkning på mindre svulster. Flere studier rapporterte prognostisk verdi av TuS med redusert overlevelsesassosiert økt TuS . I en studie Av Kornprat et al. TuS var signifikant assosiert med progresjonsfri og kreftspesifikk overlevelse i univariate og multivariate analyser i kolon, men ikke i endetarmskreft . I vår serie, høyere TuS var mer vanlig i tykktarmskreft plassering. Faktisk kan tykktarmskreft forbli asymptomatisk i lengre tid, noe som forklarer høyere TuS ved diagnose sammenlignet med rektal kreft. Det var imidlertid ingen forskjell i overlevelse mellom svulster ≥4 cm lokalisert i kolon og svulster ≥4 cm lokalisert i rektum. Det var heller ingen påvirkning av tumorplassering i mindre tumor (< 4 cm). Så basert på denne analysen hadde TuS ikke en rolle i å forutsi prognose basert på tumorplassering (kolon vs endetarm). Saha et al. rapportert i deres store pasientserie at TuS er positivt korrelert med viktige prognostiske faktorer og negativt påvirket overlevelse i kolonkreft . Dens rolle i endetarmskreft er fortsatt ikke klart.
Høyere TuS var også assosiert med pT4 stadium, rapportert å ha verste prognose Enn t1-2n1 stadium (Intergroup trial INT-0089) . Tumorbelastningen kan gjenspeile en svulstes evne til å formidle gjennom tarmveggen, noder og andre organer. Faktisk, I vår studie, TuS hadde en prediktiv ROC analyseverdi nær prediktiv verdi av antall positive lymfe. I svulster mindre enn 4 cm observerte vi ingen forskjell i overlevelse MELLOM stadium II OG III pasienter. Dette funnet kan forklares ved at vår fase II-populasjon var en høyrisikopopulasjon med dårligere prognose (nær stadium III-prognose): mange stadium pT4, mange tilfeller med mindre enn 12 fjernede lymfeknuter, mange tilfeller operert i nødssituasjon (for perforering og obstruksjon). I to SEER-databaserte studier hadde mindre svulster dårligere prognose som er stadium II sykdom. Forfatterne antydet at små TuS kan være en surrogatmarkør for biologisk aggressivitet som resulterer i dårligere utfall sammenlignet med relativt større TuS blant stadium II . Samme observasjoner ble sett i en italiensk studie . Vi undersøkte også rollen til flere prognostiske faktorer i Henhold Til TuS. Vi observerte at flere prognostiske faktorer som alder, stadium, antall involverte lymfeknuter, tumorplassering ikke hadde signifikant innvirkning i gruppen pasienter med lav TuS. I vår studie hadde adjuvant kjemoterapi positiv effekt på små svulster, bør TuS betraktes som en høyrisikofaktor I fase II? Videre studier med fokus på dette problemet er nødvendig.
Flere fallgruver kan noteres i vår serie: den lille utvalgsstørrelsen, den retrospektive innsamlingen av data og fraværet av sentral gjennomgang av patologisk rapport for en presis TS-evaluering. Vi hadde ikke nok tilgjengelige data om eksakt tumorplassering, så vi kunne ikke utføre en slik analyse. Molekylær testing ble introdusert I Tunisia i 2015, i vår studieperiode var den ikke tilgjengelig. Evaluering Av TuS i henhold til stadium og administrasjon av oksaliplatin ble ikke gjort, for for lite antall pasienter å trekke konklusjoner.
Konklusjon
TuS er en objektiv parameter som lett kan måles under patologisk undersøkelse. Det kan representere en ytterligere prognostisk faktor i en befolkning med høy grad av lokalt avansert stadium.
Fremtidige perspektiver
Flere og komplekse genetiske aletraions og / eller veier, kan være bak TuS i kolorektal kreft, molekylær analyse tar hensyn til størrelsen på svulsten kan føre til mer nøyaktige explantations i sin prognostiske rolle.
Finansielle & konkurrerende interesser disclosure
forfatterne har ingen relevante tilknytninger eller økonomisk engasjement med noen organisasjon eller enhet med en økonomisk interesse i eller økonomisk konflikt med emnet eller materialer diskutert i manuskriptet. Dette inkluderer ansettelse, konsulentselskaper, honoraria, aksjeeierskap eller opsjoner, ekspert vitnesbyrd, tilskudd eller patenter mottatt eller ventende, eller royalties.
ingen skriftlig assistanse ble benyttet i produksjonen av dette manuskriptet.
Etisk oppførsel av forskning
forfatterne oppgir at de har fått passende institutional review board-godkjenning eller har fulgt prinsippene som er skissert i Helsinkideklarasjonen for alle eksperimentelle undersøkelser av mennesker eller dyr. I tillegg til undersøkelser som involverer mennesker, er det innhentet informert samtykke fra de involverte deltakerne.
- 1 Torbjørn r. et al. Global kreftstatistikk, 2012. SERTIFISERINGSINSTANS. Kreft J. Clin. 65(2), 87–108 (2015).Crossref, Medline, Google Scholar
- 2 Missaoui N, Jaidaine L, Abdelkader AB et al. Kolorektal kreft i Sentrale Tunisia: økende forekomst trender over en 15-års periode. Asiatisk Pac. J. Kreft Prev. 12(4), 1073–1076 (2011).Medline, Google Scholar
- 3 Missaoui N, Trabelsi A, Parkin DM et al. Trender i forekomsten av kreft I Sousse-regionen, Tunisia, 1993-2006. Int. J. Kreft 127(11), 2669-2677 (2010).Crossref, Medline, CAS, Google Scholar
- 4 År J, DU XL, Li ST et al. Kjennetegn ved forskjellig lokalisert kolorektal kreft støtter proksimal og distal klassifisering: en populasjonsbasert studie av 57.847 pasienter. PLoS ONE 11(12), e0167540 (2016).Crossref, Medline, Google Scholar
- 5 Quan J, Zhang R, Liang H et al. Virkningen av tumorstørrelse på overlevelse av pasienter med pT4aN0M0 gastrisk kreft. Er. Surg. 79(3), 328-331 (2013).Medline, Google Scholar
- 6 Zhai ZW, Gu J. Påvirkning av tumorstørrelse på prognosen hos pasienter med tykktarmskreft. Zhonghua Wei Chang Wai Ke Za Zhi. 15(5), 495–498 (2012).Medline, Google Scholar
- 7 Huang B, Feng Y, Zhu l et al. Mindre tumorstørrelse er assosiert med dårlig overlevelse I stadium II kolonkreft: en analyse av 7719 pasienter I seer-databasen. Int. J. Surg. Lond. Engl. 33 (Pt A), 157-163 (2016).Crossref, Medline, Google Scholar
- 8 Crozier JE, McMillan DC, McArdle CS et al. Tumorstørrelse er assosiert med systemisk inflammatorisk respons, men ikke overlevelse hos pasienter med primær operativ kolorektal kreft. J. Gastroenterol. Hepatol. 22(12), 2288–2291 (2007).Crossref, Medline, Google Scholar
- 9 Labianca R, Nordlinger B, Beretta gd et al. Tidlig tykktarmskreft: ESMO Klinisk Praksis retningslinjer for diagnose, behandling og oppfølging. Anne. Oncol. 24 (Suppl. 6), VI64–VI72 (2013).Crossref, Medline, Google Scholar
- 10 Mandel JS, Kirke TR, Bond JH et al. Effekten av fekal okkult-blod screening på forekomsten av kolorektal kreft. N. Engl. J. Med. 343(22), 1603–1607 (2000).Crossref, Medline, CAS, Google Scholar
- 11 Siegel RL, Miller KD, Fedewa SA et al. Kolorektal kreft statistikk, 2017. CA Kreft J. Clin. 67(3), 177–193 (2017).Crossref, Medline, Google Scholar
- 12 Kornprat P, Pollheimer MJ, Lindtner RA, Schlemmer A, Rehak P, Langner C. Verdi av tumorstørrelse som en prognostisk variabel i kolorektal kreft: en kritisk reappraisal. Er. J. Clin. Oncol. 34(1), 43–49 (2011).Crossref, Medline, Google Scholar
- 13 Saha S, Shaik M, Johnston G et al. Tumorstørrelse forutsier langsiktig overlevelse i kolonkreft: en analyse Av National Cancer Data Base. Er. J. Surg. 209(3), 570-574 (2015).Crossref, Medline, Google Scholar
- 14 Le Voyer TE, Sigurdson ER, Hanlon al et al. Kolon kreft overlevelse er forbundet med økende antall lymfeknuter analysert: en sekundær undersøkelse Av Intergroup Trial INT-0089. J. Clin. Oncol. 21(15), 2912–2919 (2003).Crossref, Medline, CAS, Google Scholar
- 15 Wang Y, Zhuo C, Shi d et al. Ugunstig effekt av liten tumorstørrelse på årsaksspesifikk overlevelse i stadium iia tykktarmskreft, en SEER – basert studie. Int. J. Kolorektal Dis. 30(1), 131–137 (2015).Crossref, Medline, Google Scholar
- 16 Santullo F, Biondi A, Cananzi FCM et al. Tumorstørrelse som prognostisk faktor hos pasienter med stadium iia tykktarmskreft. Er. J. Surg. doi:10.1016/j.amjsurg.2017.03.038 (2017) (Epub ahead of print).Medline, Google Scholar
- 17 Mejri N, Dridi M, Labidi S et al. P-299 prognostic value of tumor size in stage II and III colorectal cancer in Tunisian population. Ann. Oncol. 28(Suppl. 3), mdx261.296 (2017).Google Scholar