Syrer, Baser og pH
|
|||||||||
SYRER og DERES KONJUGATBASER
Husk Bronsted–Lowry-definisjonen av en syre: en syre er en protondonor. Klart, i vårt tidligere eksempel eddiksyre donerer sitt proton TIL H2O i fremoverreaksjonen, noe som resulterer i dannelsen av acetationet. I omvendt reaksjon aksepterer acetationet et proton FRA H3O+ for å gå TILBAKE TIL CH3COOH. Fra Bronsted-Lowry-definisjonen er en base en protonacceptor.
|
dermed virker acetationet som en base i omvendt reaksjon, og er kalt konjugatbasen av eddiksyre. Eddiksyre og acetationet er kjent som et syrebasekonjugatpar. Interessant nok er det et andre syre-base-konjugatpar i reaksjonen ovenfor. Legg merke til HVORDAN I omvendt reaksjon donerer H3O+ et proton (gjør det til en syre), MENS I fremoverreaksjonen aksepterer H2O et proton (gjør det til en base). H2O og H3O+ er et konjugat syre-base par, MED H3O+ er konjugat syre og H2O er konjugat base.
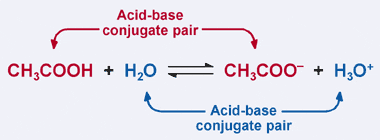
i et konjugat syre-base par har konjugat syre en mer proton enn den tilsvarende konjugat base.