17.3: de vorming van complexe ionen
het Effect van de vorming van complexe ionen op de oplosbaarheid
Wat gebeurt er met de oplosbaarheid van een licht oplosbaar zout als een ligand dat een stabiel complex ion vormt aan de oplossing wordt toegevoegd? Een dergelijk voorbeeld komt voor in de conventionele zwart-wit fotografie. Bedenk dat zwart-wit fotografische film lichtgevoelige microkristallen van AgBr bevat, of mengsels van AgBr en andere zilverhalogeniden. AgBr is een matig oplosbaar zout, met een Ksp van 5,35 × 10-13 bij 25°C. Wanneer de sluiter van de camera opent, raakt het licht van het object dat wordt gefotografeerd enkele kristallen op de film en start een fotochemische reactie die AgBr omzet in zwart Ag metaal. Goed gevormde, stabiele negatieve beelden verschijnen in tinten van grijs, overeenkomend met het aantal korrels van AgBr omgezet, met de gebieden blootgesteld aan het meest licht wordt donkerst. Om het beeld te fixeren en te voorkomen dat meer AgBr-kristallen worden omgezet in Ag-metaal tijdens de verwerking van de film, wordt de niet-gereageerde AgBr op de film verwijderd met behulp van een complexatiereactie om het spaarzaam oplosbare zout op te lossen.
de reactie voor het oplossen van zilverbromide is als volgt:
\
met
\
het evenwicht ligt ver naar links en de evenwichtsconcentraties van Ag+ en Br-ionen zijn zeer laag (7,31 × 10-7 M). Als gevolg hiervan zou het verwijderen van niet-gereageerde AgBr van zelfs maar één rol film met zuiver water tienduizenden liter water en veel tijd vergen. Het principe van Le Chatelier vertelt ons echter dat we de reactie naar rechts kunnen sturen door een van de producten te verwijderen, waardoor meer AgBr zal oplossen. Bromide-ion is moeilijk chemisch te verwijderen, maar zilver-ion vormt een verscheidenheid aan stabiele twee-coördinatencomplexen met neutrale liganden, zoals ammoniak, of met anionische liganden, zoals cyanide of thiosulfaat (S2O32−). Bij fotografische verwerking wordt overtollig AgBr opgelost met behulp van een geconcentreerde oplossing van natriumthiosulfaat.
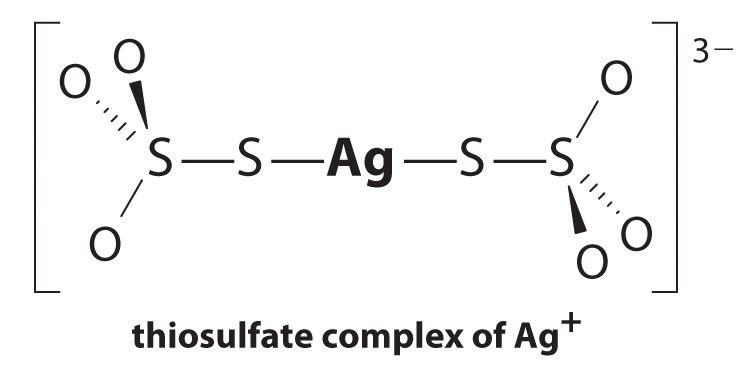
de reactie van Ag + met thiosulfaat is als volgt:
\^{3−}_{(aq)} \ label{17.3.5a}\]
met
\
de grootte van de evenwichtsconstante geeft aan dat bijna alle Ag + ionen in oplossing onmiddellijk gecomplexeerd zullen worden door thiosulfaat tot 3 -. We kunnen zien dat het effect van thiosulfate op de oplosbaarheid van AgBr door het schrijven van de juiste reacties en het toevoegen van hen samen:
\\ \mathrm{Ag^+(aq)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}\hspace{3mm}K_\textrm f&=2.9\times10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=15\end{align} \label{17.3.6}\)
het Vergelijken van K met Ksp toont aan dat de vorming van het complex ion verhoogt de oplosbaarheid van AgBr door ongeveer 3 × 1013. De dramatische toename van de oplosbaarheid in combinatie met de lage kosten en de lage toxiciteit verklaart waarom natriumthiosulfaat bijna universeel wordt gebruikt voor de ontwikkeling van zwart-witfilm. Indien gewenst kan het zilver worden teruggewonnen uit de thiosulfaat oplossing met behulp van een van de verschillende methoden en gerecycled.
als een complex ion een grote Kf heeft, kan de vorming van een complex ion de oplosbaarheid van spaarzaam oplosbare zouten aanzienlijk verhogen.
voorbeeld \(\Paginindex{2}\)
vanwege het gemeenschappelijke ioneneffect kunnen we verwachten dat een zout zoals AgCl veel minder oplosbaar is in een geconcentreerde oplossing van KCl dan in water. Een dergelijke aanname zou echter onjuist zijn, omdat het voorbijgaat aan het feit dat zilverion de neiging heeft om een twee-coördinatencomplex te vormen met chloride−ionen (AgCl2 -). Bereken de oplosbaarheid van AgCl in elke situatie:
- in zuiver water
- in 1,0 M KCL-oplossing, waarbij de vorming van complexe ionen
- wordt genegeerd dezelfde oplossing als in Deel b), behalve rekening houdend met de vorming van complexe ionen, ervan uitgaande dat AgCl2− het enige Ag+ – complex is dat zich vormt in significante concentraties
bij 25°C, Ksp = 1,77 × 10-10 voor AgCl en Kf = 1.1 × 105 voor AgCl2−.
gegeven: Ksp van AgCl, KF van AgCl2-en KCL-concentratie
gevraagd: oplosbaarheid van AgCl in water en in KCL-oplossing met en zonder de vorming van complexe ionen
strategie:
- schrijf de oplosbaarheidsproductexpressie voor AgCl en bereken de concentratie van Ag+ en Cl-in water.
- Bereken de concentratie van Ag+ in de KCL-oplossing.
- schrijf gebalanceerde chemische vergelijkingen voor de ontbinding van AgCl en voor de vorming van het AgCl2− complex. Tel de twee vergelijkingen op en bereken de evenwichtsconstante voor het totale evenwicht.
- schrijf de evenwichtsconstante expressie voor de totale reactie. Oplossen voor de concentratie van het complexe ion.
oplossing
- A als we x gelijk laten zijn aan de oplosbaarheid van AgCl, dan bij evenwicht = = x M.,
de oplosbaarheid van AgCl in zuiver water bij 25°C is dus 1,33 × 10-5 M.
- b Als x gelijk is aan de oplosbaarheid van AgCl in de KCL-oplossing, dan bij equilibrium = x M en = (1,0 + x) M. << 1.0,
als het gemeenschappelijke ioneneffect de enige belangrijke factor was, zouden we voorspellen dat AgCl ongeveer vijf ordes van grootte minder oplosbaar is in een 1,0 M KCL-oplossing dan in water.
- C om rekening te houden met de effecten van de vorming van complexe ionen, moeten we eerst de evenwichtsvergelijkingen schrijven voor zowel de ontbinding als de vorming van complexe ionen. Het toevoegen van de vergelijkingen die overeenkomen met Ksp en Kf geeft ons een vergelijking die de ontbinding van AgCl in een KCL-oplossing beschrijft. De evenwichtsconstante voor de reactie is daarom het product van Ksp en Kf:
\\ \mathrm{Ag^+(aq)}+\mathrm{2Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K_\textrm f&=1.1\times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f}=1.9\times10^{-5}\end{align}\)
D Als x gelijk de oplosbaarheid van AgCl in de KCl-oplossing, dan bij evenwicht = x en = 1,0 − x. Het vervangen van deze hoeveelheden in het evenwicht constante uitdrukking voor de netto reactie en in de veronderstelling dat x << 1.0,
dat wil zeggen dat AgCl oplost in 1,0 M KCl om een 1,9 × 10-5 m oplossing van het AgCl2− complex ion te produceren. Zo voorspellen we dat AgCl ongeveer dezelfde oplosbaarheid heeft in een 1,0 M KCL oplossing als in zuiver water, wat 105 keer groter is dan voorspeld op basis van het gemeenschappelijke ioneneffect. (In feite is de gemeten oplosbaarheid van AgCl in 1,0 M KCl bijna een factor 10 groter dan die in zuiver water, grotendeels te wijten aan de vorming van andere chloride-bevattende complexen.)
Oefening \(\Pagina{2}\)
Bereken de oplosbaarheid van kwik(II) jodide (HgI2) in elke situatie:
- zuiver water
- een 3.0 M oplossing van het NaI, uitgaande van een 2− is de enige Hg-met soorten die in significante hoeveelheden
Ksp = 2.9 × 10-29 voor HgI2 en Kf = 6.8 × 1029 voor 2−.
Antwoord
- 1.9 × 10-10 M
- 1.4 M
complexvormers, moleculen of ionen die de oplosbaarheid van metaalzouten verhogen door oplosbare metaalcomplexen te vormen, zijn gemeenschappelijke componenten van wasmiddelen. Carbonzuren met lange ketens, de belangrijkste bestanddelen van zepen, vormen onoplosbare zouten met Ca2+ en Mg2+, die in hoge concentraties aanwezig zijn in “hard” water. De neerslag van deze zouten produceert een badring en geeft een grijze tint. Het toevoegen van een complexvormer zoals pyrofosfaat (O3POPO34−, of P2O74−) of trifosfaat (P3O105−) aan detergentia voorkomt dat de magnesium-en calciumzouten neerslaan omdat de evenwichtsconstante voor complex-ionenvorming groot is:
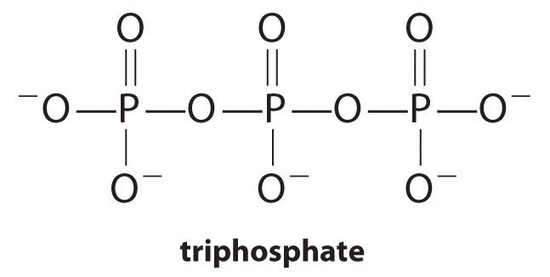
met
fosfaten kunnen echter milieuschade veroorzaken door eutrofiëring te bevorderen, de groei van overmatige hoeveelheden algen in een waterlichaam, wat uiteindelijk kan leiden tot een grote daling van het gehalte aan opgeloste zuurstof die vissen en andere waterorganismen doodt. Bijgevolg hebben veel staten in de Verenigde Staten het gebruik van fosfaathoudende detergentia verboden, en Frankrijk heeft het gebruik ervan vanaf 2007 verboden. “Fosfaatvrije” detergentia bevatten verschillende soorten complexvormers, zoals derivaten van azijnzuur of andere carbonzuren. De ontwikkeling van fosfaatvervangers is een terrein van intensief onderzoek.
waterontharders in de handel gebruiken ook een complexvormer om hard water te behandelen door het water over ionenuitwisselingsharsen te laten lopen, complexe natriumzouten. Wanneer het water over de hars stroomt, wordt het natriumion opgelost en worden onoplosbare zouten op het harsoppervlak neergeslagen. Op deze manier behandeld Water heeft een zoute smaak door de aanwezigheid van Na+, maar het bevat minder opgeloste mineralen.
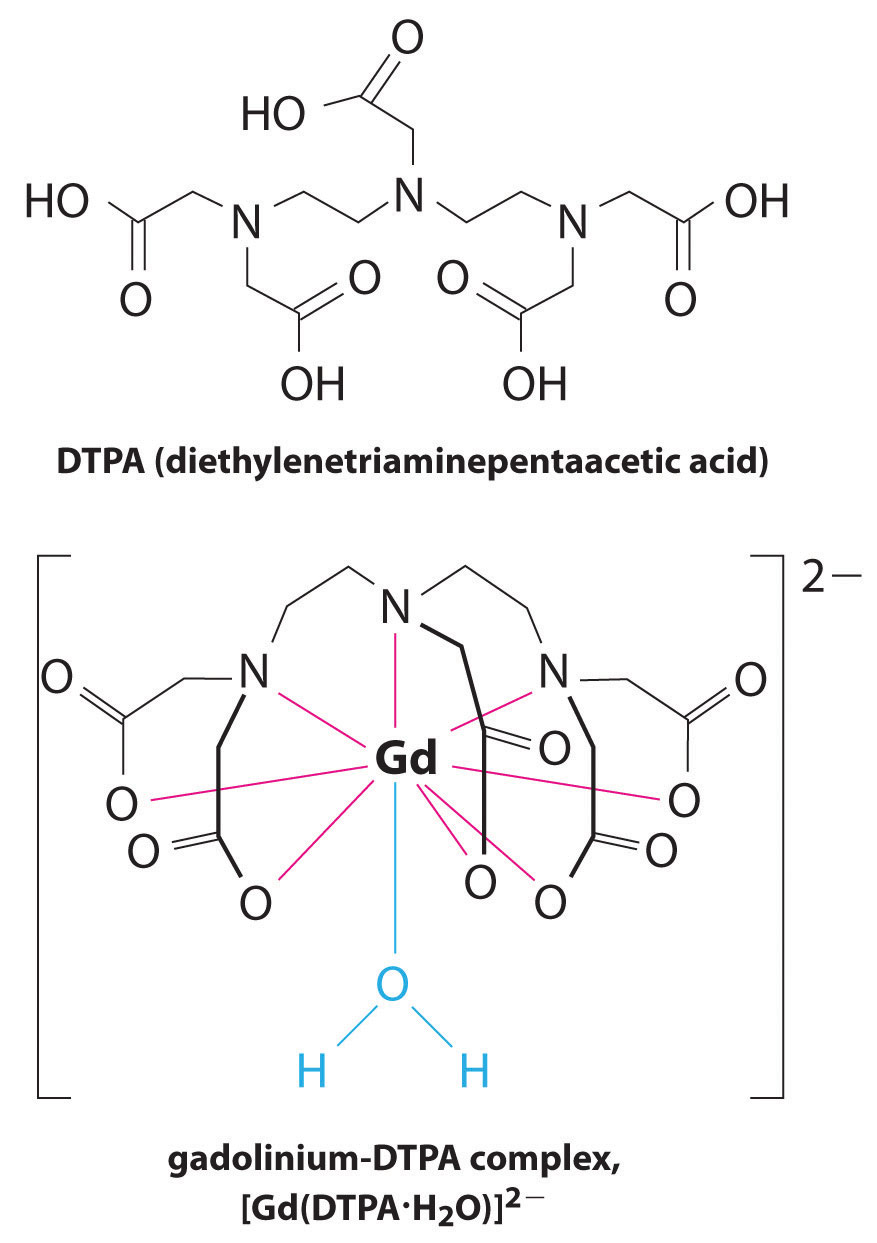
een andere toepassing van complexvormers wordt gevonden in de geneeskunde. In tegenstelling tot x-stralen, kan magnetic resonance imaging (MRI) vrij goede beelden van zachte weefsels zoals interne organen geven. MRI is gebaseerd op de magnetische eigenschappen van de 1h-kern van waterstofatomen in water, een belangrijke component van zachte weefsels. Omdat de eigenschappen van water niet erg afhankelijk zijn van of het zich in een cel of in het bloed bevindt, is het moeilijk om gedetailleerde beelden van deze weefsels te krijgen die een goed contrast hebben. Om dit probleem op te lossen, hebben wetenschappers een klasse van metaalcomplexen ontwikkeld die bekend staan als “MRI-contrastmiddelen.”Het injecteren van een MRI-contrastmiddel in een patiënt beïnvloedt selectief de magnetische eigenschappen van water in cellen van normale weefsels, in tumoren of in bloedvaten en stelt artsen in staat om elk van deze afzonderlijk te “zien” (figuur \(\Paginindex{2}\)). Een van de belangrijkste metaalionen voor deze toepassing is Gd3+, die met zeven ongepaarde elektronen zeer paramagnetisch is. Omdat Gd3+(aq) vrij toxisch is, moet het worden toegediend als een zeer stabiel complex dat niet loskomt in het lichaam en intact kan worden uitgescheiden door de nieren. De complexvormers die voor gadolinium worden gebruikt, zijn liganden zoals DTPA5 – (diethyleentriamine pentaazijnzuur), waarvan de volledig geprotoneerde vorm hier wordt weergegeven.
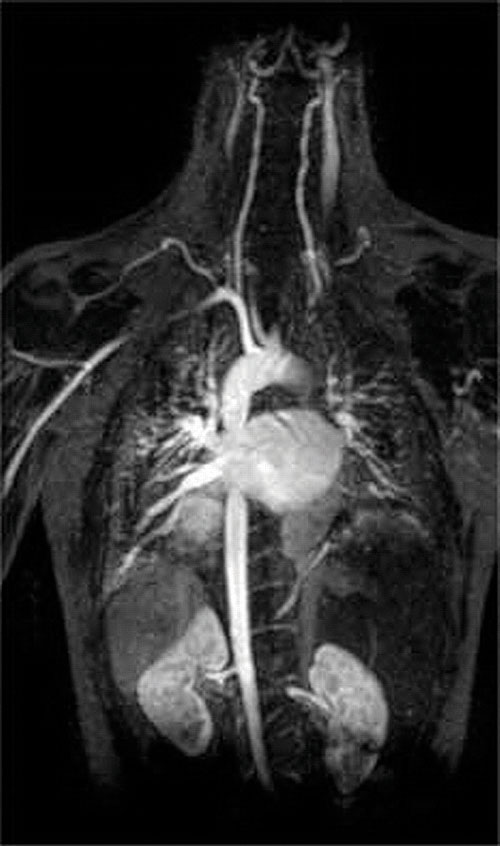
figuur \(\Pagindex{2}\): een MRI-beeld van het hart, de slagaders en de aderen. Wanneer een patiënt wordt geïnjecteerd met een paramagnetisch metaalkation in de vorm van een stabiel complex dat bekend staat als een MRI-contrastmiddel, worden de magnetische eigenschappen van water in cellen veranderd. Omdat de verschillende omgevingen in verschillende soorten cellen verschillend reageren, kan een arts gedetailleerde beelden van zachte weefsels verkrijgen.