2.3: koolmonoxide en backbonding
algemene eigenschappen
CO is een datief ligand van het L-type dat de oxidatietoestand van het metaalcentrum bij binding niet beïnvloedt, maar wel het totale aantal elektronen met twee eenheden verhoogt. We hebben onlangs gezien dat er echt twee bindingsinteracties spelen in de carbonylligand: een ligand-naar-metaal n → dσ interactie en een metaal-naar-ligand dn → π* interactie. Deze laatste interactie wordt backbonding genoemd, omdat het metaal elektronendichtheid teruggeeft aan het ligand. Om mezelf te herinneren aan het bestaan van backbonding, gebruik ik graag de rechter resonantie structuur waar mogelijk; het is echter belangrijk om te onthouden om CO te behandelen als een L-type ligand, ongeacht welke resonantie vorm wordt getekend.

orbitale interacties in M = C = O.
CO is een sterke σ-donor (of σ-base) en een goede π-acceptor (of π-zuur). De eigenschappen van ligated CO hangen sterk af van de identiteit van het metalen centrum. Meer specifiek, de elektronische eigenschappen van het metalen centrum dicteren het belang van backbonding in metaal carbonylcomplexen. De meeste botweg, meer elektron-rijke metalen centra zijn beter in backbonding aan CO. Waarom is het belangrijk om de sterkte van backbonding vast te stellen?Infraroodspectroscopie wordt gebruikt om het idee van backbonding empirisch te ondersteunen. De onderstaande tabel rangschikt sommige metaalcarbonylcomplexen in “periodieke” volgorde en geeft de frequentie weer die overeenkomt met de C = O-rekmodus. Merk op dat zonder uitzondering elke gecomplexeerde CO een stretchfrequentie heeft die lager is dan die van vrije CO. Backbonding is de schuld! De C-O-bindingsvolgorde in gecomplexeerd koolmonoxide is (bijna altijd) lager dan die van vrij CO.

C = O stretchfrequenties in metaal-carbonylcomplexen. Lijkt er hier iets niet in orde?
bovenstaande figuur toont een duidelijke toename van de frequentie (een toename van de C–O-obligatieorde) als we van links naar rechts bewegen in het periodiek systeem. Deze bevinding kan vreemd lijken als we bedenken dat het aantal d-elektronen in het neutrale metaal toeneemt als we van links naar rechts bewegen. Zouden metalen centra met meer d-elektronen niet beter moeten zijn in backbonding (en meer “elektronenrijk”)? Wat is hier aan de hand? Denk aan de periodieke trend in orbitale energie. Als we van links naar rechts bewegen, nemen de D orbitale energieën af en scheiden de energieën van de DN en π* orbitalen. Als gevolg hiervan wordt de backbonding orbitale interactie erger (vergeet niet dat sterke orbitale interacties goed op elkaar afgestemde orbitale energieën vereisen) als we naar de meer elektronegatieve late transitie metalen bewegen! We kunnen een analogie trekken met enamines en enol-ethers uit organische chemie. Het meer elektronegatieve zuurstofatoom in enol-ethers is een slechtere elektronendonor dan het stikstofatoom van enamine.

het belang van backbonding hangt af van de elektronegativiteit van het metaal en zijn elektronendichtheid.
natuurlijk kan ook de bijdrage van andere liganden op het metalen centrum aan backbonding niet worden vergeten. Logisch, elektron-donerende liganden zullen de neiging om de backbond sterker te maken (ze maken het metaal een betere elektron donor), terwijl elektron-terugtrekkende liganden backbonding zal verergeren. Het toevoegen van elektron-rijke phosphine ligands aan een metaalcentrum, bijvoorbeeld, vermindert de co het uitrekken frequentie toe te schrijven aan verbeterd backbonding.
Carbonylliganden zijn beroemd om het overbruggen van meerdere metalen centra. De binding in overbrugde carbonylcomplexen kan “traditioneel” zijn of gedelokaliseerd, afhankelijk van de structuur van het complex en de overbruggingsmodus. De verscheidenheid van het overbruggen modi komt voort uit de verschillende elektrondonors en acceptoren aanwezig op de co ligand (en de mogelijkheid van delokaliseerde binding). Bekende overbruggingsmodi worden weergegeven in de onderstaande figuur.
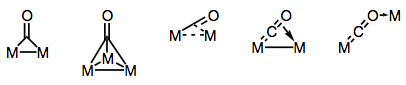
bruggen bouwen met carbonyl liganden!