7.4: Complex III
Complex III accepteert elektronen van zowel Complex I als Complex II. de elektronen komen aan in de vorm van ubiquinol, UQH2, dat twee elektronen en twee protonen levert en wordt omgezet naar ubiquinon, UQ. De ubiquinon gaat dan terug naar Complex I of Complex II om meer elektronen te verzamelen.
- Complex III is de bestemming voor elektronen afkomstig van zowel Complex I als Complex II.
- Complex III maakt gebruik van energie die vrijkomt bij elektronentransfers naar beneden om meer protonen door het binnenste mitochondriale membraan te pompen.
- de protongradiënt over het membraan wordt gebruikt om ATP-vorming aan te drijven bij Complex V.
- Complex III stuurt vervolgens zijn elektronen naar Complex IV.
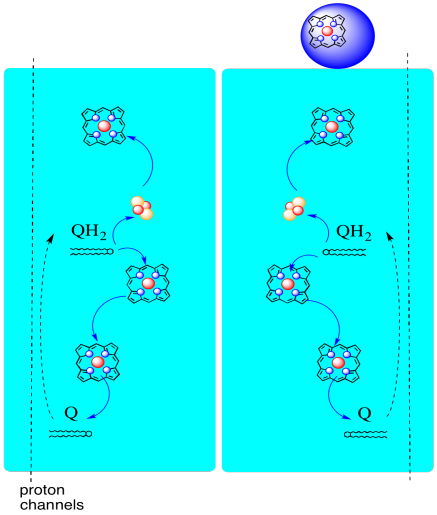
de weg van elektronen door Complex III wordt hieronder getoond. Merk op dat het complex een dimere structuur is, met twee gelijkwaardige paden: een aan de linkerkant en de andere aan de rechterkant. Elektronen worden geleverd uit uqh2, ubiquinol, in het midden van het beeld, reizen omhoog naar de mobiele cytochroom c aan de bovenkant. Een tweede elektronweg staat reis naar beneden in het beeld toe, naar een andere molecule van ubiquinone, die de elektronen in een lijn recycleert.
- Complex III heeft een ongebruikelijke, divergerende elektronenroute.
- een elektron reist verder naar cytochroom c.
- het tweede elektron wordt uiteindelijk gerecycled tot een andere ubiquinol.
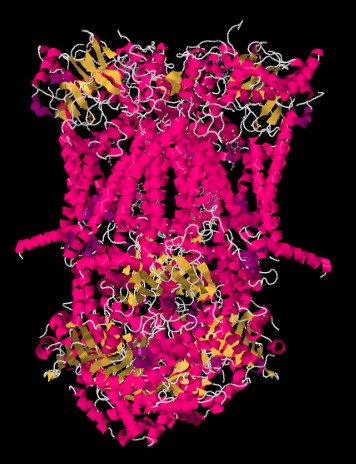
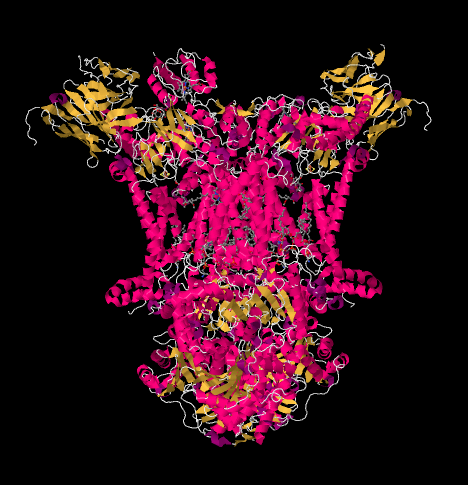
de X-ray structuur van Complex III wordt getoond in cartoon vorm hieronder. Het binnenste mitochondriale membraan zou het bovenste middengedeelte van het complex snijden. De meerderheid van de complexe projecten hieronder, in de matrix (de onderkant van het beeld, in deze oriëntatie) hoewel een aanzienlijke hoeveelheid ook uitsteekt in de intermembrane ruimte.
Complex III zet de elektronentransportketen voort en stuurt elektronen naar een hoger reductiepotentieel (en lagere vrije energie) en naar een ontmoeting met moleculaire zuurstof in Complex IV. Protonen worden ook gepompt uit de mitochondriale matrix, over het binnenste mitochondriale membraan en in de intermembrane ruimte. Tegelijkertijd resulteert een tweede elektronenroute in een effectieve recycling van de helft van de elektronen die in het complex komen, waardoor het aantal gepompte protonen per elektron dat bij Complex III aankomt, toeneemt..
- er is gesuggereerd dat de elektronenrecyclinglijn een mechanisme biedt om meer protonen uit de matrix te trekken.
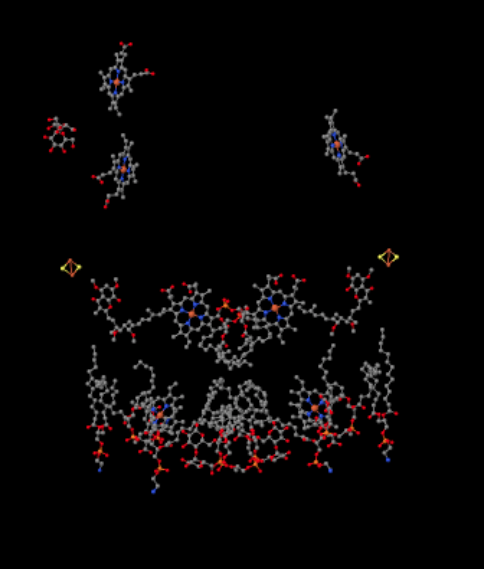
we kunnen deze ongewone opstelling zien als we de eiwitten negeren om de liganden te onthullen, hieronder. Het complex kan duidelijker worden gezien als een dimeer; de linkerhelft van het beeld is precies hetzelfde als de rechter, hoewel de tegenovergestelde kant weerkaatst. Elektronen komen het complex binnen via de mobiele drager, ubiquinol, zichtbaar aan de rechter-en linkerkant van de foto ongeveer halverwege; je ziet de ring en een ketting eraan hangen.
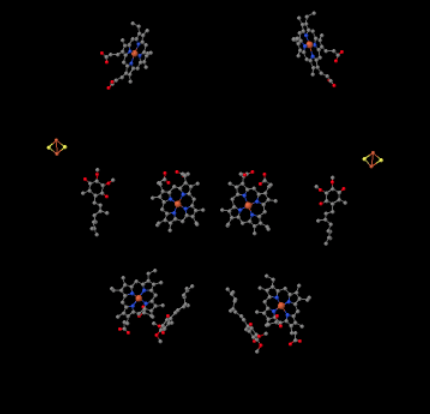
wanneer Uqh2 bindt aan Complex III, wordt één elektron doorgestuurd naar een Fes-cluster, terwijl het tweede naar een ijzer-heem-centrum wordt gestuurd, heme BL genaamd. De Fes cluster is zichtbaar net boven de ubiquinol en aan de rand van de foto. De heme BL is naar het midden van de foto.
hoewel het niet duidelijk is in de getoonde röntgenfoto, is dit Fes-cluster anders dan degene die u eerder zag. Deze wordt op zijn plaats gehouden met verschillende aminozuur zijketens. Dat zie je niet op de foto omdat het hele eiwit weggelaten is, samen met de aminozuren die aan de cluster binden. Terwijl de meeste Fes-clusters uitsluitend door cysteines op hun plaats worden gehouden, wordt deze cluster door twee cysteiens aan één kant gehouden maar door twee histidines aan de andere kant. Deze bijzondere FeS cluster wordt een Rieske cluster genoemd.
Rieske-clusters zijn belangrijk omdat het”high potential FeS-clusters” zijn. Dat betekent dat ze een uitzonderlijk positief reductiepotentieel hebben in vergelijking met andere Fes-clusters. Het reductiepotentieel van om het even welke ligand in een proteã ne is hoogst afhankelijk van zijn milieu, en zo is er een brede waaier van waarden in de meeste gevallen. Dat geldt voor ijzerzwavelclusters; normale hebben reductiepotentialen die variëren van -1,0 V tot ongeveer + 0,05 V. Rieske-clusters hebben potentialen die variëren van ongeveer 0V tot ongeveer 0,4 V.
van de Fes-cluster wordt het elektron doorgestuurd naar een ander ijzer heme-centrum in een membraangebonden eenheid genaamd cytochroom c1. Cytochroom c1 is bovenaan de foto te zien. Omdat dit beeld op dezelfde manier is georiënteerd als de andere Röntgenstructuren van het ademhalingscomplex, kunnen we zien dat dit elektron naar de intermembrane ruimte wordt getransporteerd. Ten slotte wordt dit elektron overgebracht naar een andere heem, maar deze heem wordt gebonden in een klein, mobiel eiwit, genaamd cytochroom c. cytochroom c is een andere mobiele elektronendrager. Het brengt het elektron naar complex IV. we gaan later terug naar cytochroom c.
voordat we daar komen, waar gaat het andere elektron heen? Van heme BL wordt het tweede elektron doorgegeven aan een ander ijzerporfyrinecomplex, heme BH. Dat is naar de onderkant van de foto, dus dit elektron wordt teruggestuurd naar de matrix. Wachten bij de heme BL, echter, er is een andere ubiquinone, UQ. Het wacht op het elektron. Het zal eigenlijk wachten op twee, dan zijn dok te verlaten en terug te gaan rond de ubiquinol (UQH2) bindingsplaats om de elektronen weer af te leveren.
waarom moeite doen? Waarom sturen we de elektronen niet de eerste keer goed op weg? Het lijkt erop dat ze worden gerecycled om een of andere reden. Men gelooft dat deze afleiding zorgt voor extra protonen worden gepompt over het mitochondriale membraan. Wanneer de tweede ubiquinon wordt gereduceerd tot ubiquinol door de acceptatie van twee elektronen, neemt het ook nog twee protonen op uit de matrix hieronder. Die protonen worden uiteindelijk doorgegeven naar de intermembrane ruimte wanneer de ubiquinol opnieuw geoxideerd wordt. Deze recycling, en het uitpersen van een paar extra protonen om de Proton gradiënt te verhogen, wordt de Q-lus genoemd.
het voordeel van de Q-lus wordt uitgelegd in het volgende diagram. In het diagram worden de ingangen van complex III in rood weergegeven, de uitgangen in blauw en de gerecycleerde elementen in groen. Als één ubiquinol gewoon zijn elektronen en protonen leverde en klaar was, zouden er twee protonen per ubiquinol geleverd worden. Dat is één proton output per elektron dat input was.
een tweede ubiquinol zou precies hetzelfde doen. Er zouden vier protonen output voor vier elektronen aanvankelijk input zijn. Dat is nog steeds één proton output per elektron dat input was.
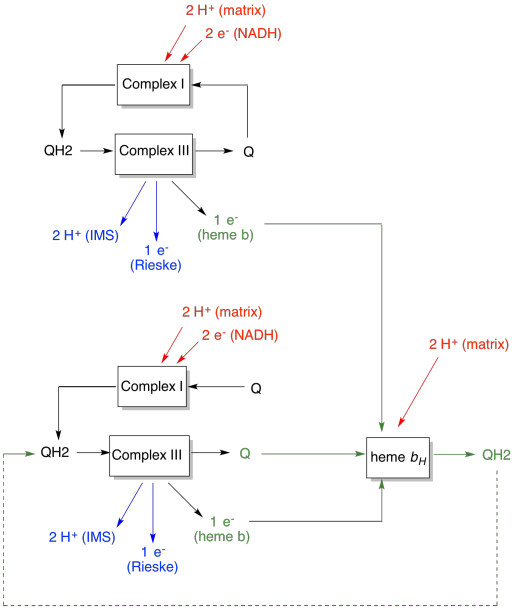
als in plaats daarvan elke keer één elektron wordt gerecycled, dan leidt elke seconde ubiquinol tot de levering van een extra paar protonen. Dat komt omdat bij het oppakken van de gerecycleerde elektronen, een ubiquinon terug moest reizen naar de matrixzijde van het membraan en nog twee protonen moest oppikken. In het algemeen betekent dit dat zes protonen worden geleverd voor vier elektronen input, of 1,5 protonen output per elektroneninvoer. Aangezien de protongradiënt is wat ATP genereert, wordt de efficiëntie verhoogd door het aantal gepompte protonen per elektron te verhogen.
- de Q-loop verhoogt het aantal protonen dat per elektroneninvoer in het systeem wordt gepompt.
nu gaan we terug naar de uitgaande elektronendrager, cytochroom c, die de elektronen naar Complex IV zal brengen. In de foto hieronder, uit een andere X-ray kristalstructuur, is het Complex gevonden met een cyctochrome C docking op de bindingsplaats. Cytochroom c is een roze bolvormig eiwit aan de bovenkant van de foto, aan de linkerhelft van het dimeer als we het hier bekijken. Het zit aan de rand van de intermembrane ruimte, dat is waterige media. In tegenstelling tot ubiquinone, die langs door de lipide bilayer van het membraan glijdt, rolt cytochroom c of glijdt of zwemt over de bovenkant aan zijn bestemming.
hetzelfde beeld wordt hieronder getoond zonder het eiwit. Het onderste deel van de foto is vrij vol met lipiden, en er hangt een suiker rond aan de linkerkant, maar rechts bovenaan zie je de ijzeren porfyrine die is genesteld in de cytochroom c.
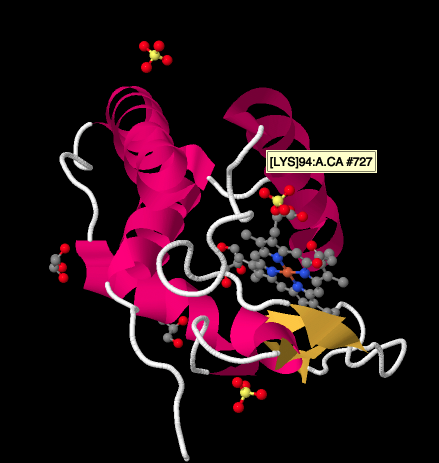
een nadere blik op een Röntgenstructuur van een cyctochrome c, hieronder, toont een relatief eenvoudig beeld vergeleken met de complexen waar we naar hebben gekeken. Er zijn een paar helices, een paar vellen, wat lussen, en dat ijzer porfyrine of heme weer. Een paar sulfaationen drijven rond in de buurt, evenals een paar glycerolmoleculen, waarschijnlijk geïntroduceerd tijdens zuivering of kristallisatie van het eiwit. Merk op dat de heme wordt gevonden aan de rand van het eiwit. Die locatie kan het gemakkelijker maken voor elektronenoverdracht van Complex III, of naar Complex IV.
- cytochroom c is de eindbestemming van elektronen die door Complex III bewegen.
- cytochroom c is een mobiele drager met één elektron.
- cytochroom c is eigenlijk een klein hydrofiel eiwit.
- cytochroom c wordt gevonden boven het mitochondriale membraan, aan de rand van de intermembraanruimte.
Wat weerhoudt cyctochrome c ervan de intermembrane ruimte in te dwalen? Als het dat zou doen, zou het de efficiënte stroom van elektronen onderbreken. Het is mogelijk dat cytochroom c heen en weer beweegt tussen Complex III en Complex IV via een mechanisme genaamd “steering”. Bij het sturen wordt de drager via aanvullende ladingen langs een traject geleid. Bijvoorbeeld, als het membraan negatief wegens polaire groepen op de membraanoppervlakte wordt geladen, dan kunnen de positieve lasten op de oppervlakte van cytochrome c zijn beweging aan de membraanoppervlakte beperken. Dat alleen al zou zijn mobiliteit verminderen van drie dimensies (overal in de intermembrane ruimte) naar twee dimensies (overal op het membraanoppervlak). Het is mogelijk dat bijkomende interacties de mobiliteit nog verder verminderen tot een eendimensionaal spoor tussen de twee complexen.
- stuurinrichting, gebaseerd op complementaire ladingen, voorkomt dat cytochroom c verloren gaat in de intermembraanruimte.
oefening \(\Paginindex{1}\)
stel mogelijke aminozuurresiduen aan de oppervlakte van cytochroom c voor die het kunnen helpen op een negatief geladen membraanoppervlak blijven.
antwoord
Arginine en lysine zijn positief geladen bij neutrale pH.
oefening \(\Paginindex{2}\)
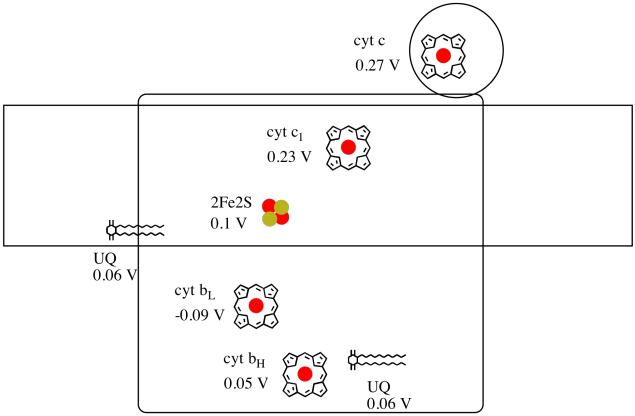
het is moeilijk om het reductiepotentieel van een individuele plaats binnen een proteã ne te meten. Nochtans, hebben de onderzoekers deze waarden kunnen schatten door EPR spectra onder diverse voorwaarden te meten. Uitgaande van het reductiepotentieel hieronder, teken een reactievooruitgang diagram voor transport van een elektron helemaal vanaf de initiële ubiquinondon helemaal tot cytochroom c.
 antwoord
antwoord
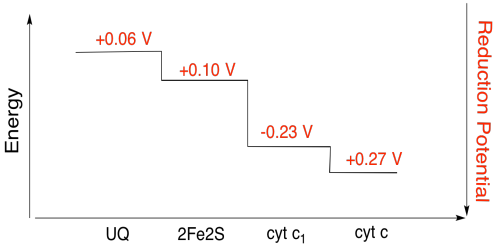
oefening \(\Paginindex{3}\)
gebruikmakend van de waarden in de figuur hierboven, bereken de energieverandering wanneer een elektron van de 2fe2s cluster aan cytochroom c1 wordt overgebracht.
Antwoord
in de Veronderstelling dat de vermindering van de mogelijkheden zijn:
2Fe2S(os) + e- → 2Fe2S(rood) Eored = 0,10 V
cyt c1(os) + e- → cyt c1(rood) Eored = 0.230 V
Dan worden de mogelijke verschil voor de reactie, ΔEo = 0.23 – (0.10) V = 0.13 V.
De Faraday relatie ΔG = – n F ΔEo geeft
ΔG = – 1 x 96,485 J V-1 mol-1 x 0.13 V = 12,543 J mol-1 = 12.5 kJ mol-1
oefening \(\Paginindex{4}\)
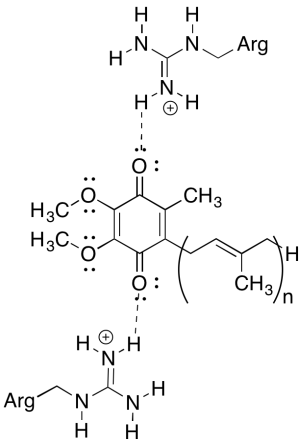
een van de verwarrende dingen over dit complex is dat, in de kringloop van elektronen, elektronenoverdracht lijkt te gaan van een initiële ubiquinon naar een uiteindelijke ubiquinon, zonder totale drijvende kracht. Het reductiepotentieel is echter zeer gevoelig voor het milieu. Laat zien hoe nabijgelegen arginineresiduen het reductiepotentieel van een ubiquinon positiever kunnen maken.
antwoord
de positieve arginineresiduen zouden via waterstofbindingen een gedeeltelijke positieve lading geven aan ubiquinon; ubiquinon zou daardoor een positiever reductiepotentieel hebben.
zie de focuspagina over de structuur van Complex III bij Biochemistry Online.X-ray crystal structure of Complex III from: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C.-A., Xia, D. Structural basis for the quinone reduction in the BC1 complex: a comparative analysis of crystal structures of mitochondrial cytochroom bc1 with bound substraat and inhibitors at the Qi site. Biochemie 2003, 4, 9067-9080. (1ntz)
X-ray crystal structure of Complex III with bound cytochroom c from: Solmaz, S. R., Hunte, C. Structure of complex III with bound cytochroom c in reduced state and definition of a minimal core interface for electrontransfer. J. Biol. Scheikunde. 2008, 283, 17542-17549. (3CXH)
X-ray crystal structure of cytochrome c from: Enguita, F. J., Pohl, E., Turner, D. L., Santos, H., Carrondo, M. A. Structural evidence for a proton transfer pathway coupled with haem reduction of cytochrome c” from Methylophilus methylotrophus. J. Biol. Inorg. Scheikunde. 2006 11, 189. (1OAE)
toeschrijving
Chris P Schaller, Ph. D., (College Of Saint Benedict / Saint John ‘ s University)