Citraat anticoagulatie tijdens CRRT voor acute nierbeschadiging
- Acute nierbeschadiging
- behandeling van Aki-niervervangende therapieën voor AKI
- hemodialyse, hemofiltratie en hemodiafiltratie
- aanvang en tijdstip van RRT voor AKI – intermitterende versus continue RRT
- anticoagulatie tijdens continue niervervangingstherapie (CRRT)
- Citraat-het mechanisme van zijn anticoagulerende werking en de toepassing ervan in CRRT
- mogelijke metabole stoornissen tijdens citraat-anticoagulated CRRT
- biochemische monitoring van patiënten die met citraat-anticoagulated CRRT
Acute nierbeschadiging
Acute nierbeschadiging (AKI), een klinisch syndroom met vele mogelijke oorzaken, wordt eenvoudig gedefinieerd als een abrupte afname van de nierfunctie over een periode van uren of dagen, hetgeen blijkt uit een recente toename van de serumcreatinineconcentratie en/of vermindering van de urineproductie .
het is verschillend van chronische nierziekte (CKD) waarbij de afname van de nierfunctie langzaam maar irreversibel progressief is en optreedt over een periode van maanden en jaren. AKI kan natuurlijk voorkomen in die met onderliggende CKD, en een diagnose van AKI wordt geassocieerd met groter dan normaal risico van een uiteindelijke diagnose van CKD .
internationaal overeengekomen richtlijnen stellen dat een diagnose van AKI kan worden gesteld als:
* serumcreatinine stijgt met ≥ 0,3 mg/dL (26,5 µmol / L) binnen 48 uur; of
• er een toename van 50% of meer in serumcreatinine is geweest binnen de afgelopen 7 dagen; of
• het urinevolume is
AKI omvat het volledige spectrum van ernst van een lichte afname in nierfunctie (stadium 1 AKI) tot nierfalen (stadium 3 AKI). De enscenering is afhankelijk van serum creatinine te meten, met of zonder urine-output-gegevens (Tabel I)
|
Podium |
Serum Creatinine |
Urine-uitgang |
|
1 |
1.5-1.9 keer baseline |
voor 6-12 uur |
|
2 |
2.0-2.9 keer baseline |
⩾ 12 uur |
|
3 |
3.0 keer baseline |
voor ⩾ 24 uur |
TABEL I: de drie fasen van De AKI ernst (uit ref 1)
De oorzaken van AKI zijn traditioneel ingedeeld in drie categorieën: prerenal; nier (intrinsieke); en postrenaal, met de nadruk op het feit dat AKI een specifieke renale etiologie kan hebben, maar ook het gevolg kan zijn van primair probleem buiten de nier.
elke aandoening die het effect heeft van het verminderen van de bloedtoevoer naar de nier (nierperfusie) is een potentiële oorzaak van prerenal AKI; deze aandoeningen omvatten: hypovolemie als gevolg van braken, diarree, bloeding, brandwonden of septische shock; en verminderde cardiale output als gevolg van bijvoorbeeld hartfalen en leverfalen (cirrose). De belangrijkste oorzaak van intrinsieke AKI is renale tubulaire necrose, als gevolg van renale ischemie of inname van nefrotoxische geneesmiddelen/toxines.
Sepsis, de meest voorkomende oorzaak van AKI bij ernstig zieke patiënten, is gedeeltelijk toe te schrijven aan slecht gedefinieerde intrinsieke nierschade die verwant is aan renale tubulaire necrose . Tot slot, postrenal AKI resultaten van een aandoening die urinestroom distale naar de nier belemmert; deze omvatten: nierstenen (calculi); prostaatziekte (tumor/hypertrofie); blaasdisfunctie; en urethrale strictuur.
behandeling van Aki-niervervangende therapieën voor AKI
er is geen specifieke behandeling voor AKI en de behandeling is grotendeels ondersteunend met een behandeling gericht op de onderliggende oorzaak. Terugtrekking van nefrotoxische geneesmiddelen, vochtreanimatie, en correctie van elektrolyt en zuur-base verstoring zijn allemaal onderdeel van deze algemene ondersteunende behandeling . Toediening van vasopressor of inotrope geneesmiddelen om de normale bloeddruk en het hartminuutvolume te herstellen kan noodzakelijk zijn.
Niervervangingstherapie (RRT), de focus van dit artikel, is de laatste redmiddelbehandeling voor patiënten met ernstige AKI die niet reageert op conservatieve ondersteunende behandeling. Ongeveer 23 % van de IC-patiënten met AKI (d.w.z. ongeveer 13% van alle IC-patiënten) krijgt RRT .
Niervervangingstherapie (RRT) is de generieke term voor alle behandelingen die de nierfunctie willen vervangen. Transplantatie van donornier aan die met eindstadium nierziekte kan als uiteindelijke RRT worden beschouwd , maar de term is vaker gereserveerd voor die therapieën die de bloedfiltering en homeostatische functies van de nier door dialyse vervangen, een proces dat een semi-permeabel membraan als bloedfilter gebruikt. Twee brede soorten dialytische RRT zijn beschikbaar voor de behandeling van AKI (en wat dat betreft, eindstadium CKD): peritoneale dialyse en hemodialyse.
hemodialyse omvat daarentegen het filteren van bloed in een machine buiten het lichaam (extracorporaal). Bloed wordt gepompt naar de filter / dialyzer, waar afvalproducten en overtollige vloeistof worden verwijderd, en vervolgens terug naar het lichaam. Dit extracorporale circuit (de dialysemachine en zijn verbindende buizen van en terug naar de patiënt) is een stollingsomgeving.
hemodialyse, hemofiltratie en hemodiafiltratie
moderne dialysemachines hebben de mogelijkheid voor hemofiltratie (HF) en hemodialyse (HD), waardoor drie verschillende dialytische modaliteiten voor de behandeling van AKI mogelijk zijn: hemodialyse (HD), hemofiltratie (HF) en hemodiafiltratie (HDF).
de kern van alle drie de modaliteiten is het semi-permeabele membraan dat een bloedfilter vormt. Als bloed gepompt uit de patiënt stroomt aan één kant van dit membraan, overtollig water en afval opgeloste stoffen passeren over het membraan. Het filtraat of effluent wordt naar afval gepompt als het gefilterde bloed naar de patiënt wordt teruggebracht.
bij hemodialyse (HD) wordt een dialysevloeistof gebruikt die continu en tegenstroomt naar bloed aan de andere kant van het membraan. De samenstelling en het stroomtarief van dialysevloeistof zorgen voor een constante concentratiegradiënt over het semi-permeabele membraan met betrekking tot bloedoplossingen. Deze concentratiegradiënten vergemakkelijken op hun beurt gecontroleerde verspreiding van opgeloste molecules over het membraan.
voor opgeloste stoffen zoals ureum en creatinine, die uit het bloed moeten worden verwijderd, is de concentratiegradiënt zodanig dat de diffusierichting van bloed naar dialysevloeistof is, terwijl voor opgeloste stoffen zoals bicarbonaat, dat vaak aan het bloed moet worden toegevoegd om de acidose in verband met ernstige AKI te corrigeren, dialysevloeistof met een hoge concentratie bicarbonaat ten opzichte van het bloed ervoor zorgt dat de diffusie in de tegenovergestelde richting plaatsvindt, van dialysevloeistof naar bloed. Aanpassing van de samenstelling en het debiet van de dialysevloeistof maakt op die manier patiëntspecifieke metabole correctie mogelijk.
Vochtovermaat is vaak een kenmerk van AKI dat tijdens hemodialyse wordt gecorrigeerd. Dit wordt bereikt door ultrafiltratie, die van de hydrostatische drukgradiënt afhangt die over het semi-permeabele membraan bestaat. De relatieve positieve hydrostatische druk aan de bloedzijde van het membraan “duwt” water effectief van bloed naar dialysevloeistof.
deze ultrafiltratie vergemakkelijkt ook de doorgang van opgeloste moleculen, die tijdens ultrafiltratie met water worden meegesleurd door een mechanisme dat opgeloste convectie (of oplosmiddelweerstand) wordt genoemd. Het gecombineerde effect van opgeloste diffusie, opgeloste convectie en ultrafiltratie tijdens hemodialyse heeft tot doel ervoor te zorgen dat het vloeistofvolume en de samenstelling binnen zowel het extracellulaire als het intracellulaire compartiment zo dicht mogelijk worden hersteld bij dat wat betrekking heeft onder die met normaal functionerende nieren.
Hemodiafiltratie (HDF) is de combinatie van HF en HD. Het maakt een optimale klaring van laagmoleculaire-gewicht opgeloste stoffen mogelijk door diffusie naar dialysevloeistof, gecombineerd met een optimale klaring van hoogmoleculaire-gewicht opgeloste stoffen door convectie en ultrafiltratie. Net als bij HF, HDF vereist continue vervangende vloeistof; en net als bij HD, HDF vereist dialysevloeistof.
aanvang en tijdstip van RRT voor AKI – intermitterende versus continue RRT
alle niervervangende therapieën (PD, HD, HF en HDF) kunnen intermitterend (d.w.z. meestal in 3-4 uur durende sessies) of continu worden toegediend totdat de nierfunctie is hersteld. Voor patiënten met nierfalen in het eindstadium, die een leven lang (chronisch) RRT nodig hebben, is de behandeling uitsluitend intermitterende hemodialyse (IHD), bijna altijd geleverd in vier uur durende sessies, drie keer per week .
patiënten met AKI hebben slechts een tijdelijke behoefte aan RRT om de nierfunctie te ondersteunen tijdens het verdwijnen van de kritieke/acute ziekte die AKI veroorzaakte. De gemiddelde duur van RRT bij patiënten met AKI is ongeveer 13 dagen , hoewel het in bepaalde gevallen slechts enkele dagen nodig kan zijn of vele weken kan duren.
traditionele (absolute) indicatoren voor het starten van RRT bij AKI zijn:
• hyperkaliëmie (plasmakalium > 6,0-6,5 mmol/l)
* ernstige uremie (plasma ureum > 30 mmol/l)
* tekenen van uremische encefalopathie
• acidose (pH * acuut longoedeem
het kan nuttig zijn om met de behandeling te beginnen voordat deze extreme effecten van AKI duidelijk zijn, maar de optimale timing voor het starten (en stoppen) van RRT is momenteel onduidelijk en het onderwerp van lopend onderzoek . Er zijn momenteel geen betrouwbare gegevens om een bepaald type RRT voor AKI te ondersteunen en bijgevolg zijn alle soorten RRT gebruikt.
de huidige richtlijnen weerspiegelen echter een consensus dat, ongeacht de modaliteit, RRT continu moet worden toegediend in plaats van met tussenpozen aan de meest ernstig zieke (hemodynamisch instabiele) patiënten. Recente onderzoeken tonen aan dat tegenwoordig continue niervervangende therapieën (CRRT ‘ s) veel vaker worden gebruikt dan intermitterende therapieën voor AKI, en dat de meest gebruikte CRRT continue veneuze veneuze hemofiltratie (CVVHF) is, gevolgd door continue veneuze hemodiafiltratie (CVVHDF).
anticoagulatie tijdens continue niervervangingstherapie (CRRT)
CRRT omvat, net als alle andere niervervangingstherapie, met uitzondering van peritoneale dialyse, het pompen van bloed door een niet-fysiologische, extracorporale kringloop. De inherente eigenschap van bloed te coaguleren (stolsel) bij contact met niet-fysiologische oppervlakken bepaalt dat om een “stolsel vrij” patiënt extracorporale circuit te behouden, bloed moet worden anticoagulated.
CRRT heeft een bijzondere behoefte aan anticoagulatie, vergeleken met intermitterende modaliteiten, vanwege de langdurige behandelingssessies en de relatief langzame snelheid waarmee bloed door het circuit wordt gepompt . Bovendien is het bloed van patiënten die CRRT nodig hebben vaak al in een relatieve stollingsvorm als gevolg van onderliggende kritieke ziekte (bijvoorbeeld sepsis) of trauma .
gedurende vele jaren was heparine, hetzij ongefractioneerde heparine (UF), hetzij laagmoleculaire heparine (LMWH), het enige antistollingsmiddel dat werd gebruikt in dialytische procedures, waaronder CRRT. Heparine wordt nog steeds gebruikt; het is een goedkoop en over het algemeen veilig middel voor anticoagulatie voor de meerderheid van patiënten die RRT nodig hebben.Systemische heparine-anticoagulatie, die niet kan worden vermeden, brengt echter onvermijdelijk een verhoogd risico op bloedingen met zich mee, zodat heparine-anticoagulatie tijdens dialytische procedures absoluut gecontra-indiceerd is voor diegenen die momenteel een bloeding hebben of een hoger risico op bloedingen hebben dan normaal.
bovendien kan heparine, in een kleine minderheid (
, de potentiële bloedingen en HIT-II risico ‘ s geassocieerd met het gebruik van heparine, de noodzaak van een alternatief antistollingsmiddel benadrukken voor sommige patiënten die RRT nodig hebben. Citraat bood een dergelijk alternatief. De regionale anticoagulation van het Citraat van de dialysekring, eerst met succes in de vroege jaren 1980 wordt gebruikt, werd oorspronkelijk gereserveerd voor die kleine minderheid van patiënten voor wie heparine gecontra-indiceerd is. Dat veranderde met resultaten van gerandomiseerde gecontroleerde onderzoeken waarin heparine-anticoagulated CRRT werd vergeleken met citraat-anticoagulated CRRT; deze toonden aan dat citraat zowel een effectiever als veiliger anticoagulans is dan heparine .
Citraat is daarom in de afgelopen jaren naar voren gekomen als het anticoagulans bij uitstek voor alle AKI-patiënten die CRRT nodig hebben . Intensive care units over de hele wereld melden nu overschakelen van heparine naar Regionale citraat anticoagulatie voor CRRT . Sommige autoriteiten bevelen zelfs het gebruik van citraat eerder aan dan heparine anticoagulation voor intermitterende (chronische) hemodialyse (IHD).
Citraat-het mechanisme van zijn anticoagulerende werking en de toepassing ervan in CRRT
Citraat, dat al meer dan een eeuw lang wordt gebruikt voor het anticoaguleren/conserveren van donorbloed voor transfusie , voorkomt bloedstolling door zijn vermogen om het geïoniseerde calcium (ICA) dat in bloedplasma circuleert te binden (chelaat). Deze iCa is een noodzakelijke cofactor voor zowel de bloedplaatjesaggregatie als verschillende belangrijke stappen in de intrinsieke en extrinsieke coagulatiewegen die verantwoordelijk zijn voor de productie van fibrine en daarmee de vorming van fibrinestolsel.
bloedstolling wordt voorkomen door verlaging van de plasma iCa-concentratie tot ongeveer 0,35 mmol/l (normaal ref-bereik 1,15-1,30 mmol/l). Deze niet-fysiologische, ernstig hypocalcemische toestand wordt bereikt door de plasmacitraatconcentratie te verhogen tot ongeveer 3 mmol/L (normale plasmacitraatconcentratie ~0,1 mmol/l ).
hoewel er verschillen in detail zijn beschreven door Morabito et al , omvatten alle protocollen voor citraatanticoagulatie tijdens CRRT de continue infusie van citraathoudende oplossing (gewoonlijk trinatriumcitraat of zuur-citraat-dextrose (ACD)-oplossing) op de prefilter/dialyselijn, dicht bij de plaats waar deze de patiënt verlaat, hetzij als afzonderlijke oplossing, hetzij in combinatie met voorfiltervervangende vloeistof. De stroomsnelheid van deze infusie wordt aangepast om een bloedcitraatconcentratie van ~3 mmol/L te bereiken, en daardoor een plasma iCa van ongeveer 0,35 mmol/l.
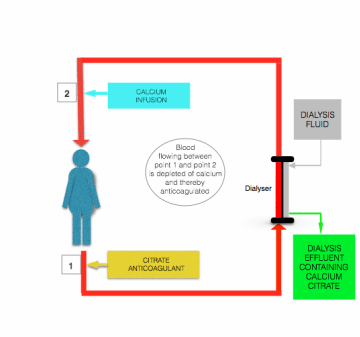
de hypocalciëmie geïnduceerd door citraatinfusie wordt gecorrigeerd voordat het bloed terugkeert naar de patiënt, door infusie van calcium bevattende oplossing (calciumchloride of calciumgluconaat) naar de postfilterlijn dicht bij de plaats waar het de patiënt binnenkomt (zie de figuur hierboven).
het grootste veiligheidsvoordeel van citraat-anticoagulatie ten opzichte van heparine-anticoagulatie is dat anticoagulatie beperkt blijft tot het extracorporale circuit. Deze zogenaamde “regionale anticoagulatie” wordt bereikt omdat het grootste deel van het geïnfundeerde citraat (als citraatanionen of calciumcitraatchelaat) uit het bloed wordt verwijderd tijdens de passage door de filter/dialysator .
enig overgebleven citraat in postfilterbloed wordt verdund in de systemische circulatie en snel gemetaboliseerd tot kooldioxide en water door de zuurstofafhankelijke Krebs-cyclus in de mitochondrion van weefselcellen (voornamelijk levercellen ).
metabolisme van citraat wordt geassocieerd met de productie van bicarbonaat: voor elk 1 mmol citraat dat wordt gemetaboliseerd, wordt 3 mmol bicarbonaat gegenereerd. De snelle klaring van citraat (halfwaardetijd van citraat in bloed is normaal gesproken ongeveer 5 minuten ) via deze voornamelijk hepatische route zorgt normaal gesproken voor de afwezigheid van systemische anticoagulatie tijdens CRRT, en daardoor geen extra risico op bloedingen.
mogelijke metabole stoornissen tijdens citraat-anticoagulated CRRT
de schijnbare terughoudendheid om citraat-anticoagulated CRRT voor alle AKI-patiënten volledig te accepteren, wordt tot voor kort toegeschreven aan bezorgdheid over de zuur-base-en elektrolytstoornissen die kunnen optreden bij patiënten die de behandeling krijgen .
de volgende elektrolyten-en zuur-base stoornissen zijn gemeld bij patiënten die met citraat-anticoagulated CRRT werden behandeld :
• hypocalciëmie / hypercalciëmie
* hypomagnesie / hypermagnesie
* hyponatriëmie / hypernatriëmie
* metabole alkalose
* metabole acidose
deze stoornissen kunnen zich om een aantal redenen voordoen, maar accumulatie van citraat in de perifere circulatie (citraattoxiciteit) kan centraal staan bij de meeste van deze stoornissen. Redenen waarom citraat zich kan ophopen tijdens CRRT zijn onder meer:
* verminderd metabolisme van citraat als gevolg van leverziekte en / of verminderde afgifte van zuurstof als gevolg van onvoldoende perfusie (bijv. bij septische / cardiogene shock)
* progressieve vermindering van membraandoorgankelijkheid tijdens dialyse met als gevolg verminderde filtratie van citraat en gelijktijdige toename van de afgifte van citraat in de systemische circulatie
* operationele fout-accidentele verhoogde snelheid van citraatinfusie in het extracorporale circuit en gelijktijdige verhoogde afgifte van citraat in de systemische circulatie
* bloedproducttransfusie-citraatconservatief aanwezig in bloedproducten draagt bij aan de citraatbelasting in de systemische circulatie als gevolg van CRRT
ongeacht de oorzaak, accumulatie van citraat in de perifere circulatie kan resulteren in citraatchelatie van circulerend geïoniseerd calcium, met als gevolg een verminderde Plasma geïoniseerde calciumconcentratie (hypocalciëmie). Als voldoende ernstige hypocalciëmie kan hartritmestoornissen en, uiteindelijk, hartstilstand veroorzaken .
hoewel plasma-geïoniseerd calcium tijdens citraataccumulatie verminderd is( toxiciteit), is het totale calcium verhoogd (hetgeen wijst op hypercalciëmie) omdat het aan citraat gebonden calcium is opgenomen in het gemeten totale calcium. Een verhoging van de verhouding van totaal tot geïoniseerd calcium (normaal 2,0) tot > 2.1 is gevonden om het betrouwbaarste signaal van citraattoxiciteit in de afwezigheid van routinematig beschikbare plasmacitraatschatting te zijn .
het risico op verhoogd plasmanatrium (hypernatrimie) geassocieerd met citraatanticoagulatie is toe te schrijven aan het hoge natriumgehalte (hypertoniciteit) van sommige citraatoplossingen die in CRRT worden gebruikt. Bijvoorbeeld, bevat de 4% – oplossing van trinatriumcitraat die in sommige protocollen wordt gebruikt natrium bij een concentratie van 420 mmol/L. in de praktijk, kan het gebruik van hypotone dialyse/vervangings vloeistoffen dit risico verminderen en hypernatremia is door alle rekeningen een zeldzame complicatie van citraat anticoagulation .
het risico op hypomagnesie (verminderd serummagnesium) tijdens anticoagulatie van citraat weerspiegelt het feit dat magnesium, net als calcium, een divalent ion is dat ook kan binden aan (chelaat) citraat. Als magnesiumverliezen als gevolg van de chelatiewerking van citraat niet volledig worden gecompenseerd door magnesium in dialysevloeistoffen/vervangende vloeistoffen, kan hypomagnesie optreden .
biochemische monitoring van patiënten die met citraat-anticoagulated CRRT
door middel van Point-of-care-tests met een bloedgasanalysator in de intensive care-eenheid kunnen de meeste parameters (geïoniseerd calcium, pH, bicarbonaat, base-overmaat, natrium en lactaat) snel en gemakkelijk worden gemeten, maar de totale serumcalcium-en magnesiumschattingen zijn gewoonlijk niet beschikbaar op deze platforms en monsters moeten voor deze metingen naar het laboratorium worden gestuurd.Twee recente studies tonen aan dat sommige bloedgasanalysatoren mogelijk niet betrouwbaar zijn voor het meten van geïoniseerd calcium bij de extreem lage, niet-fysiologische concentraties (~0.3 mmol/l) aanwezig in postfilterbloed, hoewel hun vermogen om plasma geïoniseerd calcium in de systemische circulatie (waar de concentratie veel hoger is) nauwkeurig te meten, niet in twijfel wordt getrokken. Alvorens een bloedgasanalysator te gebruiken om patiënten te controleren die met citraat-anticoagulated CRRT worden behandeld, is het raadzaam de leverancier van de bloedgasmachine te raadplegen en te bevestigen dat het instrument goed is gevalideerd om geïoniseerd calcium te meten bij de zeer lage concentratie (in het bereik van 0,15-0,4 mmol/L ) die in postfiltermonsters kan voorkomen.
|
gemeten Parameter |
controle-interval |
streefwaarden of CA. referentie-bereiken |
doel van de meting |
corrigerende maatregelen indien deze buiten het streefdoel vallen |
|
postfilter geïoniseerd calcium (iCa) concentratie, d.w.z. bloed bemonsterd uit postfilter poort. |
binnen 1 uur na aanvang en na elke wijziging van de citraatdosis, daarna om de 4-6 uur |
0.25-0.35 mmol/L |
|
Aanpassing van citrate dosis: stijging als iCa > 0.35, te verlagen indien iCa |
|
Systemische geïoniseerd calcium (iCa), dat wil zeggen het bloed opgenomen van de patiënt |
Baseline heeft alvorens te beginnen), dan 1 uur na het starten, vervolgens ten minste om de 4-6 uur |
1.15-1.30 mmol/L |
|
Aanpassing van calcium infusiesnelheid; verhogen als iCa 1.30 |
|
Systemische totaal calcium (TotCa), d.w.z. dat bloedmonster van patiënt (TotCa = iCa + calcium gebonden aan albumine + calcium gebonden aan citraat) |
ten minste om de 12-24 uur (moet gelijktijdig met systemische geïoniseerde calcium schatting) |
alleen vereist voor de bepaling van totCa:iCa ratio (zie hieronder )) |
||
|
Verhouding totaal / geïoniseerd calcium (totaal:iCa) |
Ten minste elke 12-24 uur |
op Te sporen citraat accumulatie/toxiciteit soms genoemd “citrate slot” |
Opties zijn:
|
|
|
Arteriële bloed gas analyse
|
Baseline heeft alvorens te beginnen) . binnen 1 uur na aanvang, daarna ten minste om de 4-6 uur. |
pH 7,35-7,45 bicarbonaat 23-28 mmol / l BE–2-+3 mmol / L |
voor het opsporen van zuur-base stoornissen: metabole alkalose metabole acidose |
opties in het geval van metabole alkalose omvatten:
|
|
Serum natrium |
een Keer per dag |
135-145 mmol/L |
Op te sporen ipernatremia/hyponatremia |
Zeldzame gebeurtenis – controleer de juiste dialyse/vervanging van de vloeistof |
|
Serum lactaat |
Baseline heeft alvorens te beginnen), dan is dit volgens de klinische behoeften |
om Te helpen identificeren van degenen die het risico van toxiciteit citraat |
Overwegen, samen met TotCa:iCa-verhouding, is het risico van toxiciteit citraat |
|
|
Serum magnesium |
minstens eenmaal Per dag |
Op te sporen hypomagnesia |
Correctie met magnesium infuus |
TABEL II: Biochemische monitoring tijdens de citraat-anticoagulated CRRT (Ref 24)