Frontiers in Medicine
- Introduction
- patiënten en methoden
- Patiëntenselectie in de Surveillance, Epidemiology, and End Results Database
- statistische analyse
- resultaten
- patiëntkenmerken
- verbeterd risico op T1-Stadium vergeleken met andere T-stadia in de Context van Serumcea-verhoging
- Effect van preoperatieve Serum-Cea-verhoging in T-Stadium
- discussie
- Gegevensbeschikbaarheidsverklaring
- ethische verklaring
- Auteursbijdragen
- belangenconflict
- Dankbetuigingen
Introduction
rectale kanker is een van de meest voorkomende maligniteiten wereldwijd (1). Volgens het American Joint Committee on Cancer (AJCC) staging systeem, de anatomische omvang van primaire tumor (T Stadium) is een van de belangrijkste prognostische voorspellers. Patiënten met hetzelfde T-stadium van rectale kanker kunnen echter aanzienlijk verschillende klinische resultaten vertonen.Het carcinoembryonisch antigeen (CEA) is een 180-200 kDa glycoproteïne en behoort tot de superfamilie immunoglobuline (2). CEA wordt afgescheiden door een verscheidenheid aan solide tumoren, waaronder 90% van colorectale kanker (3). Als de belangrijkste en betrouwbaarste serum prognostische biomarker bij colorectale kanker, worden verhoogde preoperatieve cea-niveaus geassocieerd met slechtere prognose van colorectale kanker (4-9).Eerdere studies hebben aangetoond dat CEA in verband werd gebracht met adhesie van kankercellen en aangeboren immuniteit bij colorectale kanker. Bovendien werd CEA ook gemeld om de hechting van colorectale kankercellen aan plaatsen van metastase te vergemakkelijken en tumorprogressie te ondersteunen (10-12).
traditioneel werd de verre verspreiding van tumorcellen beschouwd als een late gebeurtenis, maar de bevindingen van verschillende eerdere studies wezen erop dat het verwerven van metastatisch potentieel in het zeer vroege stadium van tumorprogressie (13-16) kon plaatsvinden. Wo et al. (17) gemeld dat een zeer kleine tumorgrootte betrokken bij lymfeknoop positiviteit een surrogaat voor agressieve biologie kan zijn. We vermoeden dan dat zeer vroeg stadium rectale kanker met serum cea verhoging de vroege verwerving van metastatisch potentieel zou kunnen suggereren en een zeer slechte overleving van rectale kanker voorspellen.
echter, voor zover wij weten, werden weinig studies gerapporteerd om de associatie van T-Stadium en serum cea spiegels (C0 en C1) te onderzoeken bij het bepalen van de prognose van rectale kanker. Daarom voeren we deze grote populatie-gebaseerde studie uit om te onderzoeken of zeer vroeg T-Stadium in de context van serum cea verhoging een surrogaat kan zijn voor biologisch agressieve ziekte en voorspelt voor slechte oorzaak-specifieke overleving (css) van rectale kanker. Om het effect van lymfeknooppositiviteit op ons onderzoek te verwijderen, hebben we vervolgens klierpositieve patiënten uitgesloten en de analyse gericht op Fase I-II patiënten.
patiënten en methoden
Patiëntenselectie in de Surveillance, Epidemiology, and End Results Database
als een gezaghebbende bron van informatie over de incidentie en overleving van kanker in de VS en een uitgebreide bron van population-based information met inbegrip van alle nieuw gediagnosticeerde kankergevallen die voorkomen in Surveillance, Epidemiology, and End Results (SEER)-deelnemende gebieden, omvat de Seer database ~28% van de Amerikaanse bevolking. De SEER-database bevatte geen identificatoren en was openbaar beschikbaar voor onderzoekers. SEER * Stat is een software die door het SEER-programma wordt geleverd om patiënteninformatie te verkrijgen via online toegang. In eerste instantie werd de case-listing sessie van de SEER*Stat software (SEER*Stat 8.3.5) gebruikt om alle patiëntgerelateerde informatie op te sommen, en patiënten met stadium I-II (knooppuntnegatieve) rectale kanker tussen 1 januari 2004 en 31 December 2015 werden geïdentificeerd uit de Seer database (figuur 1). Patiënten met rectale kanker werden geïdentificeerd met de ICD-o-3 site codes C199 en C209 en gedragscode 3 (NAACCR Items 522 en 523) (9). We kozen ervoor om deze jaren op te nemen omdat de informatie van preoperatieve serum CEA werd geregistreerd vanaf 2004 en Seer follow-up eindigde in 2015.

figuur 1. Stroomdiagram van de definities van de patiëntencohort.
daarna werden degenen die neoadjuvante radiotherapie kregen, gebrek aan positieve histologische bevestiging, met Onbekend ras, histologieën zonder adenocarcinoom of niet-actieve follow-up uitgesloten van onze studie. Patiënten met preoperatieve serum-CEA-spiegels werden in onze studie geïncludeerd en we groepeerden “positief / verhoogd” en “negatief / normaal”; binnen normale grenzen ” als C1 en C0 (C-fase informatie). De cut-offwaarden van CEA waren respectievelijk 2,5 ng/ml voor niet-rokers en 5 ng / ml voor rokers. Daarnaast werden ook de volgende klinisch-pathologische variabelen uit de SEER-database gehaald: T-Stadium, ras, geslacht, tumorlocatie, leeftijd bij diagnose, jaar van diagnose, graad en histologie.
statistische analyse
in deze studie werd de chi-kwadraattest van Pearson gebruikt om alle klinisch-pathologische variabelen van de patiënten uit de Seer-database te vergelijken tussen de normale en verhoogde preoperatieve serum-cea-spiegels. Sommige multivariabele Cox proportionele hazard modellen werden gebouwd om onafhankelijke prognostische variabelen van rectale kanker in onze analyses te identificeren. Overlevingscurves werden gegenereerd met behulp van de Kaplan–Meier-methode en verschillen tussen de curves werden geanalyseerd met behulp van een log-rank test. De belangrijkste resultaten van deze studie waren CSS en overall survival (OS). CSS werd berekend vanaf de datum van diagnose tot de datum van kanker-specifieke sterfte. Sterfgevallen toegeschreven aan de rectale kanker werden behandeld als gebeurtenissen, en sterfgevallen door andere oorzaken werden behandeld als gecensureerde waarnemingen op de datum van overlijden. Om te bepalen of er een significante interactie was tussen het preoperatieve serum CEA niveau en het T stadium bij het voorspellen van CSS, hebben we ook een interactievariabele gedefinieerd (T Stadium en serum cea niveau). Tweezijdig P < 0,05 werd statistisch significant geacht. Statistische analyses werden voornamelijk uitgevoerd met behulp van de SPSS versie 22 (IBM Corporation, Armonk, NY, USA).
resultaten
patiëntkenmerken
in totaal werden tussen 1 januari 2004 en 31 December 2015 19.184 patiënten met stadium I–II rectale kanker geïdentificeerd uit de Seer-database (figuur 1). Van deze patiënten werden 13.007 (67,8%) patiënten ingedeeld in het C0-Stadium en 6.177 (32,2%) patiënten werden ingedeeld in het C1-Stadium. Het AJCC staging system suggereerde dat 6.077 patiënten in het T1-stadium waren, 4.783 patiënten in het T2-Stadium, 7.021 in het T3-Stadium en 1.303 patiënten in het T4-Stadium. In totaal stierven 2.560 (13,3%) patiënten aan rectale kanker aan het einde van de follow-up. De mediane follow-up tijd van het hele cohort was 44 maanden (0-143 maanden). De uitgangswaarden van de patiënten worden samengevat in Tabel 1.
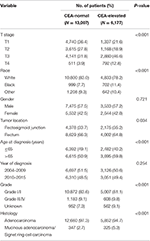
Tabel 1. Vergelijking van uitgangskenmerken van stadium I–II rectale kanker met het serumcarcinoembryonisch antigeen (cea) niveau.
verbeterd risico op T1-Stadium vergeleken met andere T-stadia in de Context van Serumcea-verhoging
bleek dat C1-Stadium waarschijnlijker correleerde met hoger T-Stadium, zwart, rectosigmoid junction, oudere leeftijd, hogere graad en mucineus adenocarcinoom/Zegelringcelcarcinoom (Tabel 1, P < 0,05). Zoals weergegeven in Tabel 2 werden ras, geslacht, tumorlocatie, leeftijd bij diagnose, jaar van diagnose, graad, histologie, T-Stadium en serum-cea-spiegel opgenomen in de multivariate Cox-analyse. Toen multivariate Cox analyse werd uitgevoerd, overtuigden we de volgende clinicopathologische kenmerken als onafhankelijke prognostische factoren in stadium I–II rectale kanker; deze omvatten ras, geslacht, tumorlocatie, leeftijd bij diagnose, tumorgraad, T Stadium, en serum cea niveau, terwijl het risico tussen T2,C0 en T1,C0 niet statistisch verschil was (P = 0,925). Er werd aangetoond dat, in de context van serum cea-verhoging, het T1-Stadium onverwacht een hoger risico op rectaal-kanker-specifieke mortaliteit vertoonde in vergelijking met de stadia T2 en T3. In stadium T1 werd een verhoogd serum-CEA geassocieerd met een verhoogd risico op mortaliteit van 227,6% in vergelijking met een normaal serum-cea.

Tabel 2. Multivariate Cox regressieanalyses van cause-specific survival (CSS) in stadium I–II rectale kanker.
Kaplan-Meier-overlevingscurven zijn uitgezet in figuren 2 en 3. Het 5-jarige CSS-percentage was 92,2% in T1C0, 75,2% in T1C1, 93,1% in T2C0, 86,7% in T2C1, 84,6% in T3C0, 76,3% in T3C1, 62,9% in T4C0 en 43,6% in t4c1 (Figuur 2, P < 0,001). Daarom vertoonde T1C1 een vergelijkbaar 5-jaars CSS-percentage in vergelijking met T3C1 (75,2 vs.76,3%, P = 0,238). Bovendien was de bevinding nog meer uitgesproken in OS. Het 5-jaars OS-percentage was 78,6% in T1C0, 48,3% in T1C1, 77,1% in T2C0, 62,3% in T2C1, 68,5% in T3C0, 54,5% in T3C1, 45,3% in T4C0 en 30,0% in t4c1 (Figuur 3, P < 0,001). T1c1 vertoonde een significant lager 5-jaars CSS-percentage vergeleken met T3C1 (48,3 vs. 54,5%, P < 0,001).
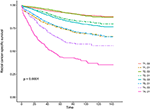
Figuur 2. Kaplan-Meier cause-specific survival (CSS) curven van het T-Stadium in combinatie met het serumcarcinoembryonisch antigeen (cea) niveau.
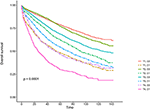
Figuur 3. Kaplan-Meier overall survival (OS) curven van het T-Stadium gecombineerd met het serumcarcinoembryonisch antigeen (cea) niveau.
Effect van preoperatieve Serum-Cea-verhoging in T-Stadium
de bosperceel werd getekend om de hazard ratio ‘ s (HRs) aan te tonen om CSS tussen normale en verhoogde cea – groepen in de respectieve t-stadia te vergelijken (Figuur 4). Vergeleken met een normaal niveau van serum CEA, in stadium T2, verhoogd gehalte van het serum CEA werd geassocieerd met 69.0% verhoogd risico van rectale kanker-specifieke sterfte ; in stadium T3, verhoogd gehalte van het serum CEA werd geassocieerd met 67.2% verhoogd risico van rectale kanker-specifieke sterfte (HR = 1.672, 95% CI = 1.486–1.882, P < 0.001); in stadium T4, verhoogd gehalte van het serum CEA werd geassocieerd met 81.3% verhoogd risico van rectale kanker-specifieke sterfte (HR = 1.813, 95% CI = 1.485–2.213, P < 0.001); daarentegen, echter, in stadium T1, verhoogd gehalte van het serum CEA gepresenteerd, zelfs tot 211.6% verhoogd risico op rectale kanker-specifieke mortaliteit (HR = 3,116, 95% BI = 2,639-3,679, P < 0,001).
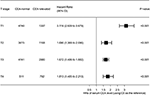
Figuur 4. Hazard ratio ‘ s (HRs) van cause-specific survival (CSS) tussen normaal en verhoogd serumcarcinoembryonisch antigeen (cea) volgens het T-Stadium.
discussie
we wilden het verband onderzoeken tussen T-Stadium en serum-cea-spiegels bij het bepalen van CSS bij rectale kanker. We veronderstelden dat rectale kanker met zeer vroeg T-Stadium (Stadium T1) en serum cea-verhoging een biologisch surrogaat voor agressieve ziekte kan zijn, waardoor een slechte oncologische uitkomst wordt voorspeld. Met ~ 20.000 patiënten gediagnosticeerd met stadium I-II rectale kanker opgenomen in onze studie.
in deze studie werd vastgesteld dat de cea-verhoging in serum waarschijnlijker correleerde met hoger T-Stadium, zwart, rectosigmoïd junction, hogere leeftijd en hogergradig en mucineus adenocarcinoom/Zegelringcelcarcinoom. Kaplan-Meier-overlevingsanalyses toonden aan dat, in de context van serumcea-verhoging, het 5-jaars CSS-percentage van stadium T1 75,2% was, wat geen statistisch verschil opleverde ten opzichte van stadium T3 (76,3%). Wat betreft totale overleving was het 5-jaars OS-percentage van stadium T1 met preoperatieve serum-cea-verhoging (48,3%) zelfs lager dan Stadium T3 betrokken bij cea-verhoging (54,5%) en bereikte geen statistisch verschil met stadium T4 (45.3%), wat betekent dat een verhoogd preoperatief serumniveau van CEA een subgroep van rectale kanker van stadium T1 met gelijkaardige CSS met één of andere Stadium T3 ziekten en met gelijkaardig OS met één of andere Stadium T4 ziekten zou kunnen identificeren.
na correctie voor bekende prognostische factoren voor rectale kanker (ras, geslacht, tumorlocatie, leeftijd bij diagnose, jaar van diagnose, graad en histologie), bleek de door ons gedefinieerde interactievariabele (T-Stadium en serum-cea-niveau) een onafhankelijke prognostische factor voor rectale kanker te zijn. Multivariate Cox-analyse toonde aan dat, in de context van serum cea-verhoging, het T1-Stadium onverwacht een hoger risico op rectaal-kanker-specifieke mortaliteit vertoonde in vergelijking met stadia T2 en T3. In stadium T1 werd een verhoogd serum-CEA geassocieerd met een verhoogd risico op mortaliteit van 227,6% in vergelijking met een normaal serum-cea. Bovendien werden ras, geslacht, tumorlocatie, leeftijd bij diagnose, en tumorrang ook geà dentificeerd als onafhankelijke prognostische factoren van stadium I–II rectale kanker. Afgezien van T1, werd gevonden dat de preoperatieve verhoging van serum CEA ~75% hogere risico ‘ s van rectaal-kanker-specifieke mortaliteit in respectieve Stadium t voorstelde, maar het aantal sterk steeg tot 211,6% in stadium T1.
in 2000 stelde de colorectale werkgroep van het AJCC voor om het serumgehalte van CEA (C-Stadium) op te nemen in het conventionele AJCC TNM-stadiëringssysteem voor colorectale kanker (18). Bovendien hebben de American Society of Clinical Oncology en de European Group on tumormarkers beide de inclusie van preoperatieve serum CEA-niveau als prognostisch hulpmiddel bij colorectale kanker (19-21) ondersteund.
verschillende eerdere onderzoeken meldden de serum – cea-spiegel als een sterke prognostische rol bij darmkanker (4-7, 22-26). In 2011, Thirunavukarasu et al. (25) gemeld dat preoperatieve serum CEA niveau was een onafhankelijke prognostische biomarker van colonkanker, en prognose was slechter bij hoge cea patiënten met een lager Stadium in vergelijking met lage cea patiënten met een hoger stadium. In die studie, werd hoge CEA zelfs geacht zo sterk als knooppositiviteit voor het voorspellen van slechte oncologische uitkomsten van darmkanker.
toch richten weinig studies zich op het ophelderen van de prognostische rol van serum CEA-spiegel bij rectale kanker. In 2016, ook met behulp van de SEER database, Tarantino et al. (9, 27) voerden de twee grote op de populatie gebaseerde onderzoeken uit, die overtuigend bewijs leverden dat een verhoogd preoperatief SERUMCEA een sterke voorspeller was voor een slechtere algehele en kankerspecifieke overleving bij rectale kanker. In 2018, Liu et al. (8) aangetoond dat preoperatieve serum CEA is een onafhankelijke prognostische factor van rectale kanker, en verhoogde serum CEA niveau gepresenteerd duidelijk slechtere overleving in vergelijking met een normale serum CEA niveau in fasen I–IV. Echter, de enige twee vorige studies gericht op het onderzoeken van de voorspellende rol van preoperatieve serum CEA niveau niet onderzocht de vereniging van CEA niveau en T podium in het voorspellen van de tumor uitkomsten van rectale kanker.
hoewel uit de conventionele studies blijkt dat kanker het gemetastaseerde potentieel stap voor stap verwerft naarmate ze groter worden (28), gaven enkele eerdere studies echter aan dat het verwerven van het gemetastaseerde potentieel zeer vroeg in tumorprogressie zou kunnen optreden. Een eerder onderzoek toonde de extreem slechte overleving van zeer kleine tumorgrootte wanneer betrokken bij lymfeknoop positiviteit (17). Bovendien tonen de bevindingen van ons onderzoek aan dat verhoging van preoperatieve serum CEA niveau in zeer vroeg stadium (stadium T1) rectale kanker wordt geassocieerd met zeer slechte OS en CSS en kan een surrogaat van agressieve biologie zijn. Wij geloven dat zowel lymfeklieren betrokkenheid en serum cea verhoging worden beschouwd als de verwerving van metastatische vermogen. Onze studie, gecombineerd met die van Wo et al. steun consequent het bovengenoemde idee dat de aanwinst van metastatische potentieel zeer vroeg in tumorprogressie zou kunnen voorkomen, zo geassocieerd met slechte oncologic resultaten, en de aanvankelijke biologische eigenschap waarschijnlijker het potentieel van verre metastase tijdens kankerprogressie, eerder dan de geaccumuleerde metastatische capaciteit (29) bepalen.
Bovendien zijn de bevindingen van onze studie van klinisch belang. Momenteel wordt stadium I rectale kanker behandeld met radicale chirurgische resectie alleen vanwege relatief gunstige oncologische resultaten. Echter, ongeveer 10-15% van de patiënten zal tumor recidief ontwikkelen na radicale resectie (30, 31). In de huidige studie identificeren we toevallig een subgroep van stadium T1 rectale kanker met zeer slechte prognose vergeleken met de rest van stadium I rectale kanker, wat betekent dat die stadium T1 rectale kanker met betrokkenheid van preoperatieve serum cea verhoging meer aandacht van oncologen zou moeten vangen.
er zijn echter twee beperkingen in onze studie. Aan de ene kant werd in deze studie geen rekening gehouden met enkele bekende prognostische factoren van rectale kanker in onze analyses, waaronder de instabiele status van microsatelliet en postoperatieve complicaties, die niet beschikbaar waren in de Seer-database en tot op zekere hoogte vooroordelen zouden kunnen introduceren. We kunnen bereiken en gemiddelde waarden van CEA in beide groepen niet opgeven. Aan de andere kant was de huidige studie eerder retrospectief dan gebaseerd op prospectieve gegevens. Daarom moeten onze bevindingen nog steeds worden gevalideerd in andere cohorten, vooral in grote prospectieve klinische studies.Concluderend toont onze studie aan dat stadium T1 rectale kanker, wanneer betrokken bij preoperatieve serum cea verhoging, een surrogaat kan zijn van biologisch agressieve ziekte en correleert met ongunstige OS en CSS. Bovendien verdient deze subgroep rectale kanker meer klinische aandacht van oncologen. Onze bevindingen, indien gevalideerd in toekomstige databasestudies, zouden een nieuw therapieidee bieden voor rectale kanker in een vroeg stadium.
Gegevensbeschikbaarheidsverklaring
de voor deze studie gegenereerde datasets zijn op verzoek beschikbaar voor de overeenkomstige auteur.
ethische verklaring
patiënten in deze studie werden geïdentificeerd uit de Seer-database, en de goedkeuring voor het gebruik van de gegevens werd verkregen door middel van een verzoek ingediend bij het Seer-programma. De goedkeuring door de institutionele toetsingsraad was niet nodig omdat de SEER-databank openbaar beschikbaar is.
Auteursbijdragen
SW en WG hebben een aanzienlijke en directe bijdrage aan deze studie geleverd en goedgekeurd voor indiening.
belangenconflict
de auteurs verklaren dat het onderzoek werd uitgevoerd zonder enige commerciële of financiële relatie die als een potentieel belangenconflict zou kunnen worden opgevat.
Dankbetuigingen
dit werk werd gedeeltelijk ondersteund door het project van het Medical Science and Technology Development Plan van Yancheng (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
PubMed Abstract / CrossRef Full Text / Google Scholar
2. Gold P, Freedman SO. Demonstratie van tumor-specifieke antigenen in menselijke coloncarcinomata door immunologische tolerantie en absorptietechnieken. J Exp Med. (1965) 121:439–62. doi: 10.1084 / jem.121.3.439
PubMed Abstract / CrossRef Full Text / Google Scholar
3. Goldstein MJ, Mitchell EP. Carcinoembryonisch antigeen in de stadiëring en follow-up van patiënten met colorectale kanker. Kanker Investeren. (2005) 23:338–51. doi: 10.1081 / CNV-58878
PubMed Abstract / CrossRef Full Text / Google Scholar
4. Becerra AZ, Probst CP, Tejani MA, Aquina CT, González MG, Hensley BJ, et al. Evaluatie van de prognostische rol van verhoogde preoperatieve carcinoembryonische antigeenspiegels bij patiënten met colonkanker: resultaten uit de nationale kankerdatabase. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245 / s10434-015-5014-1
PubMed Abstract / CrossRef Full Text / Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori s, Ushijima M, et al. Een verhoogde preoperatieve serumcarcinoembrionische antigeenspiegel kan een effectieve indicator zijn voor de noodzaak van adjuvante chemotherapie na mogelijk curatieve resectie van stadium II colonkanker. J Surg Oncol. (2010) 99:65–70. doi: 10.1002 / jso.21161
PubMed Abstract / CrossRef Full Text / Google Scholar
6. Quah HM, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, et al. Identificatie van patiënten met hoog risico stadium II colonkanker voor adjuvante therapie. Dis Colon Rectum. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-Z
PubMed Abstract / CrossRef Full Text / Google Scholar
7. Spindler BA, Bergquist JR, Thiels CA, Habermann EB, Kelley SR, Larson DW, et al. Incorporatie van CEA verbetert risico stratificatie in stadium II darmkanker. J Gastrointest Sur. (2017) 21:770-7. doi: 10.1007 / s11605-017-3391-4
PubMed Abstract / CrossRef Full Text / Google Scholar
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Combinatie van carcinoembryonisch antigeen met het American Joint Committee on Cancer TNM staging system in rectale kanker: een real-world en grote populatie-gebaseerde studie. Onco Richt Zich Daar Op. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Abstract / CrossRef Full Text / Google Scholar
9. Tarantino I, Warschkow R, Schmied BM, Güller U, Mieth M, Cerny T, et al. Voorspellende waarde van CEA voor overleving in Fase I rectale kanker: een populatie-gebaseerde neiging score-matched analyse. J Gastrointest Sur. (2016) 20:1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Oncogene. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
PubMed Abstract / CrossRef Full Text / Google Scholar
12. Cai Z, Xiao J, He X, Ke J, Zou Y, Chen Y, et al. Toegang tot nieuwe prognostische significantie van preoperatief carcinoembryonisch antigeen in colorectale kanker die tumorresectie ontvangen: meer dan positief en negatief. Kanker Biomark. (2017) 19:161–8. doi: 10.3233 / CBM-160287
PubMed Abstract / CrossRef Full Text / Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, Fürstenberger G, Richter R, et al. Het proces van metastasering voor borstkanker. EUR J Kanker. (2003) 39:1794–806. doi: 10.1016/S0959-8049(03)00422-2
PubMed Abstract / CrossRef Full Text / Google Scholar
14. Hüsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, et al. Systemische verspreiding is een vroege stap in borstkanker. kankercel. (2008) 13:58–68. doi: 10.1016 / j.ccr.2007.12.003
PubMed Abstract / CrossRef Full Text / Google Scholar
15. Podsypanina K, Du YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus H. Zaaien en vermeerderen van niet-getransformeerde muiscellen in de longen. Wetenschap. (2008) 321:1841–4. doi: 10.1126 / wetenschap.1161621
PubMed Abstract / CrossRef Full Text / Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr a, Blankenstein TJ, et al. Van latente gedissemineerde cellen tot openlijke metastase: genetische analyse van systemische progressie van borstkanker. Proc Natl Acad Sci USA. (2003) 100:7737–42. doi: 10.1073 / pnas.1331931100
PubMed Abstract / CrossRef Full Text / Google Scholar
17. Wo JY, Chen K, Neville BA, Lin NU, Punglia RS. Effect van zeer kleine tumorgrootte op kankerspecifieke mortaliteit bij klierpositieve borstkanker. J Clin Oncol. (2012) 23:32–3. doi: 10.1016 / j.breastdis.2012.01.026
CrossRef Full Text / Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. American joint committee on cancer prognostic factors consensusconferentie: colorectal working group. Kanker. (2015) 88:1739–57. doi: 10.1002/(SICI)1097-0142(20000401)88:7<1739::steun-CNCR30>3.0.CO;2-T
PubMed Abstract / CrossRef Full Text / Google Scholar
19. Duffy MJ, Van Dalen A, Haglund C, Hansson L, Holinski-Feder e, Klapdor R, et al. Tumormarkers bij colorectaal kanker: richtlijnen voor klinisch gebruik van European Group on tumormarkers (EGTM). EUR J Kanker. (2007) 43:1348–60. doi: 10.1016 / j. ejca.2007.03.021
PubMed Abstract / CrossRef Full Text / Google Scholar
20. Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS, et al. ASCO 2006 update van aanbevelingen voor het gebruik van tumormarkers bij gastro-intestinale kanker. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
PubMed Abstract / CrossRef Full Text / Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini A, Kalousová M, Holubec L, et al. Tumormarkers bij colorectale kanker, maagkanker en gastro-intestinale stromale kanker: Europese groep op tumormarkers 2014 richtlijnen update. Int J Kanker. (2014) 134:2513–22. doi: 10.1002 / ijc.28384
PubMed Abstract / CrossRef Full Text / Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. Preoperatief carcinoembryonisch antigeen voorspelt resultaten bij kliernegatieve colonkankerpatiënten: een multivariate analyse van 572 patiënten. J Am Coll Sur. (1997) 185:55-9. doi: 10.1016/S1072-7515(97)00012-4
PubMed Abstract / CrossRef Full Text / Google Scholar
23. JW, OH BR, Kim HR, Kim YJ. Preoperatief carcinoembryonisch antigeen niveau als een onafhankelijke prognostische factor in potentieel curatieve darmkanker. J Surg Oncol. (2010) 101:396–400. doi: 10.1002 / jso.21495
PubMed Abstract / CrossRef Full Text / Google Scholar
24. Ozawa H, Kotake K, Hosaka M, Hirata A, Nakagawa Y, Fujita S, et al. Incorporatie van serumcarcinoembryonische antigeenspiegels in het prognostische groeperingssysteem van darmkanker. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007/s00384-017-2772-1
PubMed Abstract / CrossRef Full Text / Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, et al. C-Stadium in darmkanker: implicaties van carcinoembryonic antigeen biomarker in het opvoeren, prognose, en beheer. J Natl Cancer Inst. (2011) 103:689–97. doi: 10.1093/jnci / djr078
PubMed Abstract / CrossRef Full Text / Google Scholar
26. Margalit O, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern N, et al. Beoordeling van de prognostische waarde van carcinoembryonische antigeenspiegels in stadium I en II colonkanker. EUR J Kanker. (2018) 94:1–5. doi: 10.1016 / j. ejca.2018.01.112
PubMed Abstract / CrossRef Full Text / Google Scholar
27. Tarantino I, Warschkow R, Worni M, Merati-Kashani K, Köberle D, Schmied BM, et al. Verhoogde preoperatieve CEA wordt geassocieerd met een slechtere overleving bij patiënten met stadium I-III rectale kanker. Br J Kanker. (2012) 107:266. doi: 10.1038 / bjc.2012.267
PubMed Abstract / CrossRef Full Text / Google Scholar
28. Norton L, Massague J. is kanker een ziekte van zelf zaaien? Nat Med. (2006) 12:875–8. doi: 10.1038 / Nm0806-875
PubMed Abstract | CrossRef Full Text / Google Scholar
29. Yu KD, Jiang YZ, Chen S, Cao ZG, Wu J, Shen ZZ, et al. Effect van grote tumorgrootte op kankerspecifieke mortaliteit bij knooppuntnegatieve borstkanker. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / j.mayocp.2012.07.023
PubMed Abstract / CrossRef Full Text / Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD, et al. Stadium I rectale kanker: identificatie van patiënten met een hoog risico. J Am Coll Sur. (1998) 186: 574-9; discussie: 579-80. doi: 10.1016/S1072-7515(98)00018-0
PubMed Abstract / CrossRef Full Text / Google Scholar
31. Gunderson LL, Sargent DJ, Tepper je, Wolmark N, O ‘ Connell MJ, Begovic M, et al. Impact van het T-en N-stadium en de behandeling op overleving en terugval bij adjuvante rectale kanker: een gepoolde analyse. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
PubMed Abstract / CrossRef Full Text / Google Scholar