prognostische waarde van tumorgrootte in stadium II en III colorectale kanker in Tunesische populatie
-
tumorgrootte (TuS) werd prognostisch gerapporteerd bij colorectale kanker.
-
in onze studie bestudeerden we de prognostische rol van Tu ‘ s en identificeerden we een cutoff waarde met de hoogste voorspellingsprestaties.
-
een grootte van 4 cm had een prognostische impact en interfereerde met andere prognostische factoren.
-
We merkten op dat leeftijd ≥65 jaar, stadium III, veneuze invasie en pN+ groter dan 3 significante slechte prognostische factoren waren bij patiënten met TuS ≥4, maar alleen stadium III was een onafhankelijke prognostische factor in multivariate analyse.
-
toediening van chemotherapie was de enige factor met een significante invloed op de overleving in univariate en multivariate analyses bij patiënten met TuS minder dan 4 cm.
colorectale kanker (CRC) is de derde meest voorkomende kanker wereldwijd en de tweede meest voorkomende oorzaak van kankergerelateerde dood in westerse landen . In Tunesië is dit een probleem voor de volksgezondheid. De incidentie nam toe in de laatste 15 jaar . Ondanks de verbetering van diagnostische en werkprocedures en ook door het gebrek aan screeningsprogramma ‘ s, blijven de meeste CRC–gevallen in Tunesië gedetecteerd in een lokaal gevorderd (pt3-T4, knooppuntpositief) of metastatisch Stadium . De prognose is de laatste jaren verbeterd, met multidisciplinair management; Overall survival (OS) van 5 jaar wordt geschat op ongeveer 70% in stadium II en 50% in stadium III . Er zijn veel inspanningen geleverd om de risicobeoordelingsfactoren in CRC te verfijnen om patiënten te identificeren die het meest waarschijnlijk baat hebben bij adjuvante therapie. Deze factoren zijn voornamelijk klinisch, pathologisch en recent moleculair (microsatelliet instabiliteit/microsatelliet stabiliteit, cDNA), sommige van hen zijn nog steeds buiten bereik in veel landen. Tumorgrootte (TuS) is een surrogaatmarker van overleving in veel gastro-intestinale kanker: maagkanker, gastro-intestinale stromale tumor, carcinoïde tumoren . De relevantie ervan in CRC is onduidelijk, met tegenstrijdige resultaten in verschillende gerapporteerde reeksen . TuS integreerde de internationale richtlijnen niet als een van de markers waarmee rekening moet worden gehouden bij het beoordelen van het risico en het aangeven van adjuvante chemotherapie . In een recente studie met pathologische beoordeling van 1443 nieuwe gevallen van CRC in het centrale gebied van Tunesië, 67,5% van de patiënten had een TuS groter dan 5 cm, Deze bevinding is volledig anders dan gevallen in westerse landen . In onze huidige studie wilden we de prestaties van TuS in het voorspellen van overleving in Fase II en III CRC bestuderen en de relatie tussen TuS en bekende prognostische factoren onderzoeken.
patiënten& methoden
we hebben retrospectief een cohort onderzocht van 257 patiënten met de diagnose colon en / of rectaal adenocarcinoom, behandeld in twee oncologische centra: Abderrahmen Mami Hospital en Clinique Taoufik Hospital tussen 2003 en 2014. Volgens de 7e editie van het American Joint Committee on Cancer (AJCC)/Union Internationale Contre le Cancer (UICC) hebben we fase II–III-gevallen opgenomen, behandeld met curatieve Intentie. We hebben alleen rekening gehouden met patiënten met volledige workup en beschikbare pathologische gegevens, waaronder TuS en follow-up gegevens. In de studieperiode werd de follow-up geprogrammeerd na voltooiing van de curatieve therapie, elke 3-4 maanden in de eerste 2 jaar, elke 6 maanden van jaar 3 tot en met 5 en daarna jaarlijks. Bij elk bezoek werden de patiënten lichamelijk onderzocht en gecontroleerd op symptomen en therapietoxiciteiten. Abdominale echografie en thorax x-ray werden uitgevoerd om de 6 maanden, vanaf 2012 thoracoabdominale CT–scan en tumormarkers (carcinoembryonisch antigeen, CA19-9) om de 6 maanden werden gedaan.
TuS werd gedefinieerd als de horizontale tumoruitbreiding gemeten aan de hand van de maximale tumordiameter. We gebruikten receiver-operating characteristic (ROC) om TuS prestaties te bepalen bij het voorspellen van overleving en om een cutoff waarde gecorreleerd aan overleving te identificeren. We hebben ook de kenmerken van de twee groepen vergeleken met de cutoff-waarde, en de prognostische factoren onderzocht in univariate en multivariate analyses in elke groep.
statistische analyse
alle analyses werden uitgevoerd met behulp van SPSS 20-software. We analyseerden ROC-curven en analyseerden het gebied onder de curve (AUC) om de nauwkeurigheid van TuS in het voorspellen van overleving te bepalen. Een AUC van 1,0 was foutloze voorspelling van kanker bij patiënten, terwijl een AUC van 0,50 een halve waarschijnlijkheid van een nauwkeurige voorspelling van de kankerstatus vertegenwoordigt. Hoe hoger de AUC-ROC, hoe groter de discriminerende kracht van de TU ‘ s voor de uitkomst. OS werd gedefinieerd als de tijd vanaf de datum van de diagnose tot de dood door een oorzaak of verlies aan follow-up of het laatste nieuws. OS werd geëvalueerd volgens de Kaplan-Meier-methode. Prognostische factoren werden beoordeeld door middel van een univariate analyse met behulp van de log-rank test en met een multivariate analyse met behulp van een Cox proportional hazards model. Een p-waarde lager dan 0,05 werd statistisch significant geacht.
resultaten
voor de totale bevolking was de gemiddelde leeftijd 59 jaar (spreiding 25-85 jaar), 57 jaar.2% was Mannelijk. We hebben een stadium III ziekte waargenomen bij 53% van de patiënten onder hen was 37,5% PN2. Adjuvante chemotherapie werd gegeven aan alle patiënten met stadium III ziekte (97,7% met oxaliplatine). In stadium II ziekte 53% van de gevallen kreeg chemotherapie, ze waren pT4 Stadium in 22,5%, minder dan 12 verwijderd lymfeklieren in 28% en onderging een spoedoperatie in 15% van de gevallen. De gemiddelde TuS was 7 cm .
in de ROC-analyse werd de AUC van TuS bij het voorspellen van overleving getoond in Figuur 1. TuS prestaties bij het voorspellen van overleving werd vergeleken met de prestaties aan het aantal betrokken lymfeklieren. De AUC was 0.62 ± 0,048 voor TuS en 0,60 ± 0,56 voor positieve lymfeklieren.

een grootte van 4 cm werd geïdentificeerd als een voorspeller van overleving met een gevoeligheid van 88,2% en een specificiteit van 59,2%. We observeerden 98 patiënten met TuS ≤4 cm en 159 patiënten met TuS groter dan 4 cm. Patiënten met TuS groter dan 4 cm hadden een grotere kans op kanker in het colon (81,1 vs 70,4%, p = 0,002) en vaak pT4 (44 vs 22.4%, p = 0,0001). We hebben geen significant verschil gezien naar geslacht, spoedoperatie, minder dan 12 verwijderde lymfeklieren, aantal positieve lymfeklieren, Stadium-en oxaliplatinetoediening tussen patiënten TuS ≤4 cm en patiënten met TuS groter dan 4 cm (Tabel 1).
| Variabelen | Tumor grootte ≤4 cm, % (n = 89) | Tumor grootte > 4 cm, % (n = 159) | p-waarde |
|---|---|---|---|
| Leeftijd: | |||
| – de Mediaan (gemiddelde) leeftijd – <65 jaar – ≥65 jaar |
56 73.4 (72) 22.6 (26) |
62.8 (100) 38.2 (59) |
0.32 0.07 |
| Geslacht: | |||
| – Man – Vrouwelijke |
50 (49) 50 (49) |
57.2 (91) 43.8 (68) |
0.25 |
| BMI†: | |||
| – <30 – ≥30 |
91.3 (63) 8.7 (6) |
85.8 (85) 14.2 (14) |
0.28 |
| Locatie: | |||
| – Dubbele Punt – Rectum |
70.4 (69) 29.6 (29) |
81.1 (129) 8.9 (30) |
0.002* |
| Chirurgische noodhulp: | |||
| – Ja – Geen |
(14) (84) |
11.3 (18) 88.7 (141) |
0.52 |
| <12 lymfeklieren onderzocht§: | |||
| – Ja – Geen |
34.6 (34) 65.4 (64) |
44.6 (71) 55.3 (88) |
0.11 |
| pN+: | |||
| – 1–3 – >3 |
83.6 (82) 16.4 (16) |
77.9 (124) 22.1 (35) |
0.26 |
| pT: | |||
| pT1–pT3 pT4 |
77.6 (76) 22.4 (22) |
55.9 (89) 44.1 (70) |
<0.01* |
| Stage: | |||
| – Stage II – Stage III |
47.9 (47) 52.1 (51) |
47.1 (75) 42.9 (84) |
0.9 |
| Adjuvant therapy: | |||
| – Yes – No |
76.6 (75) 23.4 (23) |
79.2 (126) 20.8 (33) |
0.6 |
| Oxaliplatine: | 0.48 | ||
| – Yes – No |
48.9 (48) 51.1 (50) |
53.4 (85) 46.6 (74) |
|
| Relapse rate (%) | 35.2 | 37.1 | 0.75 |
| TTR‡ (maanden) | 26 | 34 | 0.13 |
†alleen beschikbaar bij 168 patiënten.
‡tijd om terug te vallen.
§in beide fasen II en III.
*significante p-waarden.
gereproduceerd met toestemming van © Oxford University Press (2017).
OS was significant beter in TuS ≤4 cm vergeleken met TuS groter dan 4 cm, gemiddelde overleving was 158 versus 106 maanden, hazard ratio = 2.92 (95% BI: 1,27–6,75, p = 0,01). 5-jaars overleving van patiënten was 84% bij patiënten met TuS ≤4 cm en 76% bij patiënten met TuS groter dan 4 cm (p = 0,008; zie Figuur 2).
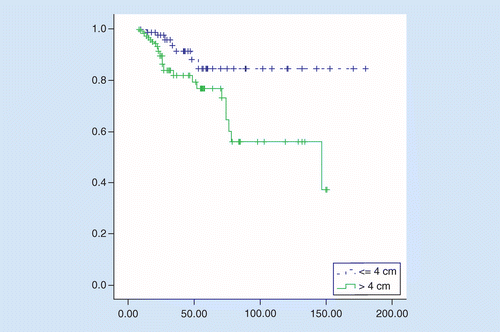
prognostische factoren werden in beide groepen onderzocht. In univariate analyse, zagen we een significante slechte invloed van leeftijd ≥65 jaar, stadium III, veneuze invasie en pN+ groter dan 3 op de overleving bij patiënten met TuS groter dan 4 cm. Alleen in multivariate analyse was stadium III een onafhankelijke prognostische factor. Bij patiënten met TuS ≤4 cm was chemotherapie in de adjuvante setting de belangrijkste factoren met een significante invloed op de overleving in univariate en multivariate analyses, er was geen prognostisch effect van de andere geteste factoren (Tabel 2).
| Variabelen | Tumor grootte < 4 cm (n = 159) | Tumor omvang ≥4 cm (n = 89) | ||
|---|---|---|---|---|
| 5-jaar OS (%) | HR (95% CI) | 5 jaar OS (%) | HR (95% CI) | |
| Leeftijd: | ||||
| – <65 jaar – ≥65 jaar |
87 78 |
1.07 (0.208−5.531) | 82 60 |
2.47 (1.35–5.88)* |
| pN+: | ||||
| – 1-3 – >3 |
78 82 |
2.14 (0.41–11.08) | 79 65 |
2.838 (1.25–6.41)* |
| pT: | ||||
| – pT1–pT3 – pT4 |
84 82 |
1.51 (0.29–7.79) | 84 74 |
1.44 (0.67–3.09) |
| Venous invasion: | ||||
| – Yes – No |
80 81 |
0.97 (0.189–5.08) | 63 84 |
2.94 (1.14–7.78)* |
| Stage: | ||||
| – Stage II – Stage III |
77 86 |
0.651 (0.148–2.955) | 85 58 |
0.285 (0.123–0.66)* |
| Adjuvant therapy: | ||||
| – Yes – No |
94 58 |
0.135 (0.025–0.696)* | 78 67 |
0.641 (0.257–1.6) |
| Oxaliplatine: | ||||
| – Yes – No |
92 83 |
0.28 (0.034–2.39) | 78 70 |
0.441 (0.19–1.02) |
| Tumor location: | ||||
| – Colon – Rectum |
90 75 |
0.428 (0.095-1.931) | 75 80 |
2.699 (0.806–9.03) |
*belangrijke HR-waarden.
HR: Hazard ratio; OS: totale overleving.
discussie
in westerse landen leidde de integratie van occulte screeningprogramma ‘ s tot de diagnose van CRC in eerdere stadia . In een recente op SEER gebaseerde studie tussen 2006 en 2012 werd 38% van de gevallen van darmkanker en 43% van de gevallen van rectumkanker in een vroeg stadium gediagnosticeerd . In landen met lage middeninkomens is een dergelijk screeningsprogramma niet beschikbaar; en de meeste gevallen worden gediagnosticeerd in een regionaal of gevorderd stadium met hoge TuS . De identificatie van prognostische factoren is een belangrijk instrument om de resultaten in dergelijke landen te verbeteren. Onze studie onderzocht de prognostische rol van TS in Fase II en III CRC in Tunesische bevolking. We merkten op dat TuS niet alleen een impact had op de overleving, maar ook interfereerde met andere prognostische factoren. Stadium III was een onafhankelijke prognostische factor in tumors met een hoog volume, terwijl veel’ klassieke ‘ prognostische factoren geen invloed hadden op kleinere tumoren. Verschillende studies meldden de prognostische waarde van TuS met verminderde overleving-geassocieerde verhoogde TuS . In een studie van Kornprat et al. TuS was significant geassocieerd met progressievrije en kankerspecifieke overleving in univariate en multivariate analyses in colon, maar niet in rectumkanker . In onze serie kwam een hogere TuS vaker voor bij darmkanker. In feite, kan darmkanker asymptomatisch voor een langere tijd blijven, wat een hogere TuS bij diagnose in vergelijking met rectale kanker verklaart. Er was echter geen verschil in overleving tussen tumoren ≥4 cm in het colon en tumoren ≥4 cm in het rectum. Er was ook geen invloed van de locatie van de tumor in kleinere tumor (<4 cm). Dus op basis van deze analyse, TuS had geen rol in het voorspellen van prognose op basis van tumor locatie (colon vs rectum). Saha et al. gemeld in hun grote reeks van patiënten dat TuS positief gecorreleerd met belangrijke prognostische factoren en negatief beïnvloed overleving bij darmkanker . Zijn rol bij rectumkanker is nog steeds niet duidelijk.
hogere TuS werd ook geassocieerd met het pt4–Stadium, waarvan werd gemeld dat het de slechtste prognose had dan het T1-2N1-Stadium (Intergroepsonderzoek int-0089) . De tumorlast kan het vermogen van een tumor weerspiegelen om door de darmwand, knooppunten en andere organen te verspreiden. In feite, in onze studie, TuS had een voorspellende ROC analyse waarde dicht bij de voorspellende waarde van het aantal positieve lymfe. Bij tumoren van minder dan 4 cm zagen we geen verschil in overleving tussen patiënten in stadium II en III. Deze bevinding kan worden verklaard door het feit dat onze Fase II populatie was een hoog risico populatie met slechtere prognose (dicht bij stadium III prognose): veel Stadium pT4, veel gevallen met minder dan 12 verwijderde lymfeklieren, veel gevallen opereerden in noodgevallen (voor perforatie en obstructie). In twee ziener data-based studies, kleinere tumoren hadden slechtere prognose die stadium II ziekte. De auteurs veronderstelden dat kleine TuS een surrogaatmarker voor biologische agressiviteit kan zijn resulterend in inferieure uitkomst vergeleken met relatief grotere TuS onder stadium II . Dezelfde waarnemingen werden gezien in een Italiaanse studie . We onderzochten ook de rol van verschillende prognostische factoren volgens TuS. We merkten op dat verschillende prognostische factoren zoals leeftijd, stadium, aantal betrokken lymfeklieren, tumorlocatie geen significante invloed hadden in de groep patiënten met lage TuS. In onze studie, adjuvante chemotherapie had positieve invloed op kleine tumoren, moet TuS worden beschouwd als een ‘hoog risico’ factor in Fase II? Verdere studies over dit specifieke onderwerp zijn nodig.
verschillende valkuilen kunnen worden opgemerkt in onze reeks: de kleine steekproefomvang, de retrospectieve verzameling van gegevens en het ontbreken van een centrale beoordeling van pathologisch rapport voor een nauwkeurige TS-evaluatie. We hadden niet genoeg beschikbare gegevens over de exacte locatie van de tumor, dus we konden een dergelijke analyse niet uitvoeren. Moleculair testen werd in 2015 geïntroduceerd in Tunesië, in onze studieperiode was het niet beschikbaar. Evaluatie van de TuS volgens Stadium en oxaliplatine toediening werd niet gedaan, voor een te klein aantal patiënten om conclusies te trekken.
conclusie
TuS is een objectieve parameter die gemakkelijk kan worden gemeten tijdens pathologisch onderzoek. Het kan een bijkomende prognostische factor zijn in een populatie met een hoge mate van lokaal gevorderd stadium.
toekomstperspectieven
verschillende en complexe genetische aletraionen en / of pathways, zouden achter de TuS kunnen liggen bij colorectale kanker, moleculaire analyse, rekening houdend met de grootte van de tumor, zou kunnen leiden tot nauwkeuriger explantaties in de prognostische rol van de tumor.
financiële & openbaarmaking van concurrerende belangen
de auteurs hebben geen relevante banden of financiële betrokkenheid met een organisatie of entiteit met een financieel belang in of financieel conflict met het onderwerp of materiaal dat in het manuscript wordt besproken. Dit omvat werkgelegenheid, adviesbureaus, honoraria, aandelenbezit of opties, deskundige getuigenis, subsidies of octrooien ontvangen of hangende, of royalty ‘ s.
bij de productie van dit manuscript werd geen gebruik gemaakt van schrijfinstrumenten.
ethisch onderzoek
de auteurs verklaren dat zij voor alle experimentele onderzoeken bij mensen of dieren de juiste goedkeuring van de institutionele toetsingsraad hebben verkregen of de in de Verklaring van Helsinki uiteengezette beginselen hebben gevolgd. Bovendien is voor onderzoeken waarbij menselijke proefpersonen betrokken zijn, geïnformeerde toestemming verkregen van de betrokken deelnemers.
- 1 Torre LA, Bray F, Siegel RL et al. Global cancer statistics, 2012. CERTIFICERINGSINSTANTIE. Kanker J. Clin. 65(2), 87–108 (2015).Crossref, Medline, Google Scholar
- 2 Missaoui N, Jaidaine L, Abdelkader AB et al. Colorectale kanker in Centraal Tunesië: toenemende incidentie trends over een periode van 15 jaar. Aziatische Pac. J. Cancer Prev. 12(4), 1073–1076 (2011).Medline, Google Scholar
- 3 Missaoui N, Trabelsi A, Parkin DM et al. Trends in de incidentie van kanker in de regio Sousse, Tunesië, 1993-2006. Int. J. Kanker 127(11), 2669-2677 (2010).Crossref, Medline, CAS, Google Scholar
- 4 Yang J, Du XL, Li ST et al. Kenmerken van verschillend gelokaliseerde colorectale kankers ondersteunen de proximale en distale classificatie: een populatie-gebaseerde studie met 57.847 patiënten. PLoS ONE 11 (12), e0167540 (2016).Crossref, Medline, Google Scholar
- 5 Quan J, Zhang R, Liang H et al. De impact van tumorgrootte op overleving van patiënten met pt4an0m0 maagkanker. Is. Surger. 79(3), 328-331 (2013).Medline, Google Scholar
- 6 Zhai ZW, Gu J. Influence of tumor size on the prognosis in patients with colon cancer. Zhonghua Wei Chang Wai Ke Za Zhi. 15(5), 495–498 (2012).Medline, Google Scholar
- 7 Huang B, Feng Y, Zhu L et al. Kleinere tumorgrootte wordt geassocieerd met slechte overleving in stadium II darmkanker: een analyse van 7719 patiënten in de Seer database. Int. J. Surg. Lond. Engl. 33 (Pt A), 157-163 (2016).Crossref, Medline, Google Scholar
- 8 Crozier je, McMillan DC, McArdle CS et al. Tumorgrootte wordt geassocieerd met de systemische inflammatoire respons maar niet overleving bij patiënten met primaire operabele colorectale kanker. J. Gastroenterol. Hepatol. 22(12), 2288–2291 (2007).Crossref, Medline, Google Scholar
- 9 Labianca R, Nordlinger B, Beretta GD et al. Vroege darmkanker: ESMO klinische praktijk richtlijnen voor diagnose, behandeling en follow-up. Anne. Oncol. 24(Suppl. 6), VI64-VI72 (2013).Crossref, Medline, Google Scholar
- 10 Mandel JS, Church TR, Bond JH et al. Het effect van fecale occulte bloedonderzoek op de incidentie van colorectale kanker. N. Engl. J. Med. 343(22), 1603–1607 (2000).Crossref, Medline, CAS, Google Scholar
- 11 Siegel RL, Miller KD, Fedewa SA et al. Colorectale kankerstatistieken, 2017. CA Cancer J. Clin. 67(3), 177–193 (2017).Crossref, Medline, Google Scholar
- 12 Kornprat P, Pollheimer MJ, Lindtner RA, Schlemmer A, Rehak P, Langner C. Value of tumor size as a prognostic variable in colorectal cancer: a critical reapraisal. Is. J. Clin. Oncol. 34(1), 43–49 (2011).Crossref, Medline, Google Scholar
- 13 Saha s, Shaik M, Johnston G et al. Tumorgrootte voorspelt overleving op lange termijn bij darmkanker: een analyse van de nationale Kankerdatabase. Is. J. Surger. 209(3), 570-574 (2015).Crossref, Medline, Google Scholar
- 14 Le Voyer TE, Sigurdson ER, Hanlon al et al. De overleving van darmkanker wordt geassocieerd met toenemend aantal geanalyseerde lymfeklieren: een secundair onderzoek van Intergroeponderzoek Int-0089. J. Clin. Oncol. 21(15), 2912–2919 (2003).Crossref, Medline, CAS, Google Scholar
- 15 Wang Y, Zhuo C, Shi D et al. Ongunstig effect van kleine tumorgrootte op oorzaak – specifieke overleving in stadium IIA colonkanker, een SEER-gebaseerde studie. Int. J. Colorectal Dis. 30(1), 131–137 (2015).Crossref, Medline, Google Scholar
- 16 Santullo F, Biondi A, Cananzi FCM et al. Tumorgrootte als prognostische factor bij patiënten met stadium IIA colonkanker. Is. J. Surger. doi:10.1016/j.amjsurg.2017.03.038 (2017) (Epub ahead of print).Medline, Google Scholar
- 17 Mejri N, Dridi M, Labidi S et al. P-299 prognostic value of tumor size in stage II and III colorectal cancer in Tunisian population. Ann. Oncol. 28(Suppl. 3), mdx261.296 (2017).Google Scholar