Zuren, Basen en pH
|
|||||||||
ZUREN EN HUN GECONJUGEERDE BASEN
Vergeet niet de Bronsted–Lowry definitie van een zuur: een zuur is een proton donor. Duidelijk, in ons vorige voorbeeld geeft azijnzuur zijn proton aan H2O in de voorwaartse reactie, resulterend in de vorming van het acetaation. Nochtans, in de omgekeerde reactie, accepteert het acetaation een proton van H3O+ om aan CH3COOH terug te keren. Uit de Bronsted-Lowry definitie is een base een proton acceptor.
|
Dus, de acetaat-ion fungeert als een basis in de omgekeerde reactie, en is de geconjugeerde base van azijnzuur. Azijnzuur en het acetaation staan bekend als een zuur–base geconjugeerd paar. Interessant genoeg is er een tweede zuur–base geconjugeerd paar in de reactie hierboven. Merk op hoe in de omgekeerde reactie, H3O + doneert een proton (waardoor het een zuur), terwijl in de voorwaartse reactie, H2o accepteert een proton (waardoor het een base). H2O en H3O+ zijn een geconjugeerd zuur-base paar, met H3O + is het geconjugeerde zuur en H2O is de geconjugeerde base.
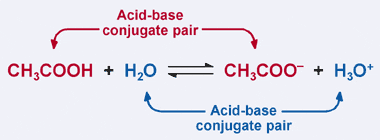
In een geconjugeerd zuur-base paar, het geconjugeerde zuur heeft een meer proton dan zijn overeenkomstige geconjugeerde base.