12.4: evaporare și condensare
evaporare
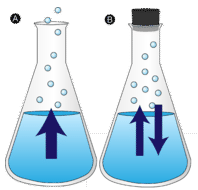
o baltă de apă lăsată netulburată dispare în cele din urmă. Moleculele lichide scapă în faza gazoasă, devenind vapori de apă. Vaporizarea este procesul în care un lichid este transformat într-un gaz. Evaporarea este conversia unui lichid în vaporii săi sub temperatura de fierbere a lichidului. Dacă apa este păstrată într-un recipient închis, moleculele de vapori de apă nu au șansa de a scăpa în împrejurimi și astfel nivelul apei nu se schimbă. Pe măsură ce unele molecule de apă devin vapori, un număr egal de molecule de vapori de apă se condensează înapoi în stare lichidă. Condensarea este schimbarea stării de la un gaz la un lichid.
pentru ca o moleculă lichidă să scape în starea gazoasă, molecula trebuie să aibă suficientă energie cinetică pentru a depăși forțele de atracție intermoleculare din lichid. Amintiți-vă că o probă lichidă dată va avea molecule cu o gamă largă de energii cinetice. Moleculele lichide care au acest anumit prag de energie cinetică scapă de suprafață și devin vapori. Ca urmare, moleculele lichide care rămân acum au o energie cinetică mai mică. Pe măsură ce se produce evaporarea, temperatura lichidului rămas scade. Ați observat efectele răcirii prin evaporare. Într-o zi fierbinte, moleculele de apă din transpirație absorb căldura corpului și se evaporă de pe suprafața pielii. Procesul de evaporare lasă răcitorul de transpirație rămas, care la rândul său absoarbe mai multă căldură din corp.
un lichid dat se va evapora mai repede când este încălzit. Acest lucru se datorează faptului că procesul de încălzire are ca rezultat o fracțiune mai mare din moleculele lichidului având energia cinetică necesară pentru a scăpa de suprafața lichidului. Figura de mai jos prezintă distribuția energiei cinetice a moleculelor lichide la două temperaturi. Numărul de molecule care au energia cinetică necesară pentru a se evapora este prezentat în zona umbrită de sub curba din dreapta. Lichidul cu temperatură mai mare \(\stânga (T_2 \dreapta)\) are mai multe molecule care sunt capabile să scape în faza de vapori decât lichidul cu temperatură mai mică \(\stânga (T_1 \dreapta)\).
la 29.029 picioare \(\stânga( 8848 \: \text{m} \dreapta)\), Muntele Everest în gama Himalaya la granița dintre China și Nepal este cel mai înalt punct de pe pământ. Altitudinea sa prezintă multe probleme practice alpiniștilor. Conținutul de oxigen al aerului este mult mai mic decât la nivelul mării, ceea ce face necesară aducerea rezervoarelor de oxigen (deși câțiva alpiniști au atins vârful fără oxigen). O altă problemă este cea a apei fierbinți pentru gătitul alimentelor. Deși apa fierbe la \(100 ^ \ text{O} \ text{C}\) la nivelul mării, punctul de fierbere de pe vârful muntelui Everest este doar despre \(70^\text{O} \text{c}\). Această diferență face foarte dificilă obținerea unei cești decente de ceai (ceea ce a frustrat cu siguranță unii dintre alpiniștii britanici).