17.3: formarea ionilor complecși
efectul formării ionilor complecși asupra solubilității
ce se întâmplă cu solubilitatea unei săruri puțin solubile dacă se adaugă la soluție un ligand care formează un ion complex stabil? Un astfel de exemplu apare în fotografia convențională alb-negru. Amintiți-vă că filmul fotografic alb-negru conține microcristale sensibile la lumină ale AgBr sau amestecuri de AgBr și alte halogenuri de argint. AgBr este o sare puțin solubilă, cu un Ksp de 5,35 la 10-13 la 25 la C. Când obturatorul camerei se deschide, lumina de la obiectul fotografiat lovește unele dintre cristalele de pe film și inițiază o reacție fotochimică care transformă AgBr în metal Ag Negru. Imaginile negative bine formate și stabile apar în tonuri de gri, corespunzătoare numărului de boabe de AgBr convertite, zonele expuse la cea mai mare lumină fiind cele mai întunecate. Pentru a fixa imaginea și a preveni transformarea mai multor cristale AgBr în metal Ag în timpul procesării filmului, AgBr nereacționat pe film este îndepărtat folosind o reacție de complexare pentru a dizolva sarea puțin solubilă.
reacția pentru dizolvarea bromurii de argint este următoarea:
\
cu
\
echilibrul se află mult spre stânga, iar concentrațiile de echilibru ale ionilor Ag+ și Br – sunt foarte scăzute (7,31 inkt 10-7 m). Drept urmare, eliminarea AgBr nereacționată chiar și dintr-o singură rolă de film folosind apă pură ar necesita zeci de mii de litri de apă și mult timp. Principiul lui Le Chatelier ne spune, totuși, că putem conduce reacția la dreapta prin eliminarea unuia dintre produse, ceea ce va determina dizolvarea mai multor AgBr. Ionul bromură este dificil de îndepărtat chimic, dar ionul de argint formează o varietate de complexe stabile cu două coordonate cu liganzi neutri, cum ar fi amoniacul, sau cu liganzi anionici, cum ar fi cianura sau tiosulfatul (S2O32 -). În procesarea fotografică, excesul de AgBr este dizolvat folosind o soluție concentrată de tiosulfat de sodiu.
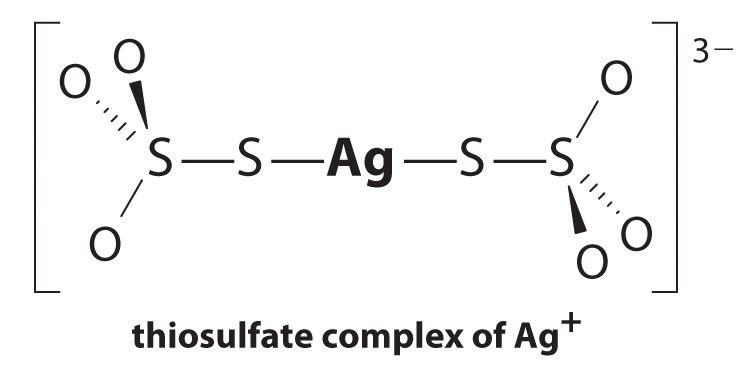
reacția Ag + cu tiosulfat este următoarea:
\^{3−}_{(aq)} \ etichetă{17.3.5a}\]
cu
\
magnitudinea constantei de echilibru indică faptul că aproape toți ionii Ag+ din soluție vor fi complexați imediat de tiosulfat pentru a forma 3−. Putem vedea efectul tiosulfatului asupra solubilității AgBr scriind reacțiile adecvate și adăugându-le împreună:
\\ \mathrm{Ag^+(aq)}+\mathrm{2s_2o_3^{2 -} (aq)}\rightleftharpoons\mathrm{^{3 -} (aq)}\hspace{3mm}K_\textrm f&=2.9 \ timpuri10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm F} = 15 \end{align} \ etichetă{17.3.6}\)
comparând K cu Ksp arată că formarea ionului complex crește solubilitatea AgBr cu aproximativ 3% 1013. Creșterea dramatică a solubilității combinată cu costul scăzut și toxicitatea scăzută explică de ce tiosulfatul de sodiu este aproape universal utilizat pentru dezvoltarea filmului alb-negru. Dacă se dorește, argintul poate fi recuperat din soluția de tiosulfat folosind oricare dintre mai multe metode și reciclat.
dacă un ion complex are un Kf mare, formarea unui ion complex poate crește dramatic solubilitatea sărurilor puțin solubile.
Example \(\PageIndex{2}\)
datorită efectului ionic comun, ne-am putea aștepta ca o sare precum AgCl să fie mult mai puțin solubilă într-o soluție concentrată de KCl decât în apă. O astfel de presupunere ar fi incorectă, totuși, deoarece ignoră faptul că ionul de argint tinde să formeze un complex cu două coordonate cu ioni de clorură (AgCl2 -). Calculați solubilitatea AgCl în fiecare situație:
- în apă pură
- în soluție de 1,0 M KCl, ignorând formarea oricăror ioni complecși
- aceeași soluție ca și în partea (b), cu excepția luării în considerare a formării ionilor complecși, presupunând că AgCl2− este singurul complex Ag + care se formează în concentrații semnificative
la 25% C, Ksp = 1,77% 10-10 pentru AgCl și Kf = 1.1 105 pentru AgCl2−.
dat: Ksp de AgCl, Kf de agcl2-și concentrația de KCl
solicitat: solubilitatea AgCl în apă și în soluție de KCl cu și fără formarea de ioni complecși
strategie:
- scrieți expresia produsului de solubilitate pentru AgCl și calculați concentrația de Ag+ și Cl− în apă.
- se calculează concentrația de Ag+ în soluția KCl.
- scrieți ecuații chimice echilibrate pentru dizolvarea AgCl și pentru formarea complexului AgCl2. Adăugați cele două ecuații și calculați constanta de echilibru pentru echilibrul general.
- scrieți expresia constantă de echilibru pentru reacția generală. Rezolvați concentrația ionului complex.
soluție
- A dacă lăsăm x egal solubilitatea AgCl, apoi la echilibru = = x M. înlocuind această valoare în expresia produsului de solubilitate,
astfel, solubilitatea AgCl în apă pură la 25 CTX este de 1,33 ctx10-5 m.
- B Dacă x este egal cu solubilitatea AgCl în soluția KCl, atunci la echilibru = x M și = (1,0 + x) M. înlocuind aceste valori în expresia produsului de solubilitate și presupunând că x << 1.0,
dacă efectul ionic comun ar fi singurul factor important, am prezice că AgCl este cu aproximativ cinci ordine de mărime mai puțin solubil într-o soluție de 1,0 m KCl decât în apă.
- C pentru a explica efectele formării ionilor complecși, trebuie mai întâi să scriem ecuațiile de echilibru atât pentru dizolvarea, cât și pentru formarea ionilor complecși. Adăugarea ecuațiilor corespunzătoare Ksp și Kf ne oferă o ecuație care descrie dizolvarea AgCl într-o soluție KCl. Constanta de echilibru pentru reacție este, prin urmare, produsul Ksp și Kf:
\\ \mathrm{Ag^+(aq)}+ \ mathrm{2CL^{ – }} \ rightleftharpoons \ mathrm {^{ – }} \ hspace{3mm}K_ \ textrm f & =1.1 \ timpuri10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\textrm f} = 1,9 \ timpuri10 ^ {-5} \ end{align}\)
D dacă lăsăm x egal solubilitatea AgCl în soluția KCl, apoi la echilibru = X și = 1,0-x. înlocuind aceste cantități în expresia constantă de echilibru pentru reacția netă și presupunând că x << 1.0,
adică AgCl se dizolvă în 1,0 m KCl pentru a produce o soluție de 1,9 10-5 m a ionului complex AgCl2. Astfel, prezicem că AgCl are aproximativ aceeași solubilitate într-o soluție de 1,0 M KCl ca și în apa pură, care este de 105 ori mai mare decât cea prezisă pe baza efectului ionic comun. (De fapt, solubilitatea măsurată a AgCl în 1,0 m KCl este aproape un factor de 10 mai mare decât cel din apa pură, în mare parte datorită formării altor complexe care conțin clorură.)
exercitarea \(\PageIndex{2}\)
calculați solubilitatea iodurii de mercur (II) (HgI2) în fiecare situație:
- apă pură
- o soluție de NaI de 3,0 M, presupunând că 2− este singura specie care conține Hg prezentă în cantități semnificative
Ksp = 2,9 10-29 pentru HgI2 și KF = 6,8 1029 pentru 2 -.
Răspuns
- 1.9 × 10-10 M
- 1.4 M
agenții de complexare, moleculele sau ionii care cresc solubilitatea sărurilor metalice prin formarea complexelor metalice solubile sunt componente comune ale detergenților de rufe. Acizii carboxilici cu lanț lung, componentele majore ale săpunurilor, formează săruri insolubile cu Ca2+ și Mg2+, care sunt prezente în concentrații mari în apa “tare”. Precipitarea acestor săruri produce un inel de cadă și dă o nuanță gri îmbrăcămintei. Adăugarea unui agent de complexare precum pirofosfat (o3popo34-sau P2O74−) sau trifosfat (P3O105−) la detergenți împiedică precipitarea sărurilor de magneziu și calciu, deoarece constanta de echilibru pentru formarea ionilor complexi este mare:
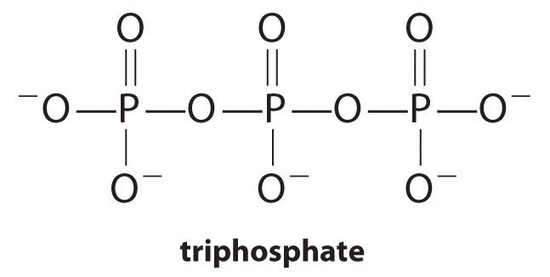
cu
cu toate acestea, fosfații pot provoca daune mediului prin promovarea eutrofizării, creșterea unor cantități excesive de alge într-un corp de apă, ceea ce poate duce în cele din urmă la scăderi mari ale nivelurilor de oxigen dizolvat care ucid peștii și alte organisme acvatice. În consecință, multe state din Statele Unite au interzis utilizarea detergenților care conțin fosfat, iar Franța a interzis utilizarea acestora începând cu 2007. Detergenții “fără fosfat” conțin diferite tipuri de agenți de complexare, cum ar fi derivații acidului acetic sau alți acizi carboxilici. Dezvoltarea substituenților fosfați este un domeniu de cercetare intensă.
dedurizatoarele de apă comerciale utilizează, de asemenea, un agent de complexare pentru tratarea apei dure prin trecerea apei peste rășini schimbătoare de ioni, care sunt săruri complexe de sodiu. Când apa curge peste rășină, ionul de sodiu este dizolvat și sărurile insolubile precipită pe suprafața rășinii. Apa tratată în acest mod are un gust mai sărat datorită prezenței Na+, dar conține mai puține minerale dizolvate.
o altă aplicație a agenților de complexare se găsește în medicină. Spre deosebire de razele X, imagistica prin rezonanță magnetică (RMN) poate oferi imagini relativ bune ale țesuturilor moi, cum ar fi organele interne. RMN se bazează pe proprietățile magnetice ale nucleului 1h al atomilor de hidrogen din apă, care este o componentă majoră a țesuturilor moi. Deoarece proprietățile apei nu depind foarte mult de faptul dacă se află în interiorul unei celule sau în sânge, este greu să obțineți imagini detaliate ale acestor țesuturi care au un contrast bun. Pentru a rezolva această problemă, oamenii de știință au dezvoltat o clasă de complexe metalice cunoscute sub numele de “agenți de contrast RMN.”Injectarea unui agent de contrast RMN la un pacient afectează selectiv proprietățile magnetice ale apei în celulele țesuturilor normale, în tumori sau în vasele de sânge și permite medicilor să “vadă” fiecare dintre acestea separat (figura \(\PageIndex{2}\)). Unul dintre cei mai importanți ioni metalici pentru această aplicație este Gd3+, care cu șapte electroni nepereche este foarte paramagnetic. Deoarece Gd3+(aq) este destul de toxic, trebuie administrat ca un complex foarte stabil care nu se disociază în organism și poate fi excretat intact de rinichi. Agenții de complexare utilizați pentru gadoliniu sunt liganzi precum dtpa5 – (acid pentaacetic dietilen triamină), a cărui formă complet protonată este prezentată aici.
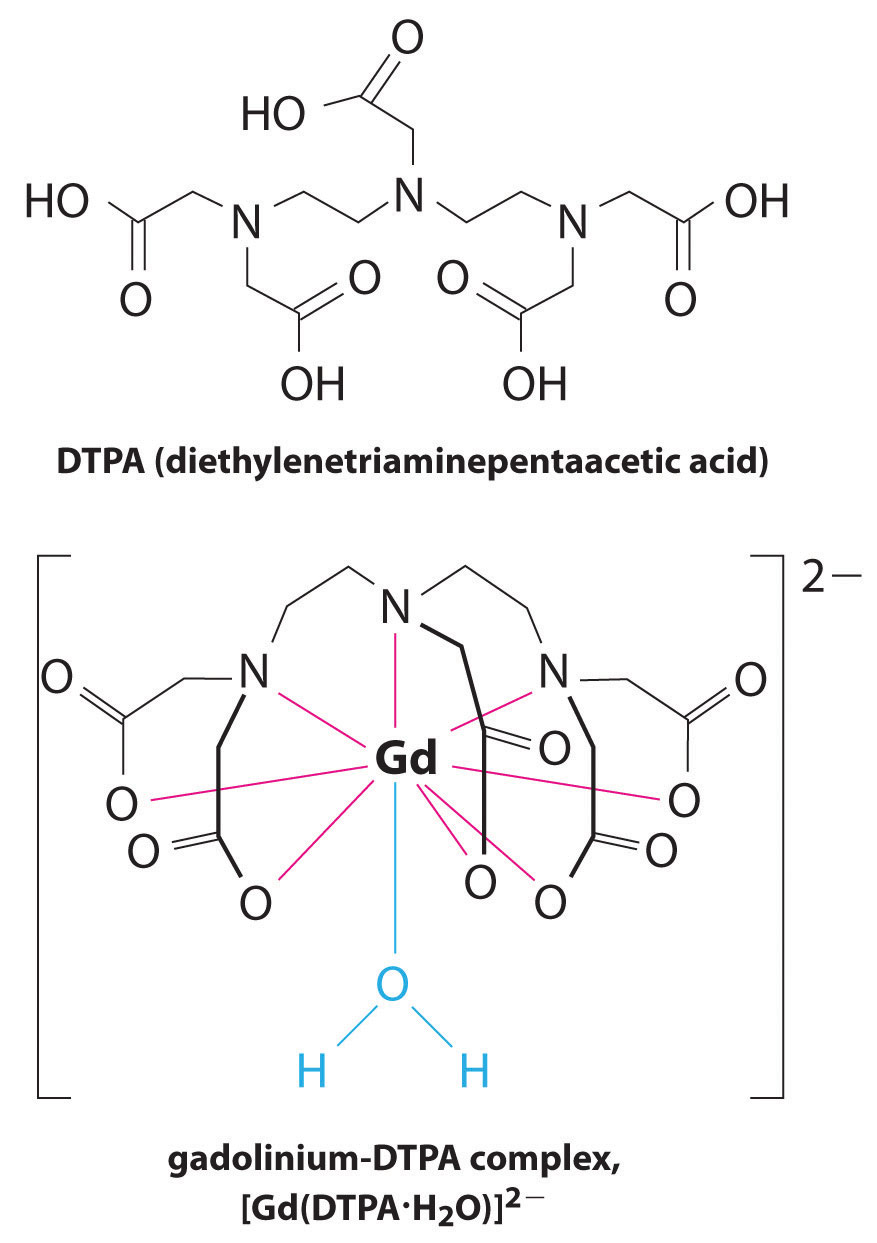
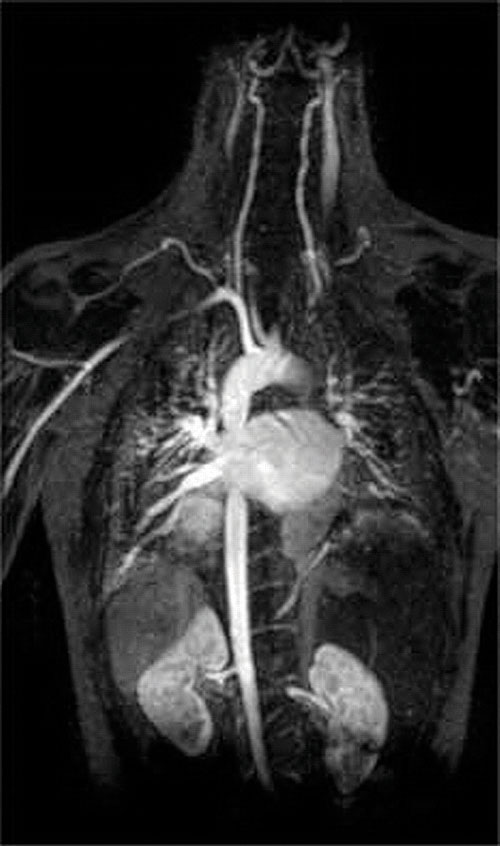
figura \(\PageIndex{2}\): o imagine RMN a inimii, arterelor și venelor. Când un pacient este injectat cu un cation metalic paramagnetic sub forma unui complex stabil cunoscut sub numele de agent de contrast RMN, proprietățile magnetice ale apei din celule sunt modificate. Deoarece diferitele medii din diferite tipuri de celule răspund diferit, un medic poate obține imagini detaliate ale țesuturilor moi.