2.3: monoxid de Carbon și backbonding
proprietăți generale
CO este un ligand dativ, de tip L, care nu afectează starea de oxidare a Centrului metalic la legare, dar crește numărul total de electroni cu două unități. Am văzut recent că există într-adevăr două interacțiuni de legătură în ligandul carbonil: o interacțiune ligand-metal n inkt și o interacțiune metal-ligand DN inkt. Această din urmă interacțiune se numește backbonding, deoarece metalul donează densitatea electronilor înapoi ligandului. Pentru a-mi aminti de existența backbondingului, îmi place să folosesc structura de rezonanță din dreapta ori de câte ori este posibil; cu toate acestea, este important să ne amintim să tratăm CO ca un ligand de tip L, indiferent de forma de rezonanță desenată.

Orbital interacțiuni în M=C=O.
CO este un puternic σ-donator (sau σ-bază) și un bun π-acceptor (sau π-acid). Proprietățile CO ligate depind profund de identitatea Centrului metalic. Mai precis, proprietățile electronice ale centrului metalic dictează importanța backbondingului în complexele carbonilice metalice. Cel mai direct, centrele metalice mai bogate în electroni sunt mai bune la backbonding la CO. De ce este important să se stabilească puterea de backbonding?
spectroscopia în infraroșu a fost folosită pentru a susține empiric ideea de backbonding. Tabelul de mai jos aranjează unele complexe carbonilice metalice în ordine “periodică” și oferă frecvența corespunzătoare modului de întindere C=O. Observați că, fără excepție, fiecare Co complexat are o frecvență de întindere mai mică decât cea a CO liber. Backbonding este de vina! Ordinea legăturii C-O în monoxidul de carbon complexat este (aproape întotdeauna) mai mică decât cea a CO liber.

c=o frecvențe de întindere în complexe metal-carbonil. Ți se pare ceva ciudat aici?
figura de mai sus descrie o creștere clară a frecvenței (o creștere a ordinii legăturii C–O) pe măsură ce ne deplasăm de la stânga la dreapta peste tabelul periodic. Această constatare poate părea ciudată dacă considerăm că numărul de electroni d din metalul neutru crește pe măsură ce ne deplasăm de la stânga la dreapta. Nu ar trebui centrele metalice cu mai mulți electroni d să fie mai bune la backbonding (și mai “bogate în electroni”)? Ce se întâmplă aici? Amintiți-vă tendința periodică a energiei orbitale. Pe măsură ce ne deplasăm de la stânga la dreapta, energiile orbitale d scad, iar energiile orbitalilor DN și ale orbitalilor* se separă. Ca urmare, interacțiunea orbitală de backbonding se înrăutățește (amintiți-vă că interacțiunile orbitale puternice necesită energii orbitale bine potrivite) pe măsură ce ne îndreptăm spre metalele de tranziție târzie mai electronegative! Putem trage o analogie cu enaminele și eterii enol din chimia organică. Atomul de oxigen mai electronegativ din eterii enol este un donator de electroni mai rău decât atomul de azot al enaminei.

importanța backbondingului depinde de electronegativitatea metalului și de densitatea electronică a acestuia.
desigur, nici contribuția altor liganzi din Centrul metalic la backbonding nu poate fi uitată. În mod logic, liganzii donatori de electroni vor tinde să facă legătura din spate mai puternică (fac din metal un donator de electroni mai bun), în timp ce liganzii care retrag electroni vor agrava legarea din spate. Adăugarea liganzilor fosfinici bogați în electroni la un centru metalic, de exemplu, scade frecvența de întindere a CO datorită îmbunătățirii backbondingului.
liganzii carbonilici sunt capabili de a lega mai multe centre metalice. Legarea în complexele carbonilice cu punte poate fi fie “tradițională”, fie delocalizată, în funcție de structura complexului și de modul de punte. Varietatea modurilor de legătură provine din diferiții donatori și acceptori de electroni prezenți pe ligandul CO (și posibilitatea legării delocalizate). Modurile de legătură cunoscute sunt prezentate în figura de mai jos.
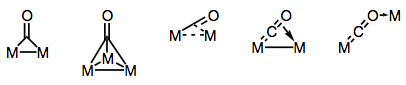
construirea de poduri cu liganzi carbonil!