7.4: Complexul III
complexul III acceptă electroni atât din complexul I, cât și din complexul II. electronii ajung sub formă de ubiquinol, UQH2, care livrează doi electroni și doi protoni și este convertit înapoi în ubiquinonă, UQ. Ubiquinona se transferă apoi înapoi la Complexul I sau complexul II pentru a colecta mai mulți electroni.
- Complexul III este destinația pentru electronii care sosesc atât din complexul I, cât și din complexul II.
- Complexul III folosește energia eliberată în transferurile de electroni în jos pentru a pompa mai mulți protoni prin membrana mitocondrială interioară.
- gradientul de protoni de-a lungul membranei este folosit pentru a conduce formarea ATP la Complexul V.
- Complexul III trimite apoi electronii la Complexul IV.
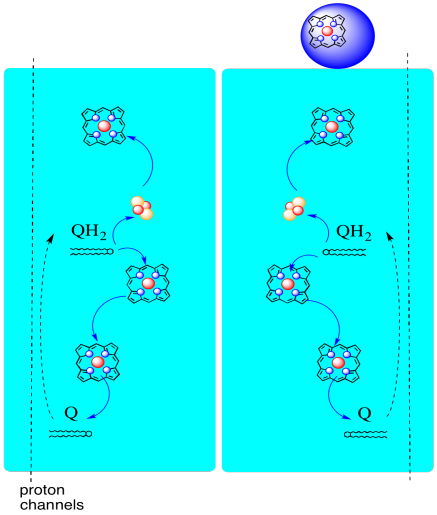
calea electronilor prin complexul III este prezentată mai jos. Rețineți că complexul este o structură dimerică, cu două căi echivalente: una afișată în stânga și cealaltă în dreapta. Electronii sunt livrați din UQH2, ubiquinol, în mijlocul imaginii, călătorind în sus către citocromul mobil c din partea de sus. O a doua cale electronică permite deplasarea în jos în imagine, spre o altă moleculă de ubiquinonă, care reciclează electronii într-o buclă.
- Complexul III prezintă o cale electronică neobișnuită, divergentă.
- un electron se deplasează spre citocromul C.
- al doilea electron este în cele din urmă reciclat într-un alt ubiquinol.
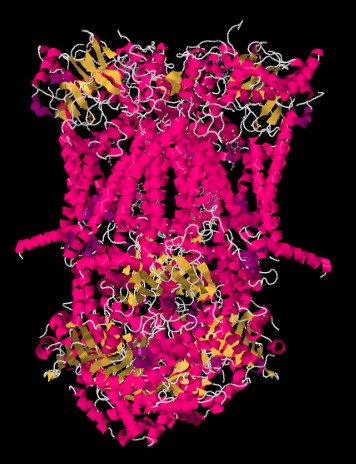
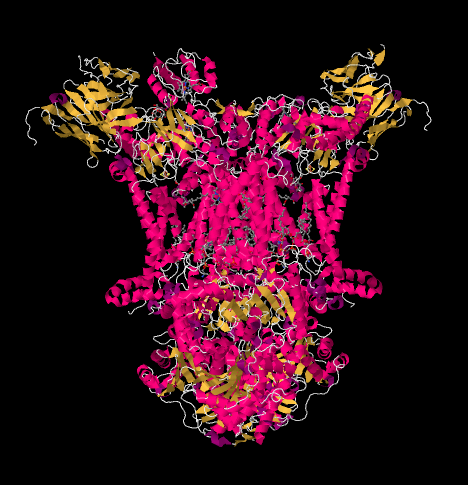
structura cu raze X a complexului III este prezentată sub formă de desene animate de mai jos. Membrana mitocondrială interioară ar intersecta porțiunea mijlocie superioară a complexului. Majoritatea proiectelor complexe de mai jos, în matrice (partea de jos a imaginii, în această orientare), deși o cantitate semnificativă iese și în spațiul intermembranar.
Complexul III continuă lanțul de transport al electronilor, trimițând electroni către un potențial de reducere mai mare (și energie liberă mai mică) și către o întâlnire cu oxigenul molecular în complexul IV. Protonii sunt, de asemenea, pompați din matricea mitocondrială, peste membrana mitocondrială interioară și în spațiul intermembranar. În același timp, o a doua cale de electroni are ca rezultat o reciclare eficientă a jumătății electronilor care intră în complex, crescând numărul de protoni pompați pe electron care ajung la Complexul III.
- s-a sugerat că bucla de reciclare a electronilor oferă un mecanism pentru extragerea mai multor protoni din matrice.
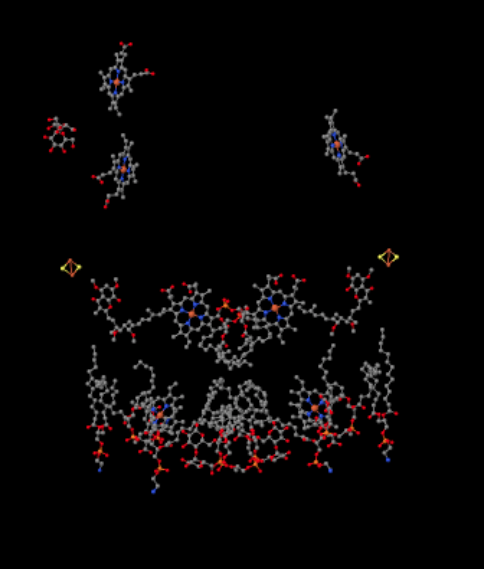
putem vedea acest aranjament neobișnuit dacă ignorăm proteinele pentru a dezvălui liganzii, mai jos. Complexul poate fi văzut mai clar ca un dimer; jumătatea stângă a imaginii este exact aceeași cu cea dreaptă, deși reflectată în sens opus. Electronii intră în complex prin intermediul transportatorului mobil, ubiquinol, vizibil în partea dreaptă și stângă a imaginii cam la jumătatea drumului în jos; puteți vedea inelulși un lanț atârnat de el.
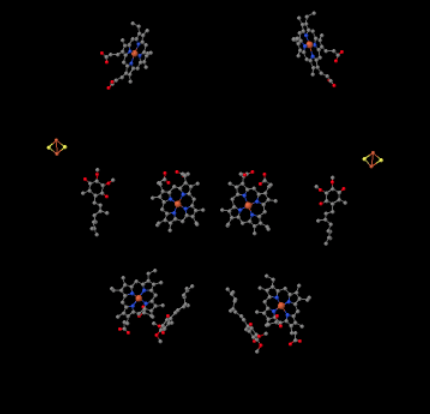
când UQH2 se leagă de Complexul III, un electron este trimis către un grup FeS, în timp ce al doilea este trimis către un centru heme de fier, numit heme BL. Clusterul FeS este vizibil chiar deasupra ubiquinolului și până la marginea imaginii. Heme BL este spre centrul imaginii.
deși nu este evident în imaginea cu raze X prezentată, acest cluster FeS este diferit de cele pe care le-ați văzut mai devreme. Acesta este ținut în loc cu diferite lanțuri laterale de aminoacizi. Nu puteți vedea asta în imagine, deoarece întreaga proteină a fost lăsată deoparte, împreună cu acei aminoacizi care se leagă de grup. În timp ce majoritatea clusterelor FeS sunt ținute pe loc exclusiv de cisteine, acest grup este ținut pe loc de doi cisteieni pe o parte, dar de două histidine pe cealaltă. Acest cluster Fes ciudat se numește un cluster Rieske.
clusterele Rieske sunt importante deoarece sunt “clustere FeS cu potențial ridicat”. Aceasta înseamnă că au potențial de reducere excepțional de pozitiv în comparație cu alte clustere FeS. Potențialul de reducere al oricărui ligand dintr-o proteină depinde în mare măsură de mediul său și, prin urmare, există o gamă largă de valori în majoritatea cazurilor. Acest lucru este valabil pentru grupurile de sulf de fier; cele normale au potențiale de reducere care variază de la -1,0 V la aproximativ +0,05 V. clusterele Rieske au potențiale care variază de la aproximativ 0V la aproximativ 0,4 V.
din grupul FeS, electronul este trimis către un alt centru hem de fier într-o unitate legată de membrană numită citocrom c1. Citocromul c1 poate fi văzut în partea de sus a imaginii. Deoarece această imagine este orientată în același mod ca și celelalte structuri cu raze X ale complexului respirator, putem vedea că acest electron este transportat în sus spre spațiul intermembranar. În cele din urmă, acest electron este transferat într-un alt hem, dar acest HEM este legat într-o proteină mică, mobilă, numită citocrom c. citocromul c este un alt purtător de electroni mobili. El transportă electronul la complexul IV. Ne vom întoarce la citocromul c puțin mai târziu.
înainte de a ajunge la asta, unde merge celălalt electron? Din heme BL, al doilea electron este trecut la un alt complex de porfirină de fier, heme BH. Aceasta este spre partea de jos a imaginii, astfel încât acest electron este de fapt trimis înapoi spre matrice. În așteptarea heme BL, totuși, există o altă ubiquinonă, UQ. Așteaptă electronul. De fapt, va aștepta două, apoi își va părăsi docul și se va întoarce în jurul locului de legare ubiquinol (UQH2) pentru a livra din nou electronii.
de ce deranjez? De ce să nu trimiți electronii pe drumul lor corect prima dată? Se pare că sunt reciclate dintr-un anumit motiv. Se crede că această diversiune permite pomparea protonilor suplimentari prin membrana mitocondrială. Când a doua ubiquinonă este redusă la ubiquinol prin acceptarea a doi electroni, ea preia, de asemenea, încă doi protoni din matricea de mai jos. Acești protoni vor fi în cele din urmă trecuți spre spațiul intermembranar atunci când ubiquinolul se oxidează din nou. Această reciclare și stoarcerea câtorva protoni suplimentari pentru a crește gradientul de protoni se numește bucla Q.
avantajul buclei Q este explicat în diagrama următoare. În diagramă, intrările la complexul III sunt afișate în roșu, ieșirile sunt afișate în albastru, iar elementele reciclate sunt în verde. Dacă un ubiquinol și-ar livra pur și simplu electronii și protonii și ar fi făcut, ar exista doi protoni livrați pe ubiquinol. Aceasta este o ieșire de protoni pe electron care a fost introdusă.
un al doilea ubiquinol ar face exact același lucru. Ar exista patru protoni de ieșire pentru patru electroni inițial de intrare. Aceasta este încă o ieșire de protoni pe electron care a fost introdusă.
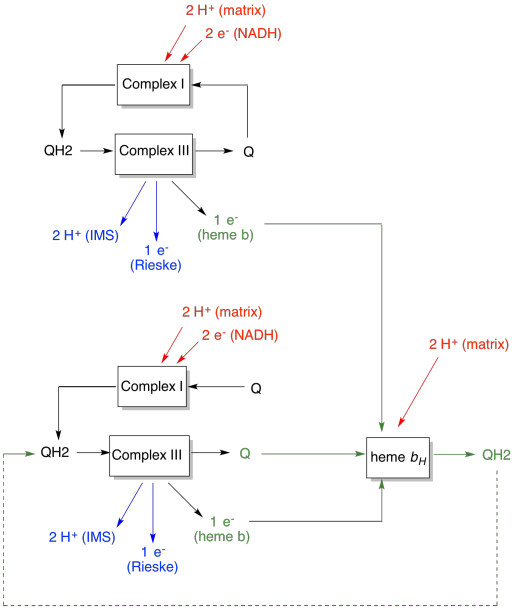
dacă, în schimb, un electron este reciclat de fiecare dată, atunci fiecare al doilea ubiquinol duce la livrarea unei perechi suplimentare de protoni. Asta pentru că în colectarea electronilor reciclați, o ubiquinonă a trebuit să călătorească înapoi în partea matricială a membranei și să ridice încă doi protoni. În general, asta înseamnă că șase protoni sunt livrați pentru patru electroni de intrare sau 1,5 protoni de ieșire pe intrare de electroni. Deoarece gradientul de protoni este ceea ce generează ATP, atunci prin creșterea numărului de protoni pompați pe electron care intră, eficiența este crescută.
- bucla Q mărește numărul de protoni pompați pe intrare de electroni în sistem.
acum să ne întoarcem la purtătorul de electroni de ieșire, citocromul c, care va transporta electronii către Complexul IV. În imaginea de mai jos, dintr-o structură diferită de cristal cu raze X, complexul a fost găsit cu o andocare cyctochrome c la locul de legare. Citocromul c este o proteină globulară roz atașată în partea de sus a imaginii, în jumătatea stângă a dimerului așa cum îl privim aici. Stă la marginea spațiului intermembranar, care este un mediu apos. Spre deosebire de ubiquinonă, care alunecă de-a lungul bistratului lipidic al membranei, citocromul c se rostogolește sau alunecă sau înoată deasupra până la destinație.
același punct de vedere este prezentat mai jos, fără proteine. Partea de jos a imaginii este destul de aglomerată de lipide și există un zahăr atârnat în stânga sus, dar chiar în partea de sus puteți vedea porfirina de fier care este amplasată în interiorul citocromului c.
o privire mai atentă asupra unei structuri cu raze X a unui ciclocrom c, de mai jos, arată o imagine relativ simplă în comparație cu complexele la care ne-am uitat. Există câteva helice, câteva foi, câteva bucle și acea porfirină de fier sau heme din nou. Câțiva ioni de sulfat plutesc în apropiere, precum și câteva molecule de glicerol, introduse probabil în timpul purificării sau cristalizării proteinei. Rețineți că hemul se găsește la marginea proteinei. Această locație poate facilita transferul de electroni de la Complexul III sau la Complexul IV.
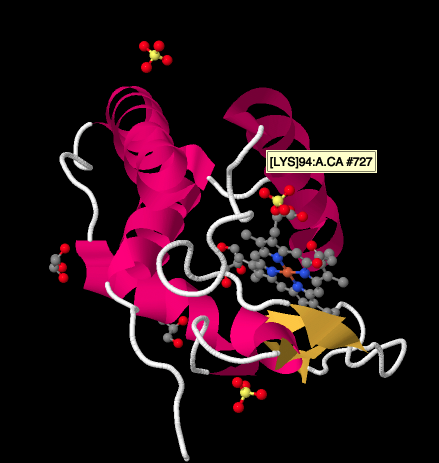
- citocromul c este destinația finală a electronilor care se deplasează prin complexul III.
- citocromul c este un purtător mobil, cu un singur electron.
- citocromul c este de fapt o proteină mică, hidrofilă.
- citocromul c se găsește deasupra membranei mitocondriale, la marginea spațiului intermembranar.
ce împiedică ciclocromul c să se rătăcească în spațiul intermembranar? Dacă ar face acest lucru, ar întrerupe fluxul eficient de electroni. Este posibil ca citocromul c să se deplaseze înainte și înapoi între complexul III și complexul IV printr-un mecanism numit “direcție”. În direcție, transportatorul este ghidat de-a lungul unei căi prin SARCINI complementare. De exemplu, dacă membrana este încărcată negativ din cauza grupurilor polare de pe suprafața membranei, atunci sarcinile pozitive de pe suprafața citocromului c pot restricționa mișcarea acesteia pe suprafața membranei. Numai asta i-ar reduce mobilitatea de la trei dimensiuni (oriunde în spațiul intermembranar) la două dimensiuni (oriunde pe suprafața membranei). Este posibil ca interacțiunile suplimentare să-i reducă mobilitatea și mai mult la o pistă unidimensională între cele două complexe.
- direcția, bazată pe SARCINI complementare, împiedică pierderea citocromului c în spațiul intermembranar.
exercitarea \(\PageIndex{1}\)
sugerați posibile reziduuri de aminoacizi la suprafața citocromului c care îl pot ajuta să rămână pe o suprafață a membranei încărcate negativ.
răspuns
arginina și lizina sunt încărcate pozitiv la pH neutru.
exercitarea \(\PageIndex{2}\)
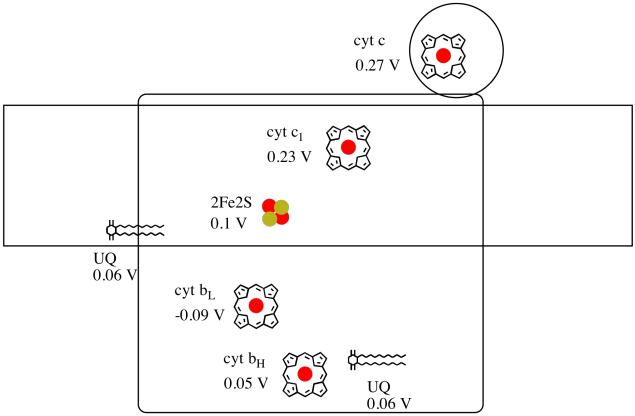
este dificil să se măsoare potențialul de reducere al unui situs individual într-o proteină. Cu toate acestea, cercetătorii au reușit să estimeze aceste valori prin măsurarea spectrelor EPR în diferite condiții. Presupunând potențialele de reducere de mai jos, desenați o diagramă de progres al reacției pentru transportul unui electron până la donatorul inițial de ubiquinonă până la citocromul c.
 răspuns
răspuns
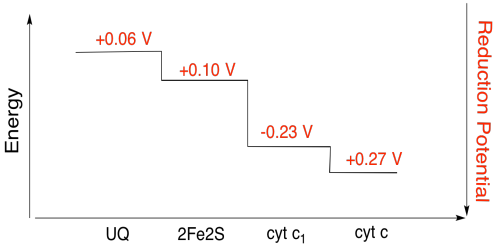
exercitarea \(\PageIndex{3}\)
folosind valorile din figura de mai sus, calculați schimbarea energiei atunci când un electron este transferat de la clusterul 2fe2s la citocromul c1.
Răspunsul
Presupunând că potențialele de reducere sunt:
2Fe2S(ox) + e- → 2Fe2S(roșu) tu vei ataca = 0.10 V
cyt c1(ox) + e- → cyt c1(roșu) tu vei ataca = 0.230 V
Atunci diferența de potențial pentru reacție, ΔEo = 0.23 – (0.10) V = 0.13 V.
Faraday legătură ΔG = – n F ΔEo dă
ΔG = – 1 x 96,485 J V-1 mol-1 x 0,13 V = 12,543 J mol-1 = 12.5 kJ mol-1
exercitarea \(\PageIndex{4}\)
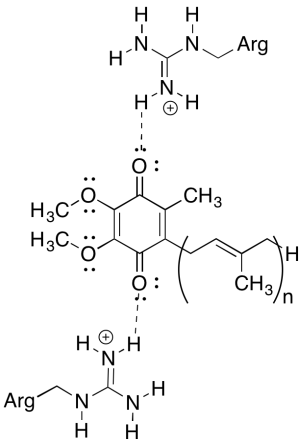
unul dintre lucrurile uimitoare despre acest complex este că, în bucla de reciclare a electronilor, transferul de electroni pare să treacă de la o ubiquinonă inițială la o ubiquinonă finală, fără o forță motrice generală. Cu toate acestea, potențialele de reducere sunt foarte sensibile la mediu. Arătați cum reziduurile de arginină din apropiere ar putea face potențialul de reducere al unei ubiquinone mai pozitiv.
răspuns
reziduurile pozitive de arginină ar conferi sarcină pozitivă parțială ubiquinonei prin legarea hidrogenului; ubiquinona ar avea ca rezultat un potențial de reducere mai pozitiv.
consultați pagina focus pe structura complexului III la Biochemistry Online.
structura cristalină cu raze X a complexului III din: Gao, X., Wen, X., Esser, L., Quinn, B., Yu, L., Yu, C.-A., Xia, D. baza structurală pentru reducerea chinonei în complexul bc1: o analiză comparativă a structurilor cristaline ale citocromului mitocondrial bc1 cu substrat legat și inhibitori la locul Qi. Biochimie 2003, 4, 9067-9080. (1ntz)
structura cristalină cu raze X a complexului III cu citocrom C legat de: Solmaz, S. R., vânătoare, C. structura complexului III cu citocrom C legat în stare redusă și definirea unei interfețe minime de bază pentru electrontransfer. J. Biol. Chem. 2008, 283, 17542-17549. (3CXH)
structura cristalină cu raze X a citocromului c din: Enguita, F. J., Pohl, E., Turner, D. L., Santos, H., Carrondo, M. A. dovezi structurale pentru o cale de transfer de protoni cuplată cu reducerea haem a citocromului c” din Methylophilus methylotrophus. J. Biol. Inorg. Chem. 2006 11, 189. (1OAE)
atribuire
Chris P Schaller, Ph. D., (Colegiul Saint Benedict / Universitatea Saint John)