7.5: Complexul IV
Complexul IV este destinația finală în lanțul de transport al electronilor. Aici, electronii care au călătorit prin ceilalți membri ai supercomplexului respirator sunt în cele din urmă livrați la O2, reducându-l la apă. Aceasta este o realizare impresionantă, deoarece un număr de specii reactive de oxigen trebuie să se formeze între adăugarea inițială a unui electron și eliberarea finală a apei, dar reacția este controlată în așa fel încât posibilitatea de deteriorare a celulelor să fie redusă la minimum. În același timp, mai mulți protoni sunt pompați peste membrana mitocondrială interioară.
- în complexul IV, electronii sunt livrați la destinația lor finală, o moleculă de O2.
- O2 este redus la apă.
exercitarea \(\PageIndex{1}\)
scrieți o jumătate de reacție redox echilibrată pentru a arăta câți electroni sunt necesari pentru a reduce o moleculă de oxigen în apă.
răspuns
O2 H2O
O2 2 H2O (o echilibrată)
O2 + 4h+ 2 H2O (H echilibrată)
O2 + 4e – + 4h + 2 H2O (încărcare echilibrată)
structura cu raze X a complexului IV este prezentată mai jos. Din nou, matricea se află la capătul inferior al imaginii, iar spațiul intermembranar este în partea de sus. Acolo docuri citocromul c, în partea de sus.
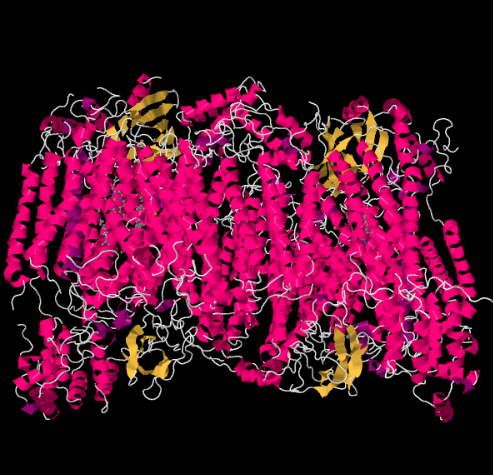
purtătorul de electroni mobil, citocromul c, se leagă la Complexul IV și livrează un electron către un situs binuclear de cupru numit CuA. Putem vedea că site-ul de cupru binuclear atunci când ne uităm în interiorul proteinei, de mai jos. Este legat doar de proteine și nimic altceva, așa că vedem doar cei doi ioni de cupru pe cont propriu în partea de sus a imaginii. Această pereche de atomi de cupru trimite electronul către un hem, citocromul a, pe care îl puteți vedea mai jos și spre stânga. De acolo, electronul trece la un alt grup binuclear, de data aceasta constând dintr-un fier legat de heme (citocromul A3) și un cupru din apropiere (CuB). Acest sit binuclear realizează reducerea dioxigenului în apă. În structură, există o moleculă de monoxid de carbon legată în situsul activ între citocromul A3 și CuB. Atomii de carbon este atașat la fier și oxigenul este atașat la cupru. Acolo s-ar lega molecula de oxigen, așteptând să fie redusă la apă.
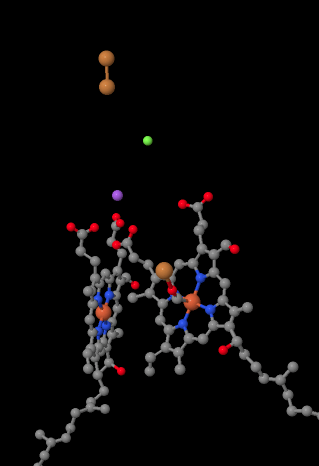
dacă vă gândiți la asta, înseamnă că electronii călătoresc în direcția opusă față de ceea ce am văzut în primele trei complexe. În complexele I și II, electronii au fost eliberați din matricea mitocondrială și au călătorit în sus spre spațiul intermembranar, oprindu-se la o ubiquinonă în membrana mitocondrială. În complexul III, electronii au continuat în acea direcție” ascendentă”, de la membrana mitocondrială la citocromul c în spațiul intermembranar. În complexul IV, electronii inversează cursul, călătorind înapoi spre matricea mitocondrială. Amintiți-vă, matricea mitocondrială este dopată cu N din cauza pompării protonilor, astfel încât acești electroni călătoresc de la partea pozitivă a membranei la partea negativă. Trebuie să fie dificil.
- în complexul IV, transportul electronilor este în direcția opusă celorlalte complexe.
- electronii se deplasează de la partea spațiului intermembranar la partea matricei mitocondriale, împotriva gradientului de încărcare.
să aruncăm o altă privire asupra liganzilor importanți pentru complex. Un desen animat este prezentat mai jos. În desen animat, molecula O2 este prezentată legându-se în acea poziție între hem a3 și pui. Acel sit metalic dinuclear este locul în care molecula de oxigen este redusă la apă.
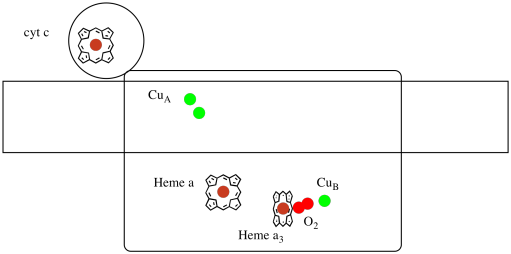
deoarece patru electroni sunt necesari pentru a reduce O2 la H2O, patru molecule de citocrom c trebuie să se lege la Complexul IV înainte ca această reducere să poată continua. Este probabil ca mediul de Coordonare al moleculei de oxigen-între două metale, mai degrabă decât doar legat de unul-să-i permită să fie redus mai rapid până la apă, mai degrabă decât să formeze specii reactive de oxigen care persistă în celulă, cum ar fi peroxizii.
exercițiu \(\PageIndex{2}\)
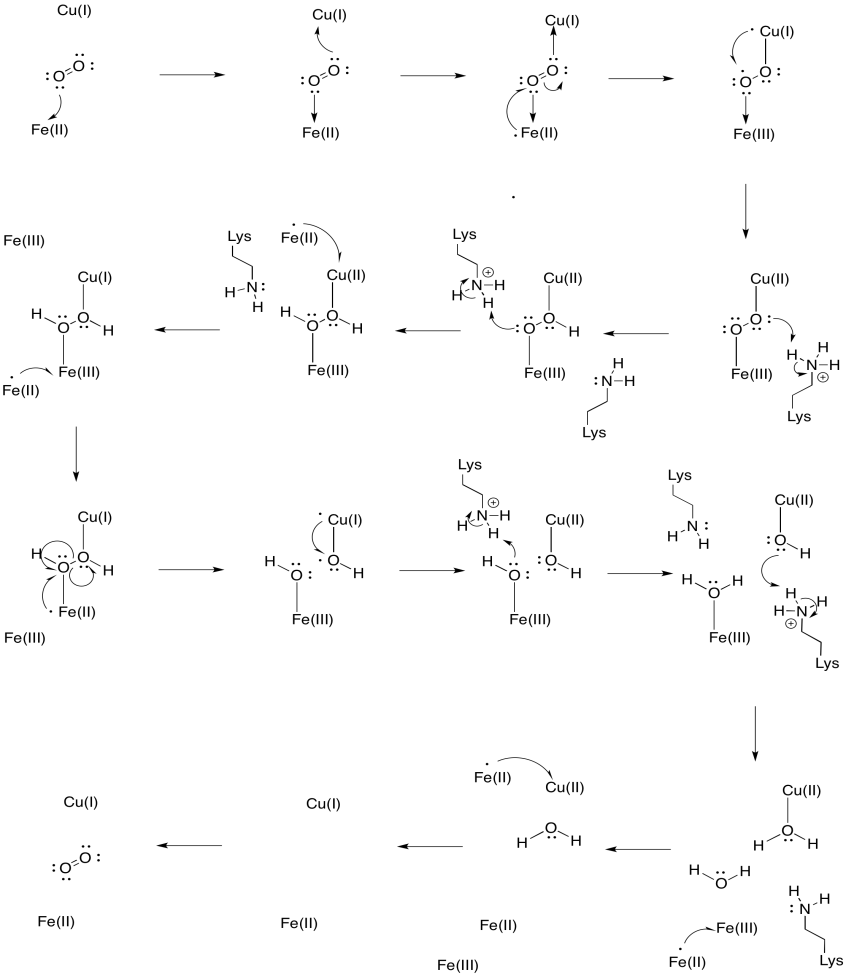
să presupunem că fierul din heme A3 începe într-o stare redusă Fe(II) și cubul începe într-o stare redusă cu(I). Furnizați un mecanism pentru reducerea oxigenului în apă, cu adăugarea a patru electroni și patru protoni. Utilizați Fe (II) ca donator de electroni și lizină ca donator de protoni.
raspuns
în plus față de aceste două metale, există și un conjugat histidină-tirozină modificat legat de CuB. S-a sugerat că această tirozină oferă o altă sursă de electroni imediați care pot fi utilizați în reducere.
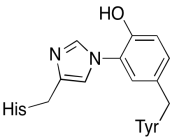
exercitarea \(\PageIndex{3}\)
arătați de ce o tirozină poate fi o sursă atât a unui proton, cât și a unui electron în procesele biochimice.
raspuns
în plus față de necesitatea de a reduce oxigenul în apă, Complexul IV contribuie, de asemenea, la gradientul de protoni, pompând protoni suplimentari pe membrana mitocondrială. Această sarcină prezintă provocări suplimentare. Un mecanism simplu de cuplare nu este posibil, deoarece electronii se mișcă în direcția opusă. Totuși, mecanismul implică modificări conformaționale ale proteinei care apar pe măsură ce metalele schimbă stările de oxidare. Modificările subtile ale mediului de coordonare pot duce la deplasarea reziduurilor de aminoacizi din apropiere. Este ușor de imaginat că, dacă un anumit aminoacid se deplasează în sus spre spațiul intermembranar, poate trage un proton cu el.
- pomparea protonilor și transportul electronilor se desfășoară în direcții opuse în complexul IV și trebuie decuplate.
- pomparea protonilor în complexul IV trebuie să se bazeze pe modificări conformaționale.
exercitarea \(\PageIndex{4}\)
site-ul CuA conține două coppers, huiduit de două cisteine punte. Ambele sunt legate de histidine terminale. În plus, un cupru este legat de o metionină suplimentară, în timp ce celălalt este legat de un carbonil din coloana vertebrală a proteinei.
- desenați copperii în locurile lor de legare.
- descrie geometria fiecărui cupru.
- dacă fiecare cupru este Cu (I), care este numărul coordonat de electroni pe fiecare cupru din complex?
- dacă fiecare cupru este Cu (I), care este sarcina totală a complexului?
răspuns a)
a)
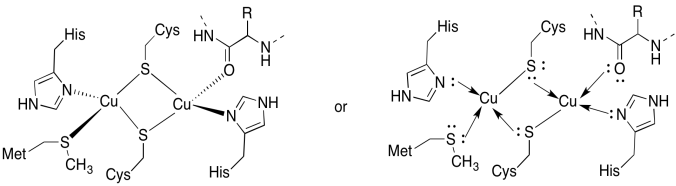
răspuns b)
B) tetraedric
răspuns c)
c) Cu(I) = d10
4 donatori = 8 e-
total = 18E-
răspuns d)
d) 2 x cu (I) = 2+
2 x Cys-S- = 2-
toate celelalte neutre
Total = 0
exercitarea \(\PageIndex{5}\)
cuprul din locul cubului este legat de două histidine și conjugatul histidină-tirozină.
- desenați cuprul în locul de legare.
- descrie geometria cuprului.
- dacă cuprul este Cu (I), care este numărul coordonat de electroni din complex?
- dacă cuprul este Cu (I), care este sarcina totală a complexului?
răspuns a)
a)
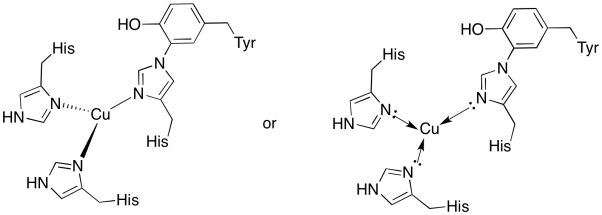
răspuns b)
b) plan trigonal
răspuns c)
c) Cu(I) = d10
3 donatori = 6 e-
total = 16 E-
răspuns d)
d) cu(I) = 1+
histidine neutre
Total = 1+
exercitarea \(\PageIndex{6}\)
este dificil să se măsoare potențialul de reducere al unui situs individual într-o proteină. Cu toate acestea, cercetătorii au reușit să estimeze aceste valori prin măsurarea spectrelor EPR în diferite condiții. Presupunând potențialele de reducere de mai jos, desenați o diagramă a progresului reacției pentru transportul unui electron până la citocromul c la oxigenul molecular.
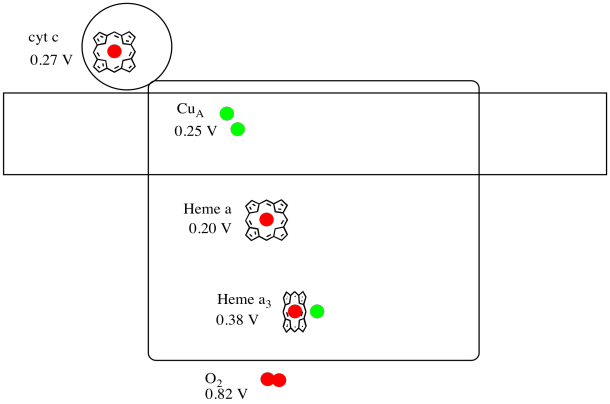 răspuns
răspuns
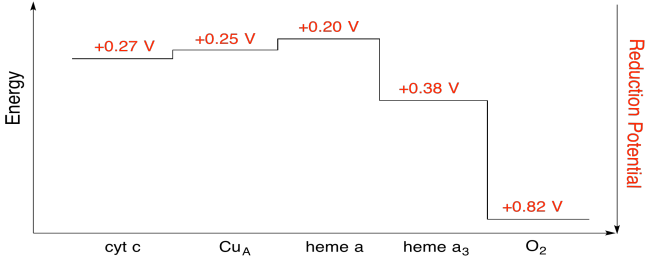
exercitarea \(\PageIndex{7}\)
folosind valorile din figura de mai sus, calculați schimbarea energiei atunci când un electron este transferat de la heme a la heme A3.
răspuns
presupunând că potențialele de reducere sunt:
heme a(ox) + e – heme a(Roșu) eored = 0,20 v
heme A3(ox) + e – heme A3(roșu) eored = 0.38 V
apoi diferența de potențial pentru reacție, 0,38 – (0,20) V = 0,18 V.
relația Faraday HECTG = – N F Hecteo dă
ECTG = – 1 x 96,485 J V-1 mol-1 x 0,13 V = 17,367 J mol-1 = 17,4 kJ mol-1
atribuire
Chris P Schaller, Ph. D., (Colegiul Saint Benedict / Universitatea Saint John)