acizi, baze și pH
|
|||||||||
acizii și bazele lor CONJUGATE
amintiți–vă definiția Bronsted-Lowry a unui acid: un acid este un donator de protoni. În mod clar, în exemplul nostru anterior, acidul acetic își donează protonul către H2O în reacția înainte, rezultând formarea ionului acetat. Cu toate acestea, în reacția inversă, ionul acetat acceptă un proton de la H3O+ pentru a reveni la CH3COOH. Din definiția Bronsted–Lowry, o bază este un acceptor de protoni.
|
astfel, ionul acetat acționează ca bază în reacția inversă și este numit baza conjugată a acidului acetic. Acidul Acetic și ionul acetat sunt cunoscute sub numele de pereche conjugată acido–bazică. Destul de interesant, există o a doua pereche conjugată acido–bazică în reacția de mai sus. Observați cum în reacția inversă, H3O + donează un proton (făcându-l acid), în timp ce în reacția înainte, H2O acceptă un proton (făcându-l o bază). H2O și H3O + sunt o pereche acido–bazică conjugată, H3O+ fiind acidul conjugat și H2O fiind baza conjugată.
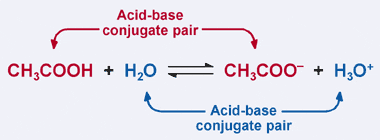
într-o pereche acid-bază conjugată, acidul conjugat are încă un proton decât baza conjugată corespunzătoare.