Anticoagularea citratului în timpul CRRT pentru leziuni renale acute
- leziuni renale Acute
- Managementul AKI – terapii de substituție renală pentru AKI
- hemodializă, hemofiltrare și hemodiafiltrare
- inițierea și calendarul RRT pentru AKI – intermitent versus RRT continuu
- anticoagularea în timpul terapiei de substituție renală continuă (CRRT)
- citrat – mecanismul acțiunii sale anticoagulante și aplicarea sa în CRRT
- tulburări metabolice potențiale în timpul CRRT anticoagulant cu citrat
- monitorizarea biochimică a pacienților cărora li se administrează CRRT anticoagulant cu citrat
leziuni renale Acute
leziuni renale Acute (AKI), un sindrom clinic cu multe cauze posibile, este pur și simplu definit ca o scădere bruscă a funcției renale pe o perioadă de ore sau zile, evidențiată de creșterea recentă a concentrației serice a creatininei și/sau reducerea cantității de urină .
este diferită de boala renală cronică (IRC) în care scăderea funcției renale este progresivă lent, dar ireversibil, apărând pe o perioadă de luni și ani. AKI poate apărea, desigur, la cei cu CKD subiacent, iar un diagnostic de AKI este asociat cu un risc mai mare decât normal al unui eventual diagnostic de CKD .
liniile directoare convenite la nivel internațional afirmă că un diagnostic de AKI poate fi pus dacă:
• creatinina serică crește cu 0,3 mg/dL (26,5 mm/l) în decurs de 48 de ore; sau
• a existat o creștere de 50% sau mai mare a creatininei serice în ultimele 7 zile; sau
• volumul de urină este
AKI cuprinde întregul spectru de severitate dintr-o scădere ușoară a funcției renale (Etapa 1 AKI) la insuficiență renală (Etapa 3 Aki). Stadializarea depinde de măsurarea creatininei serice, cu sau fără date de ieșire a urinei (tabelul I)
|
etapa |
creatinină serică |
producția de urină |
|
1 |
1.5-1.9 ori valoarea inițială |
timp de 6-12 ore |
|
2 |
2.0-2.De 9 ori valoarea inițială |
⩾ 12 ore |
|
3 |
3.0 ori valoarea inițială |
pentru 24 ore |
tabelul I: cele trei etape ale severității AKI (din ref 1)
cauzele AKI sunt clasificate în mod convențional în trei rubrici: prerenal; renal (intrinsec); și postrenal, subliniind faptul că AKI poate avea o etiologie renală specifică, dar poate rezulta și din problema primară în afara rinichiului.
orice afecțiune care are ca efect reducerea fluxului sanguin către rinichi (perfuzie renală) este o cauză potențială a AKI prerenal; aceste afecțiuni includ: hipovolemie datorată vărsăturilor, diareei, hemoragiei, arsurilor sau șocului septic; și scăderea debitului cardiac datorită, de exemplu, insuficienței cardiace și insuficienței hepatice (ciroză). Cauza majoră a AKI intrinsecă este necroza tubulară renală, rezultată din ischemia renală sau ingestia de medicamente/toxine nefrotoxice.
sepsisul, cea mai frecventă cauză a AKI la bolnavii critici, se datorează parțial leziunilor renale intrinseci slab definite, asemănătoare necrozei tubulare renale . În cele din urmă, AKI postrenal rezultă din orice afecțiune care obstrucționează fluxul de urină distal de rinichi; acestea includ: pietre renale (calculi); boala prostatei (tumoră/hipertrofie); disfuncția vezicii urinare; și strictura uretrală.
Managementul AKI – terapii de substituție renală pentru AKI
nu există un tratament specific pentru AKI și managementul este în mare măsură de susținere cu tratament îndreptat spre cauza de bază. Retragerea medicamentelor nefrotoxice, resuscitarea fluidelor și corectarea tulburărilor electrolitice și acido-bazice fac parte din acest management general de susținere . Poate fi necesară administrarea de medicamente vasopresoare sau inotrope pentru a restabili tensiunea arterială normală și debitul cardiac.
terapia de substituție renală (RRT), punctul central al acestui articol, reprezintă tratamentul de ultimă instanță pentru pacienții cu AKI severă care nu răspunde la tratamentul conservator de susținere. Aproximativ 23% dintre pacienții cu terapie intensivă cu AKI (adică aproximativ 13% din toți pacienții cu terapie intensivă) primesc RRT .
terapia de substituție renală (RRT) este termenul generic pentru toate tratamentele care încearcă să înlocuiască funcția renală. Transplantul de rinichi donator la cei cu boală renală în stadiu final poate fi considerat RRT final , dar termenul este mai des rezervat acelor terapii care înlocuiesc filtrarea sângelui și funcțiile homeostatice ale rinichiului prin dializă, un proces care utilizează o membrană semipermeabilă ca filtru de sânge. Două tipuri largi de RRT dialitic sunt disponibile pentru tratamentul AKI (și, de altfel, CKD în stadiul final): dializa peritoneală și hemodializa.
în schimb, hemodializa implică filtrarea sângelui într-o mașină din afara corpului (extracorporeală). Sângele este pompat în filtru/dializator, unde produsele reziduale și excesul de lichid sunt îndepărtate și apoi returnate în organism. Acest circuit extracorporal (aparatul de dializă și tuburile sale de legătură de la și înapoi la pacient) este un mediu procoagulant.
hemodializă, hemofiltrare și hemodiafiltrare
mașinile moderne de dializă au opțiunea de hemofiltrare (HF), precum și hemodializă (HD), permițând posibilitatea a trei modalități dialitice diferite pentru tratamentul AKI: hemodializă (HD); hemofiltrare (HF); și hemodiafiltrare (HDF).
în centrul tuturor celor trei modalități se află membrana semipermeabilă care constituie un filtru de sânge. Pe măsură ce sângele pompat de la pacient curge pe o parte a acestei membrane, excesul de apă și reziduurile dizolvate trec prin membrană. Filtratul sau efluentul este pompat la deșeuri pe măsură ce sângele filtrat este returnat pacientului.
procesul de hemodializă (HD) implică utilizarea unui fluid de dializă care curge continuu și contracurent în sânge pe cealaltă parte a membranei. Compoziția și debitul fluidului de dializă asigură un gradient de concentrație constant pe membrana semipermeabilă în ceea ce privește substanțele dizolvate din sânge. La rândul lor, acești gradienți de concentrație facilitează difuzia controlată a moleculelor dizolvate pe membrană.
pentru substanțe dizolvate precum ureea și creatinina, care trebuie îndepărtate din sânge, gradientul de concentrație este astfel încât direcția de difuzie este de la sânge la lichidul de dializă, în timp ce pentru substanțe dizolvate precum bicarbonatul, care trebuie adesea adăugate în sânge pentru a corecta acidoza asociată cu AKI severă, lichidul de dializă cu concentrație mare de bicarbonat în raport cu sângele asigură că difuzia este în direcția opusă, de la lichidul de dializă la sânge. Ajustarea compoziției lichidului de dializă și a debitului permite astfel corectarea metabolică specifică pacientului.
excesul de lichid este adesea o caracteristică a AKI care este corectată în timpul hemodializei. Acest lucru se realizează prin ultrafiltrare, care depinde de gradientul de presiune hidrostatică care există pe membrana semipermeabilă. Presiunea hidrostatică pozitivă relativă pe partea sanguină a membranei “împinge” eficient apa din sânge în lichidul de dializă.
această ultrafiltrare facilitează, de asemenea, trecerea moleculelor de solut, care sunt trase împreună cu apa în timpul ultrafiltrării printr-un mecanism numit convecție de solut (sau tragere de solvent). Efectul combinat al difuziei solutului, convecției solutului și ultrafiltrării în timpul hemodializei are scopul de a asigura că volumul și compoziția fluidului atât în compartimentul extracelular, cât și în cel intracelular sunt restabilite, cât mai aproape posibil, de ceea ce se referă la cei cu rinichi care funcționează normal.
Hemodiafiltrarea (HDF) este combinația dintre HF și HD. Permite clearance-ul optim al substanțelor dizolvate cu greutate moleculară mică prin difuzie în lichidul de dializă, combinat cu clearance-ul optim al substanțelor dizolvate cu greutate moleculară mare prin convecție și ultrafiltrare. Ca și în cazul HF, HDF necesită lichid de înlocuire continuu; și ca și în cazul HD, HDF necesită lichid de dializă.
inițierea și calendarul RRT pentru AKI – intermitent versus RRT continuu
toate terapiile de substituție renală (PD, HD, HF și HDF) pot fi administrate intermitent (adică de obicei în 3-4 sesiuni orare) sau continuu până la restabilirea funcției renale. Pentru pacienții cu insuficiență renală în stadiu final, care necesită RRT pe viață (cronică), tratamentul este exclusiv hemodializă intermitentă (IHD), livrată aproape invariabil în patru sesiuni orare, de trei ori pe săptămână .
pacienții cu AKI au doar o cerință temporară pentru RRT pentru a susține funcția renală în timpul rezoluției bolii critice/acute care a precipitat AKI. Durata medie a RRT la pacienții cu AKI este de aproximativ 13 zile , deși în cazuri particulare poate fi necesară doar câteva zile sau se poate prelungi timp de mai multe săptămâni.
indicatorii tradiționali (absoluți) pentru inițierea RRT în AKI includ:
• hiperkaliemia (potasiu plasmatic > 6,0-6,5 mmol/L)
• uremie severă (uree plasmatică > 30 mmol/L)
• semne de encefalopatie uremică
• acidoză (pH • edem pulmonar acut
poate fi benefic să începeți tratamentul înainte ca aceste efecte extreme ale AKI să fie evidente, dar momentul optim pentru inițierea (și oprirea) RRT este în prezent neclar și subiectul cercetărilor în curs . În prezent, nu există date fiabile care să susțină un anumit tip de RRT pentru AKI și, prin urmare, au fost utilizate toate tipurile de RRT.
cu toate acestea , orientările actuale reflectă un consens că, indiferent de modalitate, RRT ar trebui să fie livrat continuu, mai degrabă decât intermitent, celor mai critici pacienți (instabili hemodinamic). Studiile recente indică faptul că în zilele noastre terapiile de înlocuire renală continuă (CRRT) sunt utilizate mult mai frecvent decât terapiile intermitente pentru AKI și că cel mai frecvent utilizat CRRT este hemofiltrarea venoasă venoasă continuă (CVVHF), urmată de hemodiafiltrarea venoasă venoasă continuă (CVVHDF).
anticoagularea în timpul terapiei de substituție renală continuă (CRRT)
CRRT, în comun cu toate celelalte terapii de substituție renală, cu excepția dializei peritoneale, implică pomparea sângelui printr-un circuit nonfiziologic, extracorporal. Proprietatea inerentă a sângelui de a coagula (coagula) la contactul cu suprafețele nefiziologice determină că, pentru a menține un circuit extracorporal “fără cheaguri”, sângele trebuie anticoagulat.
CRRT are o nevoie deosebită de anticoagulare, în comparație cu modalitățile intermitente, din cauza ședințelor de tratament prelungite și a ratei relativ lente la care sângele este pompat prin circuit . În plus, sângele pacienților care necesită CRRT este adesea deja într-o stare procoagulantă relativă din cauza bolii critice subiacente (de exemplu, sepsis) sau traume .
timp de mulți ani heparina, fie heparina nefracționată (UF), fie heparina cu greutate moleculară mică (LMWH), a fost singurul anticoagulant utilizat în procedurile dialitice, inclusiv CRRT. Heparina continuă să fie utilizată; este un mijloc ieftin și, în general, sigur de anticoagulare pentru majoritatea pacienților care necesită RRT.
cu toate acestea, anticoagularea sistemică cu heparină, care nu poate fi evitată, implică în mod inevitabil un risc crescut de sângerare, astfel încât anticoagularea cu heparină în timpul procedurilor dialitice este absolut contraindicată celor care sângerează în prezent sau prezintă un risc mai mare decât normal de sângerare.
în plus, heparina poate, într-o mică minoritate (
potențialele sângerări și riscurile HIT-II asociate cu utilizarea heparinei au evidențiat necesitatea unui anticoagulant alternativ pentru unii pacienți care necesită RRT. Citratul a oferit o astfel de alternativă. Anticoagularea regională cu citrat a circuitului de dializă, utilizată pentru prima dată cu succes la începutul anilor 1980 , a fost rezervată inițial acelei mici minorități de pacienți pentru care heparina este contraindicată. Acest lucru s-a schimbat odată cu rezultatele studiilor controlate randomizate care au comparat CRRT anticoagulant cu heparină cu CRRT anticoagulant cu citrat; acestea au demonstrat că citratul este atât un anticoagulant mai eficient, cât și mai sigur decât heparina .
citratul a apărut, prin urmare, în ultimii ani ca anticoagulant de alegere pentru toți pacienții cu AKI care necesită CRRT . Unitățile de terapie intensivă din întreaga lume raportează acum trecerea de la heparină la anticoagularea citratului regional pentru CRRT . Unele autorități recomandă chiar utilizarea citratului mai degrabă decât anticoagularea heparinei pentru hemodializă intermitentă (cronică) (IHD).
citrat – mecanismul acțiunii sale anticoagulante și aplicarea sa în CRRT
citrat, care a fost utilizat pentru anticoagularea/conservarea sângelui donat pentru transfuzie de mai bine de un secol , împiedică coagularea sângelui prin capacitatea sa de a lega (chelat) calciul ionizat (iCa) care circulă în plasma sanguină. Acest iCa este un cofactor necesar atât pentru agregarea plachetară, cât și pentru mai mulți pași cheie în căile de coagulare intrinseci și extrinseci care sunt responsabile de producerea fibrinei și, prin urmare, de formarea cheagurilor de fibrină.
coagularea sângelui este prevenită prin reducerea concentrației plasmatice a iCa la aproximativ 0, 35 mmol/l (interval normal al ref 1, 15-1, 30 mmol/l). Această stare non-fiziologică, sever hipocalcemică, se realizează prin creșterea concentrației plasmatice de citrat la aproximativ 3 mmol/L (concentrație normală de citrat plasmatic ~0,1 mmol/l ).
deși există diferențe detaliate prezentate de Morabito și colab., toate protocoalele pentru anticoagularea citratului în timpul CRRT implică perfuzia continuă de soluție care conține citrat (de obicei fie citrat trisodic, fie soluție acid-citrat-dextroză (ACD)) la linia de prefiltru/dializă, aproape de locul în care părăsește pacientul, fie ca soluție separată, fie combinată cu lichid de înlocuire a prediluției. Debitul acestei perfuzii este ajustat pentru a obține o concentrație de citrat din sânge de ~3 mmol/L și, prin urmare, o iCa plasmatică de aproximativ 0, 35 mmol/L.
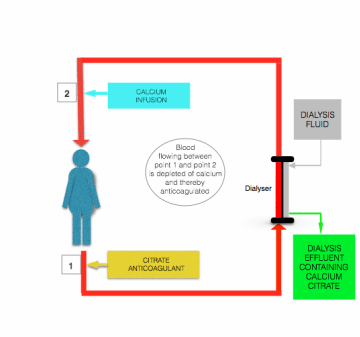
hipocalcemia indusă de perfuzia cu citrat este corectată înainte ca sângele să revină la pacient, prin perfuzarea soluției care conține calciu (clorură de calciu sau gluconat de calciu) la linia postfilter aproape de locul în care intră în pacient (vezi figura de mai sus).
avantajul major de siguranță al anticoagulării cu citrat față de anticoagularea cu heparină este că anticoagularea este limitată la circuitul extracorporal. Această așa-numită “anticoagulare regională” se realizează deoarece cea mai mare parte a citratului infuzat este îndepărtată (fie ca anioni citrați, fie ca chelat de citrat de calciu) din sânge în timpul trecerii prin filtru/dializor .
orice citrat rămas în sângele postfiltru este diluat în circulația sistemică și metabolizat rapid în dioxid de carbon și apă prin ciclul Krebs dependent de oxigen în mitocondriile celulelor tisulare (predominant celulele hepatice ).
metabolismul citratului este asociat cu producerea de bicarbonat: pentru fiecare citrat de 1 mmol metabolizat, se generează 3 mmol bicarbonat. Clearance-ul rapid al citratului (timpul de înjumătățire plasmatică al citratului în sânge este în mod normal de aproximativ 5 minute ) pe această cale în principal hepatică asigură în mod normal absența anticoagulării sistemice în timpul CRRT și, prin urmare, niciun risc suplimentar de sângerare.
tulburări metabolice potențiale în timpul CRRT anticoagulant cu citrat
reticența aparentă de a îmbrățișa complet CRRT anticoagulant cu citrat pentru toți pacienții cu AKI până de curând a fost atribuită îngrijorării cu privire la tulburările acido-bazice și electrolitice care pot apărea la pacienții cărora li se administrează tratamentul .
următoarele tulburări electrolitice și acido-bazice au fost raportate la pacienții cărora li s-a administrat CRRT anticoagulant cu citrat : • hipomagnezie/hipermagnezie
• hiponatremie/hipernatremie
• alcaloză metabolică
• acidoză metabolică
aceste tulburări pot apărea din mai multe motive, dar acumularea de citrat în circulația periferică (toxicitatea citratului) poate fi esențială pentru majoritatea acestor tulburări. Motivele pentru care citratul se poate acumula în timpul CRRT includ:
• metabolizarea afectată a citratului din cauza bolii hepatice și/sau reducerea cantității de oxigen din cauza perfuziei inadecvate (de exemplu. în șoc septic/cardiogen)
• reducerea progresivă a permeabilității membranei în timpul dializei cu filtrarea redusă a citratului și creșterea concomitentă a livrării de citrat în circulația sistemică
• eroare operațională – rata crescută accidentală a perfuziei de citrat în circuitul extracorporal și creșterea concomitentă a livrării de citrat în circulația sistemică
• transfuzia produsului sanguin – conservantul citrat prezent în produsele din sânge adaugă la sarcina citratului în circulația sistemică care rezultă din CRRT
indiferent de cauză, acumularea de citrat în circulația periferică poate duce la chelarea citratului de calciu ionizat circulant, cu o concentrație de calciu ionizat în plasmă redusă (hipocalcemie). Dacă hipocalcemia suficient de severă poate provoca aritmie cardiacă și, în cele din urmă, stop cardiac .
deși calciul ionizat plasmatic este redus în timpul acumulării de citrat (toxicitate), calciul total este crescut (indicând hipercalcemie), deoarece calciul legat de citrat este inclus în calciul total măsurat. O creștere a raportului dintre total și calciu ionizat (în mod normal 2,0) la > 2.1 s-a dovedit a fi cel mai fiabil semnal al toxicității citratului în absența estimării citratului plasmatic disponibile în mod obișnuit .
riscul de creștere a sodiului plasmatic (hipernatremie) asociat anticoagulării citratului se datorează conținutului ridicat de sodiu (hipertonicitate) al unor soluții de citrat utilizate în CRRT. De exemplu, soluția 4% de citrat trisodic care este utilizată în unele protocoale conține sodiu la o concentrație de 420 mmol/L. în practică, utilizarea fluidelor hipotonice de dializă/înlocuire poate atenua acest risc, iar hipernatremia este, din toate punctele de vedere, o complicație rară a anticoagulării citratului .
riscul de hipomagnezie (magneziu seric redus) în timpul anticoagulării citratului reflectă faptul că, în comun cu calciul, magneziul este un ion bivalent care se poate lega și de (chelat) citrat. Dacă pierderile de magneziu datorate acțiunii de chelare a citratului nu sunt complet compensate de magneziu în fluidele de dializă/înlocuire, poate apărea hipomagnezie .
monitorizarea biochimică a pacienților cărora li se administrează CRRT anticoagulant cu citrat
testarea punctului de îngrijire utilizând un analizor de gaze din sânge amplasat în unitatea de terapie intensivă permite măsurarea rapidă și convenabilă a majorității parametrilor (calciu ionizat, pH, bicarbonat, exces de bază, sodiu și lactat), dar estimarea calciului total și a magneziului seric nu sunt de obicei disponibile pe aceste platforme și probele trebuie trimise la laborator pentru aceste măsurători.
două studii recente oferă dovezi că unele analizoare de gaze din sânge pot să nu fie fiabile în măsurarea calciului ionizat la concentrații extrem de scăzute, non-fiziologice (~0.3 mmol / L) prezente în sângele postfilter, deși capacitatea lor de a măsura cu precizie calciul ionizat plasmatic în circulația sistemică (unde concentrația este mult mai mare) nu este pusă la îndoială.
|
parametru măsurat |
interval de monitorizare |
valori țintă sau aprox. intervale de referință |
scopul măsurării |
acțiuni corective în afara țintei |
|
concentrația de calciu ionizat postfilter (iCa), adică sânge prelevat din portul postfilter. |
în decurs de 1 oră de la început și după orice modificare a dozei de citrat, apoi la fiecare 4-6 ore |
0.25-0.35 mmol / L |
|
ajustarea dozei de citrat: crește dacă iCa > 0, 35, scade dacă iCa |
|
calciu ionizat sistemic (iCa), adică sânge prelevat de la pacient |
linia de bază( înainte de a începe), apoi la 1 oră după pornire, apoi cel puțin la fiecare 4-6 ore |
1.15-1.30 mmol / L |
|
ajustarea vitezei de perfuzare a calciului; crește dacă iCa 1.30 |
|
calciu total sistemic (TotCa), adică. sânge prelevat de la pacient (TotCa = iCa + calciu legat de albumină + calciu legat de citrat) |
cel puțin la fiecare 12-24 ore (trebuie să fie simultan cu estimarea sistemică a calciului ionizat) |
necesară numai pentru determinarea raportul totca: iCa (a se vedea mai jos) |
||
|
raportul dintre total și calciu ionizat (TotCa:iCa) |
cel puțin la fiecare 12-24 de ore |
pentru a detecta acumularea/toxicitatea citratului numită uneori “blocare citrat” |
opțiunile includ:
|
|
|
analiza gazelor arteriale din sânge
|
linia de bază (înainte de a începe) . în decurs de 1 oră de la pornire, apoi cel puțin la fiecare 4-6 ore. |
pH 7, 35-7, 45 bicarb 23-28 mmol/l BE–2-+3 mmol / L |
pentru a detecta tulburări acido-bazice: alcaloză metabolică acidoză metabolică |
opțiunile în cazul alcalozei metabolice includ:
|
|
sodiu seric |
o dată pe zi |
135-145 mmol / L |
pentru a detecta hipernatremia / hiponatremia |
apariție rară-verificați dializa corectă / lichidul de înlocuire |
|
lactat seric |
la momentul inițial( înainte de a începe), apoi în funcție de necesitățile clinice |
pentru a ajuta la identificarea celor care sunt la risc de toxicitate citrat |
luați în considerare, împreună cu raportul totca:iCa, riscul de toxicitate a citratului |
|
|
magneziu seric |
cel puțin o dată pe zi |
pentru a detecta hipomagnezia |
corecție cu infuzie de magneziu |
tabelul II: monitorizarea biochimică în timpul CRRT anticoagulant cu citrat (Ref 24)