canale și transportoare de ioni de clorură: de la curiozități ale naturii și sursa bolilor umane la ținte de droguri
postat: 20 August 2013 | |
la începutul studiilor universitare, elevul este introdus în diferite tipuri de proteine membranare integrale: receptori, proteine de adeziune, canale ionice, pompe ionice și transportori de ioni. Pe măsură ce progresează prin studiile lor, ei află că familiile de gene discrete și structurile proteice sunt responsabile pentru aceste clase diferite de proteine și nu există niciodată niciun motiv să se considere că ar putea exista vreo ambiguitate în atribuirea unei anumite proteine clasei sale de proteine adecvate.
acest lucru satisface practic fiecare caz de la clasă la laboratorul de cercetare până când luăm în considerare canalele de clorură. Știm că există, sunt importante și ar putea face ținte bune de droguri în mai multe domenii ale bolii, dar până de curând, ele au rămas oarecum stigmatizate și demodate în lumea terapeutică. Lipsa liganzilor selectivi nu a ajutat deloc. Singura excepție de la aceasta a fost GABA-un receptor care este cuplat la un canal de clorură intrinsecă care se deschide la legarea neurotransmițătorului inhibitor GABA. Benzodiazepinele potențează acest receptor încă de când Valiul a devenit disponibil în anii 1960, oferind efecte sedative și anticonvulsivante. Aceasta introduce un concept important: există mai multe familii de gene și diferite tipuri de proteine care pot fi descrise ca fiind canale de clorură.
acest lucru este în contrast cu ceea ce înțelegem despre canalele ionice selective de cationi, unde există puțină flexibilitate în structura proteinei care poate forma un por selectiv pentru potasiu, sodiu sau calciu; diversitatea acestor canale ionice este cauzată de variațiile domeniilor proteice distincte de pori care influențează comportamentul de deschidere-închidere. Pentru a fi corect, nu par să existe multe motive fiziologice pentru care un canal anionic ar trebui să prezinte selectivitate de clorură, deoarece există un rol fiziologic redus în transportul membranei altor halogenuri sau anioni mici; orice canal anionic va fi în mod implicit un canal de clorură din punct de vedere fiziologic. Pe de altă parte, curenții de membrană de potasiu, sodiu și calciu joacă fiecare roluri fundamentale diferite, iar permeabilitatea selectivă a membranei la acești cationi este crucială pentru funcția celulară și într-adevăr pentru viața însăși.
receptorii GABA-A sunt membri ai familiilor de canale ionice cu ligand pentameric CYS-loop, care includ mai multe tipuri de canale cu neurotransmițător excitator și inhibitor. Proteina de reglare transmembranară a fibrozei chistice (CFTR) este un canal de clorură reglat de nucleotide. Este un membru al diversei casete de legare ATP (ABC) transportor familie și este singurul care nu pare să transporte niciun substrat pe o membrană, ci mai degrabă funcționează ca un canal de clorură. Familia CLC de canale de clorură cu tensiune apar dintr-o altă familie de gene distincte și au o structură generală unică printre proteinele membranare. Această familie de proteine a adus multe surprize în ultimii 30 de ani, iar membrii acestei familii vor fi introduși aici și, de asemenea, cum ar putea fi considerați ținte de droguri.
alte evoluții interesante din domeniul canalelor de clorură au apărut în urma identificării moleculare a proteinelor care stau la baza canalelor de clorură activată de calciu (ClCa). Funcțional, știm despre rolurile lor fiziologice de ceva timp, dar identificarea moleculară recentă a proteinelor de canal a permis dezvoltarea instrumentelor moleculare și farmacologice pentru a le sonda și modifica activitatea. Această revizuire se concentrează asupra potențialului farmacologic al direcționării canalelor ClCa și a proteinelor CLC; funcția și localizarea lor subcelulară sunt rezumate în Figura 1.
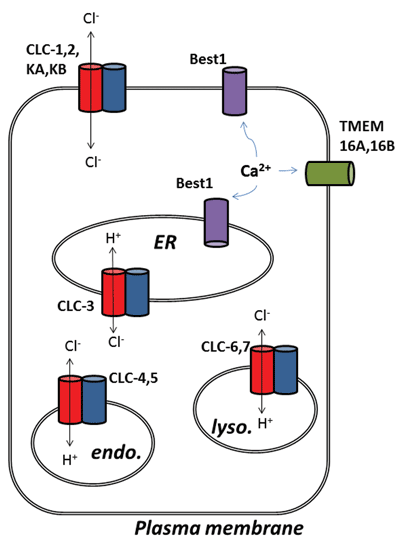
Figura 1
o introducere în proteinele CLC
cei nouă membri ai acestei familii de proteine sunt CLC-1 până la 7, CLC-KA și KB. Membrul fondator, CLC-1, este canalul de clorură de tensiune al mușchilor scheletici și va fi discutat mai jos. Multe studii funcționale au fost efectuate pe un omolog cu titlul onorific de CLC-0, izolat de organul electric Electroplax, care permite razei să-și uimească victimele acvatice. Reconstituirea CLC-0 în bistraturi lipidice și înregistrarea electrofiziologică a curenților care curg prin canale ionice unice au relevat o proprietate interesantă. De obicei, atunci când se înregistrează curentul dintr-un mic plasture de membrană care conține un singur canal ionic, se observă fluctuații între două amplitudini de curent: una reprezentând canalul închis și cealaltă reprezentând curentul care curge prin canalul deschis. Fluctuațiile reflectă tranzițiile dintre stările cinetice deschise și închise. Cu CLC-0, totuși, era evident că proteina cu un singur canal ionic consta din doi pori echivalenți care se puteau deschide independent1. Prin urmare, acest canal a fost descris ca fiind dublu-barrelled (Figura 2). Astfel, nu a fost o mare surpriză faptul că structurile cristaline ale omologilor din bacteriile enterice au dezvăluit că complexul proteic era un dimer, fiecare subunitate posedând o cale de conducere a ionilor2 (Figura 2).
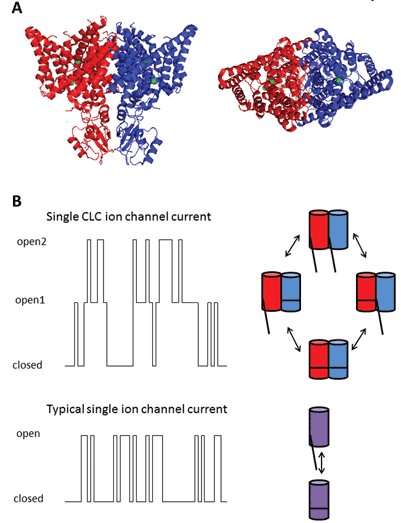
Figura 2
a doua surpriză a apărut atunci când au fost efectuate experimente funcționale detaliate pe CLC-ec1 de la E. coli. În loc să funcționeze ca un canal de clorură, la fel ca ruda sa pierdută de mult în mușchiul scheletic vertebrat, CLC-ec1 este un transportor de schimb 2CL-/H+ sau antiporter, cu stoichiometrie de schimb strictă 2:13. Această proteină este importantă pentru supraviețuirea bacteriilor enterice la pH4 scăzut și este probabil să exploateze un gradient de clorură pentru a menține pH-ul celular la un nivel tolerabil. Prin urmare, CLC procariote ar putea fi ținte pentru inhibitori pentru tratarea infecției patogene cu E. coli sau Salmonela4. Descoperirea comportamentului de schimb ionic a stimulat în mod natural eforturi suplimentare pentru a determina dacă oricare dintre aceste schimburi clorură-proton a existat la CLC-urile de mamifere, presupunând că schimbul Cl–/H+ ar putea fi adevărata funcție a CLC-urilor arhetipale, iar cele identificate ca canale de clorură ar putea fi doar excepții de la regulă. Acest lucru pare să fie cazul, deoarece există dovezi puternice că CLC-3 până la CLC-7 funcționează ca transportori de schimb 2Cl–/H+, care locuiesc în principal în organele intracelulare, în timp ce CLC-1, CLC-2, KA și KB sunt adevărate canale ionice conductoare de clorură de membrană plasmatică 5-9. Deoarece proprietatea CLC arhetipală este transportul de schimb, fiind găsit în toate formele de viață celulară, ultima subclasă de proteine, canalele de clorură de bună credință, pot fi, prin urmare, considerate transportoare de clorură rupte, care au pierdut cuplarea transportului de clorură la mișcarea unui al doilea Ion substrat.
CLC-1
acest fondator al familiei CLC este canalul de clorură cu tensiune al mușchilor scheletici și servește la reglarea potențialului membranei și la repolarizarea membranei după potențialele de acțiune pentru relaxarea mușchiului. În majoritatea țesuturilor, ne-am aștepta ca canalele de potasiu să joace acest rol, ceea ce fac în mușchiul cardiac și neted, precum și reglarea excitabilității membranei în alte tipuri de celule. Sistemul tubular transversal este o extensie a membranei plasmatice (sarcolemma) și pătrunde în țesutul contractil. Este esențial pentru răspândirea rapidă a activității electrice în mușchi și orchestrează contracția rapidă și controlată. Efluxul de potasiu din celulele musculare în spațiul închis al tubului t ar crește concentrația extracelulară de potasiu și ar restrânge acest gradient de ioni, ceea ce ar duce la depolarizarea prelungită a membranei. Cu canalele de clor care joacă rolul predominant de repolarizare, acest lucru este prevenit. Pierderea mutațiilor funcționale la CLC-1 duce la miotonie la om, capre și șoareci (pentru o analiză recentă, Vezi 10) și se caracterizează prin afectarea relaxării musculare, în concordanță cu pierderea unui curent de membrană repolarizantă.
cu expresia limitată la mușchiul scheletic, CLC-1 ar putea fi o țintă atractivă pentru medicamentele care controlează contracția musculară prin creșterea sau scăderea funcției CLC-1 și, prin urmare, reduc sau cresc excitabilitatea musculară. Compușii care cresc funcția CLC-1 ar putea fi capabili să trateze miotonia, în special în cazurile în care ar putea compensa pierderea parțială a activității canalului de clorură. Inhibarea CLC-1 ar putea reduce pragul de contracție musculară și poate fi utilă în cazurile de slăbiciune musculară sau boli degenerative, cum ar fi distrofia musculară.
CLC-2
canalul de clorură rectificator interior, CLC-2, are o distribuție tisulară oarecum răspândită. Poate fi găsit în neuronii centrali unde reglează activitatea neuronală11-13. În astrocite, direcționarea sa subcelulară către joncțiunile celulare este reglementată de o interacțiune cu GlialCAM (MLC1), mutații în care perturbă această direcționare și provoacă leucoencefalopatie14 megalencefalic. Interesele terapeutice recente implică expresia CLC-2 în mucoasa intestinală și bronhiolele pulmonare, unde joacă un rol în secrețiile intestinale și, respectiv, pulmonare. Lubiprostone, un medicament utilizat clinic pentru ameliorarea constipației, a fost propus să-și exercite efectul prin activarea CLC-2, dar acest efect este controversat. În timp ce acest compus activează canalele CLC-2 în unele studii, în altele reglează traficul CLC-2 și crește funcția CFTR prin activarea receptorilor de prostaglandină15,16. Cu toate acestea, există suficiente dovezi că creșterea funcției CLC-2 a căilor respiratorii ar putea oferi o cale alternativă de clorură în fibroza chistică17.
CLC-KA/KB
aceste canale de clorură sunt exprimate în special în epiteliile renale și contribuie la permeabilitatea membranelor celulare la fluxul pasiv de clorură. Acestea au un rol cheie în membrul ascendent și tubulii distali ai nefronului, oferind o cale bazolaterală pentru reabsorbția clorurii, în urma transportului din urina primară prin membrana apicală. Gena CLCKB, care codifică CLC-KB, este una dintre cele cinci gene care stau la baza sindromului Bartter. Mutațiile de pierdere a funcției în CLC-KB au ca rezultat o reabsorbție defectuoasă a clorurii și, prin urmare, conduc la o tulburare de risipire a sării, care este asociată cu poliuria. Una dintre principalele caracteristici ale persoanelor care sunt afectate de mutațiile CLC-KB (Bartter ‘ S type III) este tensiunea arterială scăzută. O formă mai severă a bolii este cauzată de mutații ale genei Bsnd (Bartter ‘ S type IV), care codifică Barttin, o proteină auxiliară importantă pentru traficul atât al CLC-KA, cât și al KB către membrana plasmatică.18. Această formă a tulburării include, de asemenea, surditate senzorială, despre care se crede că este cauzată de pierderea traficului de CLC-KA și KB către membranele epiteliale din urechea internă. Probabil, pierderea activității CLC-KA sau KB, dar nu ambele, poate fi tolerată de sistemul auditiv. Acest lucru sugerează că inhibitorii selectivi pentru CLC-KA sau CLC-KB, sau inhibarea parțială a ambelor, pot acționa ca un diuretic de buclă nou, cu potențial de scădere a tensiunii arteriale și cu puține efecte secundare. Acest lucru a condus la studiul farmacologiei lor și la dezvoltarea unor noi derivați de inhibitori cu afinitate micromolară scăzută19, care au avut efecte diuretice atunci când au fost administrați șobolanilor20. Pe de altă parte, medicamentele care activează canalele CLC-KB pot spori activitatea reziduală a canalelor defecte la pacienții de tip III Bartter.
CLC-7
din subclasa transportorului de schimb 2CL–/H+, CLC-7 este o țintă promițătoare pentru acțiunea medicamentului și inhibarea acestuia poate fi benefică în osteoporoză. Încă o dată, această indicație își are originea din observațiile bolii umane cauzate de mutațiile de pierdere a funcției în CLC-7, care provoacă osteropetroza21. În această tulburare, remodelarea osoasă de către osteoclaste este deficitară, despre care se crede că este cauzată de secreția defectă de acid și enzime. Acest lucru duce la os dens, care, dacă este reprodus de un inhibitor CLC-7,ar putea reduce dizolvarea osului și, prin urmare, ar întări scheletul pacienților cu osteoporoză22, 23. În studiile proof-of-concept, inhibarea farmacologică a acidificării24 sau întreruperea funcției CLC-7 de către anticorpi25 a redus resorbția osoasă. Cu toate acestea, inhibarea CLC-7 nu poate fi lipsită de complicații, deoarece studiile la om și la șoarece sugerează că lipsa funcției CLC-7 poate fi asociată și cu tulburări de stocare neuronală și degenerare din cauza funcției lizozomale reduse26.
pierderea funcției mutații umane-lecții din CFTR
merită o scurtă pauză în acest moment pentru a considera că unele dintre indicațiile terapeutice pentru noile medicamente vizate de CLC vizează tratarea tulburărilor distincte și la capătul opus al spectrului față de cele care sunt cauzate de funcția CLC defectă. În plus față de cele descrise mai sus, boala Dent I este o boală renală legată de X care este cauzată de pierderea funcției CLC-5 (a se vedea 27 pentru o revizuire recentă). Toate sunt tulburări moștenite rare și un defect proteic major implică fie o activitate redusă a proteinelor, fie traficul către membrana țintă. De fapt, multe mutații individuale determină retenția ER și lipsa maturării proteinelor. O paralelă ar putea fi făcută cu fibroza chistică, majoritatea persoanelor afectate posedând mutația er-reținută de la 508. Abordările recente și stratificate pentru tratarea fibrozei chistice au fost rezultatul unui atac cu două direcții pentru a corecta plierea proteinelor mutante (corectori CF) și/sau pentru a crește activitatea canalelor de clorură CFTR cu membrană plasmatică (potențiatori CF). Succesul apare cu clasa potențiatorului28, care sunt eficiente la pacienții cu mutații care reduc activitatea CFTR fără pierderea biosintezei proteinelor sau a traficului (de exemplu, G551D), totuși eficacitatea corectorilor de pliere (care este necesară în majoritatea cazurilor) rămâne de stabilit29. Deși bolile asociate cu pierderea funcției CLC sunt toate tulburări genetice rare, este posibil ca într-o zi să putem trata persoanele cu miotonie, sindromul Bartter, boala Dent și osteopetroza, precum și fibroza chistică cu medicamente care corectează cauza reală a tulburării lor.
canale de clorură activate de calciu
în cele din urmă, se va menționa canalele de clorură activată de calciu (ClCa), care au roluri fiziologice clar definite într-un număr de tipuri de celule, totuși identificarea lor moleculară a suferit câteva porniri false și bâlbâite. Povestea implică patru tipuri de proteine: membri ai clca, Bestrophin, Tweety și tmem16 familii de gene. În toate cazurile, supraexprimarea lor recombinantă a dus la generarea de curenți de clorură de membrană care sunt stimulați prin creșterea concentrației intracelulare de calciu și, în diferite proporții, prin depolarizarea membranei. Călătoria pentru CLCA s-a încheiat când s-a constatat că aceasta era o proteină care a fost secretată, dar, de asemenea, a reglat probabil expresia membranei canalelor ClCa endogene la sistemul de expresie30. Proteinele Tweety și bestrophin nu prezintă toate proprietățile canalelor ClCa studiate în țesuturile majore, deși Best1 apare responsabil pentru o componentă a ClCa în neuronii senzoriali31 și poate fi,de asemenea, un regulator important al eliberării calciului din reticulul endoplasmic32, 33. Trei studii independente au propus TMEM16A (numit și Ano1) ca candidat pentru o componentă majoră, dacă nu în întregime, pentru un canal de clorură activat de calciu34-36. Multe studii ulterioare, facilitate de generarea de instrumente moleculare, au susținut acest lucru. TMEM16A este important pentru reglarea excitabilității membranei în mușchiul neted vascular, este reglat în sus într-un model animal de hipertensiune pulmonară și tonul poate fi redus prin inhibarea canalului37,38. În neuronii senzoriali, tmem16a cuplează prezența mediatorilor inflamatori la hiperexcitabilitatea membranei și inhibarea TMEM16A are efecte antinociceptive39. La modelele animale de astm, expresia acestui canal de clor este crescută, iar inhibarea acestuia poate avea efecte benefice40. Se găsește, de asemenea, în celulele interstițiale ale Cajalului intestinului și funcția canalului este necesară pentru contracția ritmică a mușchiului neted în peretele intestinal41. În plus, activarea TMEM16A poate oferi o cale alternativă pentru secreția de clorură epitelială în fibroza chistică42. Deși există încă unele dezbateri în jurul funcției precise a restului familiei TMEM16, funcția ClCa a fost atribuită și TMEM16B (Ano2), despre care se crede că stă la baza canalului ClCa în celulele olfactive de păr43, 44. Pot exista, de asemenea, roluri pentru această clasă de canale ionice în biologia celulelor canceroase, iar inhibarea acesteia poate preveni proliferarea celulelor45-48.
concluzii
această revizuire a evidențiat diferitele roluri ale clorurii care conduc sau transportă proteinele și modul în care disfuncția lor este cuplată la tulburarea umană sau la simptomele asemănătoare bolii în modelele animale. Există o lipsă severă de reactivi farmacologici care inhibă, activează sau îmbunătățesc traficul cu membrană a canalelor de clorură și a transportorilor. Se înregistrează progrese cu medicamente care inversează funcția defectă a CFTR în fibroza chistică, ceea ce va duce, sperăm, la medicamente specifice diferitelor tipuri de mutații moștenite. Inhibitorii și activatorii canalelor de clorură activate de calciu tmem16a42, 49 se dovedesc a fi instrumente de laborator utile, iar noii compuși ar putea produce medicamente eficiente, în special dacă pot produce efecte specifice țesuturilor. Moleculele specifice pentru anumite CLC – uri sunt probabil cele mai evazive. Înțelegerea bazei structurale a activării CLC cu tensiune închisă50 ar putea identifica domeniile proteice care pot fi vizate prin proiectarea rațională a medicamentelor bazate pe structură. Astfel de instrumente ne vor permite să punem la încercare câteva dintre ideile terapeutice noi care au fost revizuite și prezentate aici.
biografia autorului

Dr. Jon Lippiat și-a finalizat doctoratul în structura, funcția și farmacologia canalelor de potasiu la Universitatea din Leicester. A studiat funcția celulelor beta pancreatice și diabetul la Universitatea din Oxford înainte de numirea sa ca lector în farmacologie la Universitatea din Leeds. Cercetările sale implică elucidarea proprietăților structurale și fiziologice ale mai multor tipuri diferite de canale ionice și transportoare și direcționarea potențială a acestora prin noi reactivi farmacologici.
problema
problema 4 2013
subiecte conexe
canale de clorură, ținte de droguri, canale ionice