frontiere în medicină
- Introducere
- pacienți și metode
- selecția pacienților în baza de date de supraveghere, Epidemiologie și rezultate finale
- analiză statistică
- rezultate
- caracteristicile pacientului
- risc îmbunătățit de stadiu T1 comparativ cu alte stadii T în contextul creșterii serice a CEA
- efectul creșterii CEA serică preoperatorie în stadiul T
- discuție
- Declarație privind disponibilitatea datelor
- declarație de etică
- contribuțiile autorului
- Conflict de interese
- mulțumiri
Introducere
cancerul Rectal este una dintre cele mai frecvente afecțiuni maligne la nivel mondial (1). Conform sistemului de stadializare al Comitetului mixt american pentru Cancer (AJCC), amploarea anatomică a tumorii primare (stadiul T) este unul dintre cei mai importanți predictori prognostici. Cu toate acestea, pacienții cu același stadiu t al cancerului rectal pot prezenta rezultate clinice considerabil diferite.
raportat pentru prima dată în 1965, antigenul carcinoembrionar (CEA) este o glicoproteină de 180-200 kDa și un membru al superfamiliei imunoglobulinelor (2). CEA este secretată de o varietate de tumori solide, inclusiv 90% din cancerele colorectale (3). Fiind cel mai important și mai fiabil biomarker prognostic seric în cancerul colorectal, nivelurile crescute de CEA preoperatorie se dovedesc a fi asociate cu prognosticul mai rău al cancerului colorectal (4-9).
studiile anterioare au demonstrat că CEA a fost asociată cu adeziunea celulelor canceroase și imunitatea înnăscută în cancerul colorectal. În plus, CEA a fost, de asemenea, raportată pentru a facilita atașarea celulelor canceroase colorectale la locurile de metastază și pentru a sprijini progresia tumorii (10-12).
în mod tradițional, răspândirea îndepărtată a celulelor tumorale a fost considerată un eveniment tardiv, totuși rezultatele mai multor studii anterioare au indicat că dobândirea potențialului metastatic ar putea avea loc în stadiul foarte timpuriu al progresiei tumorii (13-16). Wo și colab. (17) a raportat că o dimensiune foarte mică a tumorii implicată în pozitivitatea ganglionilor limfatici poate fi un surogat pentru biologia agresivă. Apoi suspectăm că cancerul rectal în stadiu foarte timpuriu cu creșterea CEA serică ar putea sugera dobândirea timpurie a potențialului metastatic și prezice o supraviețuire foarte slabă a cancerului rectal.
cu toate acestea, din cunoștințele noastre, puține studii au fost raportate pentru a investiga asocierea stadiului T și a nivelurilor serice CEA (C0 și C1) în determinarea prognosticului cancerului rectal. Prin urmare, efectuăm acest studiu amplu bazat pe populație pentru a examina dacă stadiul T foarte timpuriu în contextul creșterii serice a CEA poate fi un surogat pentru boala agresivă biologic și prezice supraviețuirea specifică cauzei (CSS) a cancerului rectal. Pentru a elimina efectul pozitivității ganglionilor limfatici asupra cercetării noastre, am exclus apoi pacienții cu noduri pozitive și am concentrat analiza pe pacienții din stadiul I-II.
pacienți și metode
selecția pacienților în baza de date de supraveghere, Epidemiologie și rezultate finale
ca sursă autoritară de informații privind incidența și supraviețuirea cancerului în SUA și o sursă cuprinzătoare de informații bazate pe populație, inclusiv toate cazurile de cancer nou diagnosticate care apar în zonele participante la supraveghere, Epidemiologie și rezultate finale (SEER), baza de date SEER cuprinde ~28% din populația americană. Baza de date SEER nu conținea identificatori și era disponibilă publicului pentru cercetători. SEER * Stat este un software furnizat de programul SEER pentru a obține informații despre pacient folosind accesul online. La început, sesiunea de listare a cazurilor software-ului SEER*Stat (SEER*Stat 8.3.5) a fost utilizată pentru a enumera toate informațiile legate de pacient, iar pacienții diagnosticați cu cancer rectal în stadiul I-II (nod–negativ) între 1 ianuarie 2004 și 31 decembrie 2015 au fost identificați din Baza de date SEER (Figura 1). Pacienții cu cancer Rectal au fost identificați prin codurile site-ului ICD-o-3 C199 și C209 și Codul de comportament 3 (articolele NAACCR 522 și 523) (9). Am ales să includem acești ani deoarece informațiile despre serul preoperator CEA au fost înregistrate începând cu 2004, iar urmărirea SEER s-a încheiat în 2015.

Figura 1. Diagrama de flux a definițiilor cohortei pacientului.
apoi, cei cărora li s-a administrat radioterapie neoadjuvantă, lipsa confirmării histologice pozitive, cu rasă necunoscută, histologii non-adenocarcinom sau urmărire neactivă au fost excluși din studiul nostru. În studiul nostru au fost incluși pacienți cu cea serică preoperatorie disponibilă, grupând “pozitiv / crescut” și ” negativ / normal; în limite normale ” ca C1 și C0 (informații C-stage). Valorile limită ale CEA au fost de 2, 5 ng/ml pentru nefumători și, respectiv, 5 ng/ml pentru fumători. În plus, următoarele variabile clinicopatologice ale pacientului au fost, de asemenea, preluate din Baza de date SEER: stadiul T, rasa, sexul, localizarea tumorii, vârsta la diagnostic, anul diagnosticului, gradul și histologia.
analiză statistică
în studiul de față, testul chi-pătrat al lui Pearson a fost utilizat pentru a compara toate variabilele clinicopatologice ale pacienților preluate din Baza de date SEER între nivelurile normale și cele crescute ale CEA serică preoperatorie. Unele modele de risc proporțional Cox multivariabile au fost construite pentru a identifica variabilele prognostice independente ale cancerului rectal în analizele noastre. Curbele de supraviețuire au fost generate folosind metoda Kaplan-Meier, iar diferențele dintre curbe au fost analizate prin testul log-rank. Rezultatele principale de interes în studiul de față au fost CSS și supraviețuirea globală (SG). CSS a fost calculat de la data diagnosticului până la data decesului specific cancerului. Decesele atribuite cancerului rectal au fost tratate ca evenimente, iar decesele din alte cauze au fost tratate ca observații cenzurate la data decesului. Pentru a determina dacă a existat o interacțiune semnificativă între nivelul CEA seric preoperator și stadiul T în prezicerea CSS, am definit și o variabilă de interacțiune (stadiul T și nivelul cea seric). P față-verso < 0,05 a fost considerată semnificativă statistic. Analizele statistice au fost efectuate în principal folosind versiunea SPSS 22 (IBM Corporation, Armonk, NY, SUA).
rezultate
caracteristicile pacientului
în general, 19184 de pacienți diagnosticați cu cancer rectal în stadiul I–II au fost identificați din Baza de date SEER între 1 ianuarie 2004 și 31 decembrie 2015 (Figura 1). Dintre acești pacienți, 13.007 (67,8%) pacienți au fost repartizați în stadiul C0, iar 6.177 (32,2%) pacienți au fost repartizați în stadiul C1. AJCC sistem de stadializare a sugerat că 6.077 de pacienți au fost în stadiul T1, 4.783 de pacienți în stadiul T2, 7.021 în stadiul T3 și 1.303 au fost în stadiul T4. Un total de 2.560 (13,3%) pacienți au murit de cancer rectal la sfârșitul perioadei de urmărire. Durata mediană de urmărire a întregii cohorte a fost de 44 luni (0-143 luni). Caracteristicile inițiale ale pacienților sunt rezumate în tabelul 1.
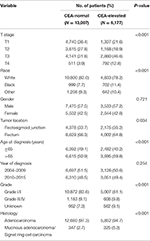
Tabelul 1. Compararea caracteristicilor inițiale ale cancerului rectal în stadiul I–II cu nivelul antigenului carcinoembrionar seric (CEA).
risc îmbunătățit de stadiu T1 comparativ cu alte stadii T în contextul creșterii serice a CEA
s-a constatat că stadiul C1 a fost mai probabil să se coreleze cu stadiul t mai mare, joncțiunea neagră, rectosigmoidă, vârsta înaintată, gradul superior și carcinomul cu celule cu adenocarcinom mucinos/inel Signet (Tabelul 1, P < 0,05). După cum se arată în tabelul 2, rasa, sexul, localizarea tumorii, vârsta la diagnostic, anul diagnosticului, gradul, histologia, stadiul T și nivelul CEA seric au fost incluse în analiza Cox multivariată. Când s–a efectuat analiza Cox multivariată, am convins următoarele caracteristici clinicopatologice ca factori prognostici independenți în stadiul I-II al cancerului rectal; acestea au inclus rasa, sexul, localizarea tumorii, vârsta la diagnostic, gradul tumorii, stadiul T și nivelul CEA seric, în timp ce riscul dintre T2, C0 și T1,C0 nu a fost diferența statistică (P = 0,925). S-a demonstrat că, în contextul creșterii serice a CEA, stadiul T1 a prezentat un risc neașteptat mai mare de mortalitate specifică cancerului rectal comparativ cu stadiile T2 și T3. În stadiul bolii T1, nivelul crescut al CEA serică a fost asociat cu un risc crescut de mortalitate cu 227,6% comparativ cu nivelul normal al CEA serică.

Tabelul 2. Analize de regresie Cox Multivariate ale supraviețuirii specifice cauzei (CSS) în stadiul I–II cancer rectal.
curbele de supraviețuire Kaplan–Meier sunt reprezentate grafic în figurile 2, 3. Rata CSS pe 5 ani a fost de 92,2% în T1C0, 75,2% în T1C1, 93,1% în T2C0, 86,7% în T2C1, 84,6% în T3C0, 76,3% în T3C1, 62,9% în T4C0 și 43,6% în T4C1 (Figura 2, P < 0,001). Prin urmare, T1C1 a prezentat o rată CSS similară de 5 ani comparativ cu T3C1 (75,2 față de 76,3%, P = 0,238). În plus, constatarea a fost și mai pronunțată în OS. Rata OS de 5 ani a fost de 78,6% în T1C0, 48,3% în T1C1, 77,1% în T2C0, 62,3% în T2C1, 68,5% în T3C0, 54,5% în T3C1, 45,3% în T4C0 și 30,0% în T4C1 (Figura 3, P < 0,001). T1C1 a prezentat o rată CSS semnificativ mai mică de 5 ani comparativ cu T3C1 (48,3 față de 54,5%, P < 0,001).
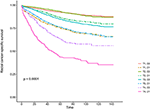
Figura 2. Curbele de supraviețuire specifice cauzei Kaplan–Meier (CSS) ale stadiului T combinate cu nivelul antigenului carcinoembrionar seric (CEA).
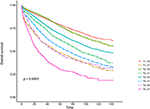
Figura 3. Curbele de supraviețuire globală (SG) Kaplan–Meier ale stadiului T combinate cu nivelul antigenului carcinoembrionic seric (CEA).
efectul creșterii CEA serică preoperatorie în stadiul T
parcela forestieră a fost trasată pentru a arăta ratele de risc (HRs) pentru a compara CSS între grupurile CEA normale și cele crescute în etapele t respective (Figura 4). Comparativ cu nivelul normal al CEA serică, în stadiul T2, nivelul crescut al CEA serică a fost asociat cu 69,0% risc crescut de mortalitate specifică cancerului rectal ; în stadiul T3, nivelul crescut al CEA serică a fost asociat cu 67,2% risc crescut de mortalitate specifică cancerului rectal (RR = 1,672, IÎ 95% = 1,486-1,882, P < 0,001); în stadiul T4, nivelul risc de mortalitate specifică cancerului rectal (RR = 1,813, IÎ 95% = 1,485-2,213, p < 0,001); în schimb, totuși, în stadiul T1, nivelul crescut al cea serică a prezentat chiar până la 211.Risc crescut cu 6% de mortalitate specifică cancerului rectal (RR = 3, 116, IÎ 95% = 2, 639-3, 679, P < 0, 001).
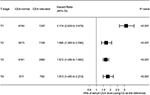
Figura 4. Ratele de risc (HRs) ale supraviețuirii specifice cauzei (CSS) între nivelul normal și cel crescut al antigenului carcinoembrionar seric (CEA) în funcție de stadiul T.
discuție
ne-am propus să investigăm asocierea stadiului T și a nivelurilor serice CEA în determinarea CSS a cancerului rectal. Am emis ipoteza că cancerul rectal cu stadiu T foarte timpuriu (stadiul T1) și creșterea CEA serică poate fi un surogat biologic pentru boala agresivă, prezicând astfel un rezultat oncologic slab. Cu aproximativ 20.000 de pacienți diagnosticați cu cancer rectal în stadiul I–II incluși în studiul nostru.
în acest studiu, s-a constatat că creșterea CEA serică a fost mai probabil să se coreleze cu stadiul t superior, joncțiunea neagră, rectosigmoidă, vârsta mai înaintată și carcinomul cu celule cu adenocarcinom mucinos și mucinos. Analizele de supraviețuire Kaplan–Meier au arătat că, în contextul creșterii serice a CEA, rata CSS la 5 ani a stadiului T1 a fost de 75,2%, ceea ce nu a atins diferența statistică față de stadiul T3 (76,3%). Când vine vorba de supraviețuirea globală, rata de OS de 5 ani a stadiului T1 cu creșterea CEA serică preoperatorie (48,3%) a fost chiar mai mică decât stadiul T3 implicat în creșterea CEA (54,5%) și nu a atins diferența statistică față de stadiul T4 (45.3%), ceea ce înseamnă că nivelul seric preoperator crescut al CEA ar putea identifica un subgrup de cancere rectale în stadiul T1 cu CSS similar comparativ cu unele boli în stadiul T3 și cu OS similar comparativ cu unele boli în stadiul T4.
după ajustarea pentru factorii prognostici cunoscuți ai cancerului rectal (rasă, sex, localizarea tumorii, vârstă la diagnostic, an de diagnostic, grad și histologie), variabila de interacțiune (stadiul T și nivelul CEA seric) pe care am definit-o a fost demonstrată a fi un factor prognostic independent al cancerului rectal. Analiza Cox multivariată a arătat că, în contextul creșterii CEA serică, stadiul T1 a prezentat un risc neașteptat mai mare de mortalitate specifică cancerului rectal comparativ cu stadiile T2 și T3. În stadiul bolii T1, nivelul crescut al CEA serică a fost asociat cu un risc crescut de mortalitate cu 227,6% comparativ cu nivelul normal al CEA serică. În plus, rasa, sexul, localizarea tumorii, vârsta la diagnostic și gradul tumorii au fost, de asemenea, identificate ca factori prognostici independenți ai cancerului rectal în stadiul I–II. În afară de T1, S-a constatat că creșterea CEA serică preoperatorie a prezentat riscuri cu ~75% mai mari de mortalitate specifică cancerului rectal în stadiul T respectiv, totuși numărul a crescut foarte mult la 211,6% în stadiul T1.
în 2000, grupul de lucru Colorectal al AJCC a propus includerea nivelului seric al CEA (stadiul C) în sistemul convențional de stadializare AJCC TNM al cancerului colorectal (18). Mai mult, societatea americană de Oncologie Clinică și Grupul European pentru markeri tumorali au susținut atât includerea nivelului seric preoperator CEA ca instrument de prognostic în cancerul colorectal (19-21).
mai multe cercetări anterioare au raportat nivelul CEA seric ca un rol prognostic puternic în cancerul de colon (4-7, 22-26). În 2011, Thirunavukarasu și colab. (25) a raportat că nivelul seric preoperator CEA a fost un biomarker prognostic independent al cancerului de colon, iar prognosticul a fost mai rău la pacienții cu CEA ridicată cu un stadiu inferior comparativ cu pacienții cu CEA scăzută cu un stadiu superior. În acest studiu, CEA ridicată a fost chiar considerată la fel de puternică ca pozitivitatea nodului pentru prezicerea rezultatelor oncologice slabe ale cancerului de colon.
cu toate acestea, puține studii se concentrează pe elucidarea rolului prognostic al nivelului seric CEA în cancerul rectal. În 2016, folosind și baza de date SEER, Tarantino și colab. (9, 27) au efectuat cele două investigații mari bazate pe populație, care au furnizat dovezi convingătoare că nivelul crescut al CEA serică preoperatorie a fost un predictor puternic al supraviețuirii generale și specifice cancerului în cancerul rectal. În 2018, Liu și colab. (8) a demonstrat că CEA serică preoperatorie a fost un factor prognostic independent al cancerului rectal, iar nivelul seric crescut al CEA a prezentat o supraviețuire evident mai slabă comparativ cu nivelul seric normal al CEA în stadiile I–IV. cu toate acestea, singurele două studii anterioare s-au concentrat pe investigarea rolului prognostic al nivelului seric preoperator al CEA nu au examinat asocierea nivelului CEA și a stadiului T în prezicerea rezultatelor tumorale ale cancerului rectal.
deși convențional arată că cancerul dobândește potențialul metastatic pas cu pas pe măsură ce cresc la o dimensiune mare (28), Cu toate acestea, unele studii anterioare au indicat că dobândirea potențialului metastatic ar putea apărea foarte devreme în progresia tumorii. O cercetare anterioară a demonstrat supraviețuirea extrem de slabă a dimensiunii foarte mici a tumorii atunci când este implicată în pozitivitatea ganglionilor limfatici (17). În plus, rezultatele cercetărilor noastre arată că creșterea nivelului seric preoperator CEA în stadiul foarte timpuriu (stadiul T1) cancerul rectal este asociat cu OS și CSS foarte slabe și poate fi un surogat al biologiei agresive. Credem că atât implicarea ganglionilor limfatici, cât și creșterea CEA serică sunt considerate ca dobândirea capacității metastatice. Studiul nostru, combinat cu cel al lui Wo și colab. susțin în mod constant ideea menționată mai sus că dobândirea potențialului metastatic ar putea avea loc foarte devreme în progresia tumorii, astfel asociată cu rezultate oncologice slabe, iar caracteristica biologică inițială este mai probabil să determine potențialul metastazelor îndepărtate în timpul progresiei cancerului, mai degrabă decât capacitatea metastatică acumulată (29).
mai mult, rezultatele studiului nostru au o semnificație clinică. În prezent, cancerul rectal în stadiul I este tratat numai cu rezecție chirurgicală radicală din cauza rezultatelor oncologice relativ favorabile. Cu toate acestea, aproximativ 10-15% dintre pacienți vor dezvolta recurența tumorii după rezecția radicală (30, 31). În studiul de față, se întâmplă să identificăm un subgrup de cancer rectal în stadiul T1 cu prognostic foarte slab comparativ cu restul cancerului rectal în stadiul I, ceea ce înseamnă că acele cancer rectal în stadiul T1 cu implicarea creșterii serice preoperatorii CEA ar trebui să atragă mai multă atenție oncologilor.
cu toate acestea, există două limitări în studiul nostru. Pe de o parte, acest studiu nu a inclus unii factori de prognostic cunoscuți ai cancerului rectal în analizele noastre, inclusiv starea de instabilitate a microsatelitului și complicațiile postoperatorii, care nu au fost disponibile din Baza de date SEER și ar putea introduce prejudecăți într-o oarecare măsură. Nu putem oferi intervale și valori medii ale CEA în ambele grupuri. Pe de altă parte, studiul de față a fost mai degrabă retrospectiv decât bazat pe date prospective. Prin urmare, constatările noastre trebuie încă validate în alte cohorte, în special în studii clinice prospective mari.
în concluzie, studiul nostru demonstrează că cancerul rectal în stadiul T1, atunci când este implicat în creșterea cea serică preoperatorie, poate fi un surogat al bolii biologic agresive și se corelează cu OS și CSS nefavorabile. Mai mult, acest subgrup de cancer rectal merită mai multă atenție clinică a oncologilor. Descoperirile noastre, dacă sunt validate în viitoarele studii de baze de date, ar oferi o nouă idee de terapie pentru cancerul rectal în stadiu incipient.
Declarație privind disponibilitatea datelor
seturile de date generate pentru acest studiu sunt disponibile la cerere autorului corespondent.
declarație de etică
pacienții din acest studiu au fost identificați din Baza de date SEER, iar aprobarea pentru utilizare a datelor a fost obținută printr-o cerere depusă la programul SEER. Aprobarea de către Comitetul de evaluare instituțională nu a fost necesară, deoarece baza de date SEER este disponibilă publicului.
contribuțiile autorului
SW și WG au adus o contribuție substanțială și directă la acest studiu și l-au aprobat pentru depunere.
Conflict de interese
autorii declară că cercetarea a fost realizată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
mulțumiri
această lucrare a fost susținută în parte de proiectul Planului de dezvoltare a științei și tehnologiei medicale din Yancheng (YK2015075).
1. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. statisticile globale ale cancerului 2018: estimările GLOBOCAN ale incidenței și mortalității la nivel mondial pentru 36 de tipuri de cancer în 185 de țări. Ca Cancer J Clin. (2018) 68:394–424. doi: 10.3322 / caac.21492
Rezumat PubMed / CrossRef Text Complet / Google Scholar
2. Aur P, Freedman așa. Demonstrarea antigenelor specifice tumorii în carcinoamele colonului uman prin tehnici de toleranță și absorbție imunologică. J Exp Med. (1965) 121:439–62. doi: 10.1084 / jem.121.3.439
PubMed Rezumat / CrossRef Text Complet / Google Scholar
3. Goldstein MJ, Mitchell EP. Antigenul carcinoembrionar în stadializarea și urmărirea pacienților cu cancer colorectal. Cancer Invest. (2005) 23:338–51. doi: 10.1081 / CNV-58878
rezumat PubMed / CrossRef Text Complet / Google Scholar
4. Becerra az, Probst CP, Tejani MA, Aquina CT, Gonz Unixtlez MG, Hensley BJ și colab. Evaluarea rolului prognostic al nivelurilor ridicate de antigen carcinoembrionar preoperator la pacienții cu cancer de colon: rezultate din Baza de date națională a cancerului. Ann Surg Oncol. (2016) 23:1554–61. doi: 10.1245 / s10434-015-5014-1
PubMed rezumat / CrossRef Text Complet / Google Scholar
5. Ogata Y, Murakami H, Sasatomi T, Ishibashi N, Mori S, Ushijima M, și colab. Creșterea nivelului seric de antigen carcinoembrionic preoperator poate fi un indicator eficient pentru necesitatea chimioterapiei adjuvante după rezecția potențial curativă a cancerului de colon în stadiul II. J Surg Oncol. (2010) 99:65–70. doi: 10.1002 / jso.21161
Rezumat PubMed / CrossRef Text Complet / Google Scholar
6. Quah HM, Chou JF, Gonen M, Shia J, Schrag D, Landmann RG, și colab. Identificarea pacienților cu cancer de colon în stadiul II cu risc ridicat pentru terapia adjuvantă. Dis Colon Rect. (2008) 51:503–7. doi: 10.1007 / s10350-008-9246-z
PubMed rezumat / CrossRef Text Complet / Google Scholar
7. Spindler BA, Bergquist JR, Thiels CA, Habermann EB, Kelley SR, Larson DW și colab. Încorporarea CEA îmbunătățește stratificarea riscului în cancerul de colon în stadiul II. J Gastrointest Surg. (2017) 21:770-7. doi: 10.1007 / s11605-017-3391-4
PubMed rezumat / CrossRef Text Complet / Google Scholar
8. Liu Q, Lian P, Luo D, Cai S, Li Q, Li X. Combinația antigenului carcinoembrionic cu Comitetul mixt american pentru cancer TNM stadializarea sistemului în cancerul rectal: un studiu bazat pe populație din lumea reală și mare. Onco Țintește Acolo. (2018) 11:5827–34. doi: 10.2147 / OTT.S171433
PubMed Rezumat / CrossRef Text Complet / Google Scholar
9. Tarantino I, Warschkow R, Schmied BM, G Oktorller U, Mieth M, Cerny T, și colab. Valoarea predictivă a CEA pentru supraviețuirea în stadiul I cancer rectal: o analiză bazată pe Scor de înclinație bazată pe populație. J Gastrointest Surg. (2016) 20:1213-22. doi: 10.1007/s11605-016-3137-8
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Beauchemin N, Arabzadeh A. Carcinoembryonic antigen-related cell adhesion molecules (CEACAMs) in cancer progression and metastasis. Cancer Metastasis Rev. (2013) 32:643–71. doi: 10.1007/s10555-013-9444-6
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Arabzadeh A, Chan C, Nouvion AL, Breton V, Benlolo S, DeMarte L, et al. Host-related carcinoembryonic antigen cell adhesion molecule 1 promotes metastasis of colorectal cancer. Oncogene. (2013) 32:849–60. doi: 10.1038 / onc.2012.112
PubMed Rezumat / CrossRef Text Integral / Google Scholar
12. Cai Z, Xiao J, El X, Ke J, Zou Y, Chen Y, și colab. Accesarea nouă semnificație prognostică a antigenului carcinoembrionic preoperator în cancerul colorectal care primește rezecția tumorii: mai mult decât pozitivă și negativă. Cancer Biomark. (2017) 19:161–8. doi: 10.3233 / CBM-160287
PubMed rezumat / CrossRef Text Complet / Google Scholar
13. Engel J, Eckel R, Kerr J, Schmidt M, F Inqustrstenberger G, Richter R, și colab. Procesul de metastazare pentru cancerul de sân. Eur J Cancer. (2003) 39:1794–806. doi: 10.1016 / S0959-8049(03)00422-2
PubMed rezumat / CrossRef Text Complet / Google Scholar
14. H oktsemann Y, Geigl JB, Schubert F, Musiani P, Meyer M, Burghart E, și colab. Răspândirea sistemică este un pas timpuriu în cancerul de sân. Celule Canceroase. (2008) 13:58–68. doi: 10.1016 / j.ccr.2007.12.003
PubMed Rezumat / CrossRef Text Integral / Google Scholar
15. K, YC, Jechlinger M, Beverly LJ, Hambardzumyan D, Varmus H. Semănarea și propagarea celulelor mamare de șoarece netransformate în plămâni. Știință. (2008) 321:1841–4. doi: 10.1126 / știință.1161621
Rezumat PubMed / CrossRef Text Complet / Google Scholar
16. Schmidt-Kittler O, Ragg T, Daskalakis A, Granzow M, Ahr A, Blankenstein TJ și colab. De la celule diseminate latente la metastaze evidente: analiza genetică a progresiei sistemice a cancerului de sân. Proc Natl Acad Sci Statele Unite ale Americii. (2003) 100:7737–42. doi: 10.1073 / pnas.1331931100
PubMed Rezumat / CrossRef Text Complet / Google Scholar
17. Wo JY, Chen K, Neville BA, Lin nu, Punglia RS. Efectul dimensiunii foarte mici a tumorii asupra mortalității specifice cancerului în cancerul de sân pozitiv la nod. J Clin Oncol. (2012) 23:32–3. doi: 10.1016/j.breastdis.2012.01.026
CrossRef Text Complet / Google Scholar
18. Compton C, Fenoglio-Preiser CM, Pettigrew N, Fielding LP. Comitetul mixt American pentru factorii prognostici ai cancerului Conferința consensului: grupul de lucru colorectal. Cancer. (2015) 88:1739–57. doi: 10.1002 / (SICI)1097-0142(20000401)88:7<1739::ajutor-CNCR30>3.0.CO;2-T
Rezumat PubMed / CrossRef Text Complet / Google Scholar
19. Duffy MJ, van Dalen A, Haglund C, Hansson L, Holinski-Feder e, Klapdor R, și colab. Markeri tumorali în cancerul colorectal: grupul European pentru markeri tumorali (EGTM) ghid pentru utilizare clinică. Eur J Cancer. (2007) 43:1348–60. doi: 10.1016 / j.ejca.2007.03.021
PubMed Rezumat / CrossRef Text Integral / Google Scholar
20. Locker GY, Hamilton S, Harris J, Jessup JM, Kemeny N, Macdonald JS și colab. ASCO 2006 actualizarea recomandărilor pentru utilizarea markerilor tumorali în cancerul gastro-intestinal. J Clin Oncol. (2006) 24:5313–27. doi: 10.1200 / JCO.2006.08.2644
PubMed Rezumat / CrossRef Text Integral / Google Scholar
21. Duffy MJ, Lamerz R, Haglund C, Nicolini a, Kalousov m, Holubec l, și colab. Markeri tumorali în cancerul colorectal, cancerul gastric și cancerele stromale gastro-intestinale: grupul European privind markerii tumorali 2014 ghid de actualizare. Int J Cancer. (2014) 134:2513–22. doi: 10.1002 / CJI.28384
Rezumat PubMed / CrossRef Text Complet / Google Scholar
22. Harrison LE, Guillem JG, Paty P, Cohen AM. Antigenul carcinoembrionic preoperator prezice rezultatele la pacienții cu cancer de colon nod-negativ: o analiză multivariată a 572 de pacienți. J Am Coll Surg. (1997) 185:55-9. doi: 10.1016 / S1072-7515(97)00012-4
PubMed rezumat / CrossRef Text Complet / Google Scholar
23. Huh JW, Oh BR, Kim HR, Kim YJ. Nivelul antigenului carcinoembrionar preoperator ca factor prognostic independent în cancerul de colon potențial curativ. J Surg Oncol. (2010) 101:396–400. doi: 10.1002 / jso.21495
Rezumat PubMed / CrossRef Text Complet / Google Scholar
24. Ozawa H, Kotake K, Hosaka M, Hirata a, Nakagawa Y, Fujita S, și colab. Încorporarea nivelurilor serice de antigen carcinoembrionar în sistemul de grupare prognostică a cancerului de colon. Int J Colorect Dis. (2017) 32:1–9. doi: 10.1007 / s00384-017-2772-1
PubMed rezumat / CrossRef Text Complet / Google Scholar
25. Thirunavukarasu P, Sukumar S, Sathaiah M, Mahan M, Pragatheeshwar KD, Pingpank JF, și colab. Stadiul C în cancerul de colon: implicațiile biomarker-ului antigenului carcinoembrionar în stadializarea, prognosticul și managementul. J Natl Cancer Inst. (2011) 103:689–97. doi: 10.1093 / jnci / djr078
PubMed rezumat / CrossRef Text Complet / Google Scholar
26. Margalit O, Mamtani R, Yang YX, Reiss KA, Golan T, Halpern N, și colab. Evaluarea valorii prognostice a nivelurilor antigenului carcinoembrionar în cancerul de colon în stadiul I și II. Eur J Cancer. (2018) 94:1–5. doi: 10.1016 / j.ejca.2018.01.112
Rezumat PubMed / CrossRef Text Complet / Google Scholar
27. Tarantino I, Warschkow R, Worni M, Merati-Kashani K, K Oktsberle D, Schmied BM, și colab. CEA preoperatorie crescută este asociată cu o supraviețuire mai slabă la pacienții cu cancer rectal în stadiul I-III. Br J Cancer. (2012) 107:266. doi: 10.1038 / bjc.2012.267
PubMed Rezumat / CrossRef Text Integral / Google Scholar
28. Norton L, Massague J. cancerul este o boală de auto-însămânțare? Nat Med. (2006) 12:875–8. doi: 10.1038 | Nm0806-875
PubMed rezumat / CrossRef Text Complet / Google Scholar
29. Yu KD, Jiang YZ, Chen s, Cao ZG, Wu J, Shen ZZ, și colab. Efectul dimensiunii mari a tumorii asupra mortalității specifice cancerului în cancerul de sân negativ. Mayo Clin Proc. (2012) 87:1171–80. doi: 10.1016 / j. mayocp.2012.07.023
PubMed Rezumat / CrossRef Text Integral / Google Scholar
30. Blumberg D, Paty PB, Picon AI, Guillem JG, Klimstra DS, Minsky BD și colab. Stadiul I cancer rectal: identificarea pacienților cu risc ridicat. J Am Coll Surg. (1998) 186: 574-9; discuție: 579-80. doi: 10.1016 / S1072-7515(98)00018-0
PubMed rezumat / CrossRef Text Complet / Google Scholar
31. Gunderson LL, Sargent DJ, Tepper JE, Wolmark N, O ‘ Connell MJ, Begovic M, și colab. Impactul etapelor T și N și al tratamentului asupra supraviețuirii și recidivei în cancerul rectal adjuvant: o analiză comună. J Clin Oncol. (2004) 22:1785-96. doi: 10.1200 / JCO.2004.08.173
PubMed Rezumat / CrossRef Full Text / Google Scholar