implicarea antigenului înrudit pe celulele parenchimatoase stimulează proliferarea celulelor T CD8+ in situ
- celulele T înrudite CD8+ se găsesc în LN și țesutul inflamat
- celulele T CD8 + se extind la locul inflamației
- interacțiunea înrudită cu insulele promovează expansiunea
- interacțiunea înrudită cu leucocitele rezidente nu este necesară
- interacțiunea înrudită cu celulele parenchimatoase este importantă
- celulele T proliferează la locul inflamației
- interacțiunea înrudită cu celulele parenchimatoase determină proliferarea
- IL-2 este mai important la locul inflamației
celulele T înrudite CD8+ se găsesc în LN și țesutul inflamat
în experimentele inițiale (Fig. 1) am stabilit un model în care răspunsurile celulelor T CD8 la un antigen parenchimat, ovalbumină (ovule), ar putea fi analizate. Șoarecii OT-i exprimă un TCR transgenic care mediază recunoașterea celulelor T CD8+ a peptidei OVA257-264 prezentată pe molecula MHC clasa I H-2kb. Celulele T CD8 au fost îmbogățite din șoareci OT-i / CD45.1, etichetați cu coloranți CFSE și transferați adoptiv de I.v. în șoareci gazdă B6 (CD45.2+). Celulele T transferate adoptiv s-au putut distinge de celulele gazdă prin colorarea CD45.1 (precum și CD8 și lanțul Va2 al TCR OT-I) în timp ce diluția colorantului CFSE a fost utilizată pentru a identifica celulele care au proliferat (de exemplu, Fig. 1a, suplimentar Fig. 1). Antigenul parenchimat a fost introdus prin altoirea B6.insulițe de la oxiflora (astfel de insulițe exprimă ovule în celulele parenchimatoase de la oxiflora sub promotorul insulinei de șobolan, tabelul suplimentar 1) sub capsula renală a șoarecilor gazdă cărora li s-au administrat deja celule T OT-i/CD45.1. Toate cele trei surse (gazdă, donator de celule T și donator de insule) au un fundal B6 și, prin urmare, exprimă H-2kb. Astfel, deși expresia antigenului OVA s-a limitat la celulele altoite cu celule int, am presupus că prezentarea ovulelor derivate din celule Int de către APC non-parenchimatoase,cum ar fi DC prin prezentare încrucișată, ar fi necesară pentru amorsarea LN și, probabil, pentru răspunsurile locale ale celulelor T17, 18.

celule OT-i divizate (CD45.1 viabil+CD8+VA2+ poartă) în drenarea Ln renală și grefă la 3 sau 6 zile după primirea unei singure grefe de 400 B6.insulele de la xixtova. (a) parcele reprezentative de citometrie în flux. Poziția vârfului ot-I nedivizat a fost determinată utilizând controlul ‘no antigen’ al unei grefe de insulă B6. (b) Numărul Total de OT-i divizate în Ln renală și grefă în cazul în care fiecare punct reprezintă un șoarece individual. Date colectate din șapte experimente independente: n = 8 primitori de grefă în ziua 3 și n=14 primitori de grefă în ziua 6. Într-o zi 6 grefa a fost pierdută din cauza unei defecțiuni a citometrului de flux. Barele orizontale sunt mijloace, valorile P au fost calculate prin testul t nepereche, cu două cozi, cu corecția lui Welch.
celulele T CD8 + se extind la locul inflamației
după cum era de așteptat, un răspuns OT-i puternic a fost detectat mai întâi în LN renal care drenează locul grefei și acest lucru a fost dependent de prezența antigenului OVA (Fig. 1a, b). La 3 zile post-grefă, ot-i divizat ar putea fi detectat în LNs drenând B6.grefe de insule de la inktova (Fig. 1a) și au fost abundente (Fig. 1b, media=9,2 int.104). În schimb, de 100 de ori mai puține celule ot-I divizate ar putea fi detectate în cadrul B6.grefele de la gravura (Fig. 1A, b, media = 6,6 int.102). Numărul de celule OT-i divizate a crescut de 300 de ori la locul grefei din ziua 3 până în ziua 6 (Fig. 1b, medie=6,6 XCT 102 în ziua 3 până la 2,1 XCT 105 în ziua 6, P<0,0001, test T cu două cozi nepereche cu corecția lui Welch), în timp ce nu a existat o creștere a LN (Fig. 1b). Răspunsul OT-I în B6.grefele de la inktova ar putea fi explicate prin infiltrarea celulelor OT-I care au proliferat în LN. Cu toate acestea, profilele CFSE au fost diferite între siturile grefei și LN, deoarece celulele OT-I din grefe au fost mai divizate decât cele din Ln în ziua 6 (Fig. 1a). Există cel puțin două explicații posibile pentru această diferență. Numai celulele care s-au divizat de multe ori s-au infiltrat în grefă. Alternativ, celulele ajung grefa divizată mai rapid, posibil datorită abundenței de antigen disponibile. Creșterea numărului absolut de celule în grefă comparativ cu LN în ziua 6 ne-a determinat să investigăm această ultimă explicație.
interacțiunea înrudită cu insulele promovează expansiunea
pentru a determina posibila contribuție a MHC înrudit în grefă la expansiunea locală am folosit insule derivate din bm1.șoarecii de la oxktova (tabelul suplimentar 1). În bm1.șoarecii de la soareci, molecula H–2kbm1 nu este în măsură să prezinte peptida OVA257-264 din cauza a trei mutații la H-2kb (ref. 19). O comparație a răspunsurilor la B6.xctova și bm1.grefele insulare de la inktova au arătat că, în ciuda răspunsurilor similare OT-I în Ln renal drenant, extinderea OT-I a fost redusă de șase ori în bm1.în comparație cu B6.grefele de la oxiclova (medie=4.7 ot 104 față de 2,6 ot 105 împărțit ot-I; P = 0,0153 test T cu două cozi nepereche cu corecția lui Welch; Fig. 2a). Această expansiune mai puțin eficientă a celulelor OT-i infiltrate bm1.grefele de la ectova au sugerat că interacțiunile înrudite cu celulele insulare altoite au contribuit la expansiunea locală a celulelor T.

analiza citometriei în flux a celulelor OT-I (CD45.1 viabil+CD8+VA2+ gate) la 6 zile după grefă. (a) ot-i total divizat în Ln renal drenant și grefă după primirea unei singure grefe de 400 B6.unktoktova sau bm1.insulele de la xixtova. Date pentru B6.șoarecii altoiți de la inktova sunt un subset al celui prezentat în Fig. 1b. fiecare punct reprezintă un mouse individual. Datele colectate din două experimente independente sunt prezentate în fiecare panou: n = 5 destinatari ai B6.grefele de la inktova și n = 6 primitori de bm1.grefe de la oktova. Barele orizontale sunt mijloace, valorile P au fost calculate prin testul t nepereche, cu două cozi, cu corecția lui Welch. (b) schema modelului de grefă bipolară în care grefele a 200 de insule sunt plasate la poli opuși ai aceluiași rinichi și au o LN renală comună drenantă. Total împărțit OT-I în (c) B6.kbko și kbko.grefele bipolare de la oxiftova și (d) B6.datele pentru același șoarece sunt conectate prin linii punctate: valorile P au fost calculate prin raportul asociat t-test.
pentru a elimina orice contribuție de H-2kbm1 alloantigen am generat KbKO.șoarecii de la oxiclova care exprimă antigenul ovulelor în celulele beta insulare, dar nu au aloantigen sau H-2kb (tabelul suplimentar 1). Apoi am folosit un ‘model de grefă bipolară’ pentru a compara răspunsurile la B6.kbko și kbko.grefele de insuliță de la inktova plasate la poli opuși ai aceluiași rinichi într-un șoarece gazdă B6, astfel încât celulele T infiltrate de grefă au fost derivate din celulele T amorsate în același LN (Fig. 2b). Au fost de 10-100 de ori mai multe celule T prezente în B6.oktoktova decât KbKO.grefele de la gravura (Fig. 2c). Folosind raportul OT-i divizat la poli opuși ai rinichiului calculat pentru șoareci individuali, am derivat un raport relativ de răspuns (RRR). RRR a indicat faptul că expansiunea locală a celulelor T a fost de 26 de ori mai mare atunci când s-a produs angajamentul înrudit cu celulele grefei (RRR=26,4 14,1 in B6.kbko:kbko.grefele de la oxiftova, P = 0,0025, raportul pereche t-test, Fig. 2c).
am comparat, de asemenea, răspunsurile la B6 bipolar.grefele de la inktova și B6 (fără antigen) (Fig. 2d). Foarte puține OT-I ar putea fi detectate în grefele B6 (Fig. 2d) și considerăm că este probabil ca multe dintre acestea să circule OT-i derivate din contaminarea sângelui. Astfel, inflamația nespecifică asociată cu transplantul de grefe care nu au antigen nu duce la o expansiune eficientă a celulelor T în țesutul inflamat. În schimb, răspunsul la B6.grefele de la clasa a X-a au fost din nou foarte potente și de peste 900 de ori mai mari decât cele de la clasa A X-A B6 (RRR=950 la clasa a X-a 252 pentru clasa A x-A B6.inktoktova: grefe B6, P < 0,0001, raport pereche t-test, Fig. 2d).
împreună, aceste experimente au indicat faptul că expansiunea celulelor T CD8 în țesutul țintă inflamat a fost promovată semnificativ de prezentarea locală a antigenului. Acest lucru nu exclude neapărat alte contribuții la expansiunea celulelor T, de exemplu, prin prezentarea încrucișată a gazdei DC în grefă. Noi aver doar că interacțiunea înrudită între celulele T și celulele insulita duce la expansiunea substanțială a celulelor T.
interacțiunea înrudită cu leucocitele rezidente nu este necesară
insulele sunt clustere complexe de celule care includ celule de tip inkt, celule endoteliale și leucocite rezidente pe insule (IRL). Prin urmare, am căutat în continuare să clarificăm care celule insulare au prezentat antigen la infiltrarea celulelor T pentru a conduce expansiunea celulelor T. Cel mai evident candidat ar fi IRL. Aceste celule CD45 + au fost definite în mod diferit ca DC sau macrofage, Co-exprimă CD11c și F4/80 și s-a dovedit că procesează și prezintă antigeni20,21,22,23. Prin urmare, am examinat rolul IRL donator în stimularea expansiunii locale a celulelor T CD8. B6.șoarecii de la inktova au fost traversați la CD11c. DTR.Șoareci GFP pentru a obține CD11c. DTR.GFP.șoarecii de la clasa a VIII-a ale căror celule din clasa A X-a exprimă ovule și ale căror celule CD11c+ ar putea fi ablate prin injectarea de toxină difterică (DT) 8. Am testat mai întâi de FACS că insulele izolate de CD11c.DTR.Șoarecii GFP tratați cu DT au fost epuizați de celule CD11c +(Fig. 3a, b). CD11c + IRL la șoarecii de control netratați au fost identificați prin colorare pentru CD45 și CD11c, precum și expresia lor a reporterului GFP și au fost clar epuizați prin tratamentul DT (Fig. 3A, b, P = 0,0002, test t nepereche cu două cozi cu corecția lui Welch). De asemenea, am confirmat că CD11c+IRL a co-exprimat F4/80 și H-2 Kb MHC clasa I (fig suplimentar. 2a) și, în consecință, celulele F4/80 + au fost, de asemenea, epuizate din Insulele șoarecilor tratați cu DT (Fig suplimentar. 2b). CD11c. DTR.GFP.insulițele de la insulova izolate de la șoareci netratați și tratați cu DT au fost altoite la poli opuși ai aceluiași rinichi. Numărul OT-i împărțit a fost similar între grefe, indicând faptul că depleția IRL nu a avut niciun efect asupra expansiunii celulelor T CD8+ la locul grefei (Fig. 3c). Pentru a confirma că IRL nu au fost importante pentru expansiunea locală a celulelor T CD8, am efectuat un al doilea set de experimente. KbKO.șoarecii de la zaktova au fost iradiați și reconstituiți fie cu KbKO, fie cu măduva osoasă B6 (BM) pentru a genera o sursă de insule de la zaktova în care expresia H-2kb a fost absentă din toate celulele sau a fost restabilită selectiv la LIR (Fig. 3d). Comparația acestor insule în modelul de grefă bipolară a arătat niveluri similare de expansiune a celulelor OT-I în ambele grefe (Fig. 3e). Prin urmare, IRL nu sunt factori majori ai expansiunii locale a celulelor T CD8.

analiza citometriei în flux care arată epuizarea CD11c + IRL în CD11c. DTR.Șoareci GFP tratați cu DT: (a) parcele reprezentative care arată închiderea CD11C+IRL în insulele de la șoarecii de control netratați și depleția acestora în ziua următoare unui singur tratament DT și (b) enumerarea CD11c+IRL la șoarecii netratați și tratați cu DT. Fiecare punct reprezintă un preparat insular individual care conține insule grupate de la 1 la 8 șoareci, n=5 preparate insulare netratate și 6 preparate insulare tratate DT grupate din patru experimente independente. Valoarea p calculată prin testul t nepereche, cu două cozi, cu corecția lui Welch. (c) ot-i total divizat la 6 zile după grefa bipolară de insule obținută din CD11c.DTR.GFP.șoarecii de la oxixtova care nu au fost tratați sau tratați cu DT (n=6 șoareci primitori comasați din două experimente independente). Datele pentru același mouse sunt conectate prin linii punctate; valorile P calculate prin raportul asociat t-test. (d) parcele reprezentative care arată absența sau prezența expresiei H-2kb pe CD11c+IRL a șoarecilor KbKO reconstituiți cu KbKO sau, respectiv, B6 BM. Pe celule viabile. (e) ot-i total divizat la 6 zile după grefa bipolară de insule obținută de la șoareci chimerici (n=3 șoareci primitori dintr-un singur experiment). Datele pentru același mouse sunt conectate prin linii punctate; Valorile P calculate prin raportul asociat t-test.
interacțiunea înrudită cu celulele parenchimatoase este importantă
B6.Șoarecii RIP-Kb exprimă transgenic H-2kb în celule centi sub controlul insulinei de șobolan24. Prin trecerea acestor șoareci la KbKO.soareci de la inktova am generat KbKO.oktokova.șoarecii de la clasa a X-a la care expresia H-2Kb a fost limitată la celule de la clasa A X-a (tabelul suplimentar 1). Expresia H-2kb pe celule de la numărul de celule de la numărul de celule de la numărul de celule de la numărul de celule de la numărul de celule a fost confirmată prin analiza FACS a insulelor (Fig. 4a). Am închis pe celule hematopoietice insulare (CD45+) și celule endoteliale (CD31+) și am arătat că H-2kb nu a fost exprimat pe aceste celule nici în KbKO.kbko sau kbko.oktokova.șoarecii de la inktikb comparativ cu expresia puternică la șoarecii de la B6 (Fig. 4a). Celulele CD45-CD31 rămase sunt autofluorescente pozitive și îmbogățite în celulele endocrine. Analiza FACS a insulelor din KbKO.oktokova.șoarecii de la x-2kb au prezentat expresia H – 2KB în cadrul populației autofluorescente îmbogățite cu celule de la X-X la niveluri similare cu cele observate în Insulele B6 (Fig. 4a). Comparația în modelul de grefă bipolară a indicat faptul că expansiunea OT-I a fost de 14 ori mai mare atunci când antigenul înrudit a fost exprimat pe celule int (RRR=14,0 int 4,1 pentru KbKO.oktokova.x-x-x-x-x-x-x-x-x.grefele de la oxiftova, P = 0,0008, raportul pereche t-test, Fig. 4b).

(a) parcele de citometrie în flux (închise pe celule viabile) care arată restaurarea selectivă a expresiei H-2kb pe celulele parenchimale. Histogramele reprezintă insule din KbKO (umbrite), B6 (punctate) sau KbKO.soareci (bold). (b) total împărțit OT-I la 6 zile după grefa bipolară de KbKO.kbko și kbko. oktokova.x-x-x-x-x. insule (n=6 șoareci primitori adunați din trei experimente independente). Datele pentru același mouse sunt conectate prin linii punctate; valorile P calculate prin raportul asociat t-test.
celulele T proliferează la locul inflamației
rezultatele noastre de mai sus indică faptul că a existat o proliferare locală la locul țintă. Pentru a detecta celulele proliferante activ am trecut șoareci OT-i/CD45.1 la șoareci FucciRG pentru a genera FucciRG/ot-i / CD45.1 șoareci (abreviat FucciOT-I). La astfel de șoareci, celulele fluorescente roșii (FucciR) în timpul G0/G1 și verzi (FucciG) în timpul fazelor ciclului celular S/G2/M25,26. Degradarea și acumularea treptată a reporterilor FucciR și FucciG în timpul tranziției între fazele ciclului permite distincții suplimentare: exprimarea FucciR mai intensă în celulele G0 în repaus față de celulele G1 ciclice, celulele FucciR−g negative duble în G1 foarte timpuriu și celulele FucciR+G+ pozitive slab duble în G1/S (refs 26, 27). Celulele FucciOT-i în repaus de la șoareci neîngropați au fost FucciG- − Fig. 5A, panoul superior, ungrafted). Pentru a evita interferența cu coloranții Fucci am înlocuit CFSE cu CTV. La șoarecii care au primit B6.grefele de la niktova, analiza diluției CTV a indicat că FucciOT-I divizat a fost prezent în Ln renal drenant și unele dintre acestea au fost FucciG+ sugestive pentru diviziunea celulară activă (Fig. 5A, panoul superior, drenarea LN). La locul grefei, am detectat FucciOT-I care a suferit multe diviziuni (CTV nu mai este detectabil) și multe dintre acestea au fost FucciG+ care susțineau proliferarea continuă (Fig. 5A, Panou superior, grefă proaspătă). Compararea proporției celulelor FucciG+ în cadrul populației divizate OT-I (Fig. 5c) a indicat faptul că proliferarea continuă în cadrul grefelor proaspete (26,8% 8,8% FucciG+) a depășit-o fie în Ln renal drenant (7,3% 1,6%, P=0,008, testul T cu două cozi nepereche cu corecția lui Welch), fie în Ln renal non-drenant (2,1% 2,1%, P=0,003, testul T cu două cozi nepereche cu corecția lui Welch). Într-adevăr, examinarea atât a expresiei FucciG, cât și a FucciR a indicat faptul că majoritatea ot-I infiltrate de grefă se împărțeau activ, adică foarte puține celule au prezentat o expresie ridicată a FucciR care era o caracteristică a celulelor în repaus în ln a șoarecilor nerafinați (Fig. 5A, panouri inferioare). Deși am presupus că această proliferare la locul inflamației a fost generată in situ, nu am putut ignora complet posibilitatea ca acest lucru să reflecte pur și simplu sosirea recentă a celulelor proliferante. Pentru a clarifica acest lucru, am recoltat grefele bipolare ale B6.insulițele de la xixtova se analizează o grefă imediat după excizie, iar cealaltă grefă se cultivă timp de 1 zi (Fig. 5a). În timp ce numărul de OT-I nu a crescut pe parcursul perioadei de cultură (Fig. 5b), reflectând probabil moartea celulară în condiții ex-vivo suboptimale, au continuat să fie detectate multe celule FucciG+ OT-I (14,2 inktiv 4,2% FucciG+, Fig. 5c). Profilul grefei cultivate, fără o posibilă recrutare pentru o zi, ar indica faptul că a existat o proliferare ridicată de novo în grefă.

(a) parcele schematice și reprezentative de citometrie în flux (închise pe limfocite CD45.1+CD8+VA2+ viabile) care prezintă răspunsul celulelor FucciOT-I în LNs renale sau bipolare B6.grefe de la oktova. LNs și grefa de la un pol au fost examinate imediat (proaspete la 6 zile după grefă) în timp ce grefa de la polul opus a fost cultivată timp de 1 zi înainte de analiză. LN de la un șoarece nerafinat a fost inclus pentru a arăta absența diviziunii și a expresiei FucciG (panoul superior) și predominanța celulelor înalte FucciR (panoul inferior) în FucciOT-I. (b) FucciOT-i total divizat în grefe proaspete și cultivate. Medie + s. d., N = 5, valorile P calculate prin raportul cu două cozi pereche t-test. (c) %FucciG+ împărțit OT-I în grefe proaspete care nu drenează și grefe care drenează Ln renal, precum și grefe proaspete și cultivate. Medie + s. d., n = 5 cu excepția Ln care nu se scurge pentru care n = 4 din cauza pierderii unui LN în timpul procesării. Valorile P au fost calculate prin testul t nepereche cu două cozi cu corecția lui Welch. Datele sunt colectate din două experimente independente.
interacțiunea înrudită cu celulele parenchimatoase determină proliferarea
am profitat apoi de modelul FucciOT-I pentru a evalua rolul unui alt potențial conducător local al proliferării celulelor T în grefa, APC derivat din gazdă, cum ar fi DC inflamator. Pentru a elimina orice contribuție a APC gazdă am derivat mai întâi un fundal KbKO. Pe măsură ce șoarecii KbKO au respins celulele OT – I, am creat kbko BM în chimaere B6 pentru a le folosi ca gazde; astfel, celulele hematopoietice nu aveau H-2kb, dar erau permisive pentru celulele OT-I. Acestor chimaere li s-au administrat celule FucciOT-I T și grefe bipolare de KbKO.insulițe de la inktova (lipsite de expresia H-2kb și, prin urmare, capacitatea de a prezenta antigenul OVA) și KbKO.oktokova.insulele de tip x-2kb (atât antigenul h-2KB, cât și antigenul OVA au fost limitate la celule de tip X-X). Deoarece Chimera nu avea APC pozitiv H-2kb, a fost necesar să se administreze celule splenice acoperite cu peptide OVA257-264 pentru a iniția răspunsul OT-I. Succesul acestei amorsări a fost demonstrat de diluția CTV în celulele FucciOT-I din Ln renal, deși la momentul recoltării acestea erau FucciG− și nu păreau să se dividă activ(0,1 0,0% FucciG+, Fig. 6a, d). Foarte puțini OT-I s-au infiltrat în KbKO.grefele de la Centova, dar au fost în mod clar extinse în cadrul KbKO.oktokova.grefe de x-x (RRR de 61,4 x-x 26,6 pentru KbKO.oktokova.x-x-x-x-x-x-x-x-x.oktokova, Fig. 6B, P=0,0008, raportul cu două cozi pereche t-test). Astfel, chiar și în absența antigenului înrudit pe APC gazdă, antigenul înrudit pe celulele parenchimatoase a fost suficient pentru a conduce expansiunea celulelor T CD8 la locul grefei. Cele câteva celule FucciOT-I t prezente în KbKO.grefele de la inktova s-au asemănat cu cele din LN atât din punct de vedere al progresiei lor ineficiente către fracția foarte divizată (Fig. 6a, c, 7,5 int. 0,9% foarte impartit in LN si 19,3 int. 3,3% foarte impartit in KbKO.grefele de la inktova) și lipsa expresiei FucciG (Fig. 6a, d, 0,1 0,0% în LN și 0,1 0,1% în kbko.ot-i a avut loc la locul grefei în absența antigenului înrudit. În schimb, OT-i în cadrul KbKO.oktokova.grefele de la clasa a VIII-a au fost predominant divizate (92,3 la sută 1,0%, Fig. 6a, c) și unele dintre acestea au fost FucciG+ și astfel au proliferat activ (Fig. 6a, d, 5.0 int.1.2% FucciG+). Prin urmare, prezentarea antigenului înrudit de către celulele parenchimale ale insulelor a fost capabilă să conducă proliferarea de novo a FucciOT-I in situ.

răspunsul FucciOT-I la grefele din KbKO BM în șoarecii gazdă B6 în care celulele hematopoietice gazdă nu au expresia H-2kb. Șoarecii altoiți au primit celule splenice acoperite cu peptide în ziua altoirii pentru a iniția amorsarea OT-I. (a) parcele reprezentative de citometrie în flux (închise pe limfocite CD45.1 viabile+CD8+Va2+). Panoul superior arată lipsa de diviziune și expresia FucciG în repaus OT-i în LN a unui șoarece care nu a fost nici grefat, nici amorsat. Trei panouri inferioare prezintă reponses într-un șoarece bipolar grefat și amorsat: drenarea renală Ln, KbKO.kbko și kbko.oktokova.grefe de la o mie de mii. Celulele divizate la șoarecii altoiți au fost împărțite în două sectoare, celulele foarte divizate căzând în sectorul în care CTV a fost diluat dincolo de limita de detecție. (b) Total divizat FucciOT-I în KbKO.kbko și kbko.oktokova.grefele bipolare de la centikb, valorile P calculate prin testul t asociat cu raportul cu două cozi. (c) % foarte divizată și (d) % FucciG+ OT-i în drenarea LN renală și grefe de șoareci altoiți bipolari. Valorile P au fost calculate prin testul t asociat cu două cozi. Rezultatele pentru șoarecii individuali sunt conectați prin linii punctate, n=6 șoareci primitori adunați din două experimente independente.
IL-2 este mai important la locul inflamației
arătăm că expresia IL-2RA a fost mai importantă pentru proliferarea și acumularea celulelor T CD8+ în parenchimul periferic (grefe insulare) comparativ cu în interiorul locului de amorsare în drenarea LN (Fig. 7a). În plus, am analizat răspunsul într-un al doilea sit îndepărtat de locul de amorsare, adică Ln care nu se scurge. Celulele T CD8 + marcate cu CTV de la șoarecii OT-I. IL-2RAKO (IL−2RA-CD45.2+) și ot-i/Ly5.1 (IL-2RA+, CD45.1+CD45.2+) au fost co-transferați la șoarecii gazdă B6.CD45.1 (CD45.1+) înainte de a primi o singură grefă de B6.insulele de la xixtova. Semnăturile alelice CD45 distincte ale fiecăreia dintre populațiile de celule T transferate (în combinație cu colorarea pentru CD8 și Va2) ne-au permis să cuantificăm și să comparăm raportul WT divizat:IL-2rako ot-I (Fig. 7a, suplimentar Fig. 3). IL-2RA WT a depășit în mod clar IL-2RA KO OT-I la locul grefei, comparativ fie cu drenarea (P=0,025, testul t asociat cu două cozi), fie cu non-drenarea (P=0,044, testul t asociat cu două cozi) LN. Acest lucru este în concordanță cu dependența crescută a celulelor T CD8+ de IL-2 în momentul întâlnirii secundare cu antigenul la locul inflamației, comparativ cu în timpul amorsării inițiale în drenajul LN.
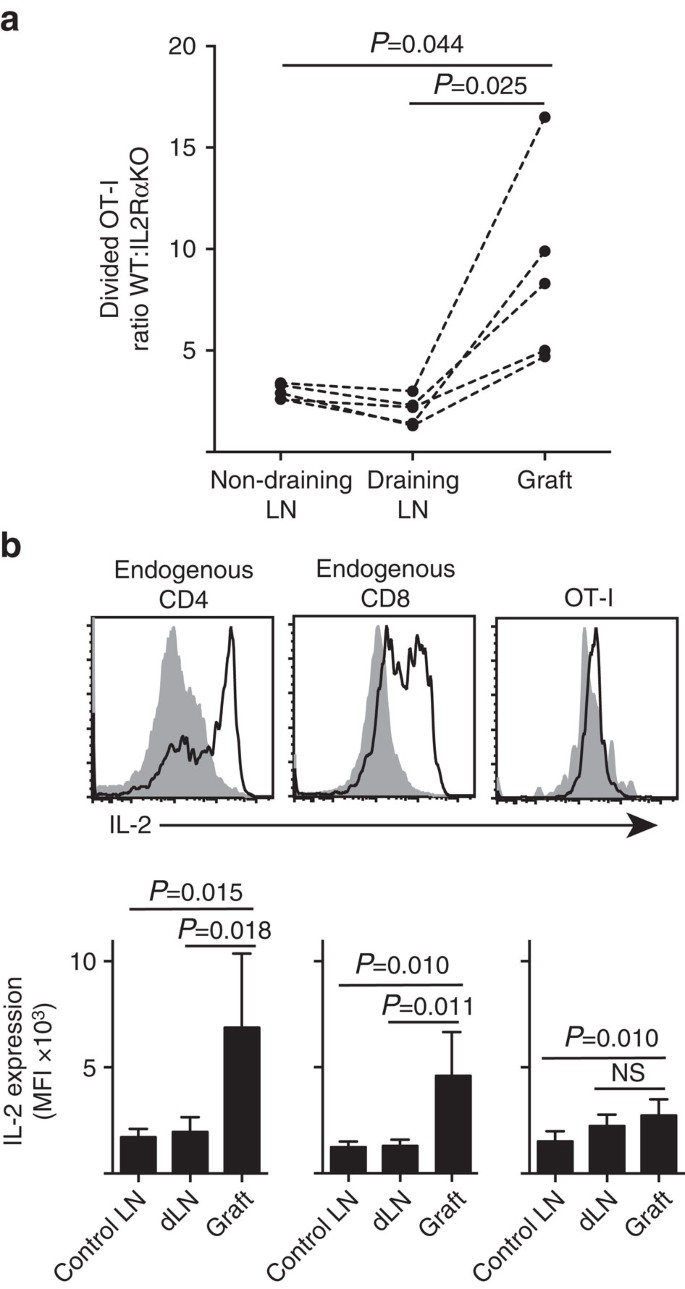
(a) raportul IL-2RA împărțit în greutate:celulele IL-2RA KO ot-I recuperate din B6.grefa de insulă de la inktova, drenând Ln renal și ln inghinal care nu drenează după co-transfer (106 din fiecare) în șoareci gazdă B6.CD45.1. Raporturile au fost calculate pentru organele individuale cu rezultate pentru șoarecii individuali conectați prin linii punctate și comparați prin testul t pereche cu două cozi. Rezultatele prezentate pentru șoarecii primitori n=5 și reprezentativi pentru trei experimente independente. (b) expresia IL-2 în celulele CD4+ și CD8+ endogene și celulele ot-i transferate în receptorii B6 ai B6.grefe de insule de la inktova. Panourile superioare prezintă parcele reprezentative de citometrie în flux pentru drenarea Ln renală a grefei (gri solid) și grefă (linie neagră). Panourile inferioare rezumă intensitatea fluorescentă medie (IFM) a expresiei IL-2 pentru LNs renale prelevate de la Ln negraftat (Ln de Control), precum și grefa și drenarea Ln renală (dLN) a șoarecilor altoiți. Rezultatele prezentate ca medie + s. d., n=6 grupate din două experimente independente și comparate prin testul t nepereche cu două cozi cu corecția lui Welch.
dependența sporită de IL-2 pentru proliferarea celulelor T CD8+ la locul inflamației a dedus o cerință pentru producția locală de IL-2. Prin urmare, am examinat potențialul diferitelor celule T (CD4+ și CD8+ derivate din gazdă endogenă, precum și celulele T ot-i CD8+ transferate) pentru capacitatea de a produce IL-2 (Fig. 7b). Suspensiile celulare preparate din grefe sau LN au fost restimulate scurt (4 ore) cu PMA și ionomicină înainte de colorare pentru exprimarea IL-2 intracelular. Examinarea celulelor T CD4+ și CD8 + derivate din gazdă endogenă a furnizat dovezi convingătoare ale producției de IL-2 la locul inflamației grefei, cu o creștere clară a IFM a colorării IL-2 prin comparație fie cu LN drenant, fie fără drenaj. Nivelurile de IL-2 în celulele T ot-i CD8+ la locul inflamației au fost moderat crescute față de cele din LN care nu drenează, dar nu au diferit semnificativ de cele din Ln care drenează. O interpretare a acestor date este că interacțiunea înrudită a OT-I cu celulele parenchimale induce proliferarea rapidă, dar producția slabă de IL-2, astfel încât OT-I sunt dependente de paracrina IL-2 derivată din celulele T endogene CD4+ și CD8+ în mediul grefei locale. Cu toate acestea, un experiment suplimentar a indicat faptul că IL-2 exogen în absența antigenului parenchimat nu a putut conduce expansiunea celulelor ot-i CD8+. IL-2 (Hil-2 recombinant, 25.000 UI) a fost administrat intraperitoneal șoarecilor B6 care au primit grefe bipolare de B6.Insulele B6 și B6. Comparația recuperării OT-I în organele recuperate de la șoarecii tratați cu IL-2 sau vehicul în ziua 6 după grefare nu a arătat o creștere semnificativă a acumulării de celule ot-i divizate în două situsuri care nu au antigen parenchimatos și anume grefe de insule B6 (3 int 3 în vehiculul tratat comparativ cu 49 int 64 în șoarecii tratați cu IL-2, P=0.342) și ln inghinal care nu se scurge (1.648+633 la vehiculul tratat comparativ cu 1.660+1.023 la șoarecii tratați cu IL-2, P=0,987, valoarea medie a s.d., n=3, testul t nepereche cu două cozi cu corecția lui Welch).