12.4: Verdampfung und Kondensation
Verdampfung
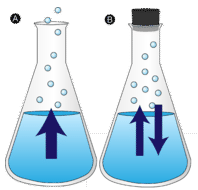
Eine ungestörte Wasserpfütze verschwindet schließlich. Die flüssigen Moleküle entweichen in die Gasphase und werden zu Wasserdampf. Verdampfung ist der Prozess, bei dem eine Flüssigkeit in ein Gas umgewandelt wird. Verdampfung ist die Umwandlung einer Flüssigkeit in ihren Dampf unterhalb der Siedetemperatur der Flüssigkeit. Wenn das Wasser stattdessen in einem geschlossenen Behälter aufbewahrt wird, haben die Wasserdampfmoleküle keine Chance, in die Umgebung zu entweichen, und so ändert sich der Wasserstand nicht. Wenn einige Wassermoleküle zu Dampf werden, kondensiert eine gleiche Anzahl von Wasserdampfmolekülen wieder in den flüssigen Zustand. Kondensation ist die Zustandsänderung von einem Gas zu einer Flüssigkeit.
Damit ein flüssiges Molekül in den Gaszustand entweichen kann, muss das Molekül über genügend kinetische Energie verfügen, um die intermolekularen Anziehungskräfte in der Flüssigkeit zu überwinden. Denken Sie daran, dass eine bestimmte flüssige Probe Moleküle mit einem breiten Spektrum kinetischer Energien enthält. Flüssige Moleküle, die diese bestimmte kinetische Schwellenenergie haben, entweichen der Oberfläche und werden zu Dampf. Infolgedessen haben die verbleibenden Flüssigkeitsmoleküle jetzt eine geringere kinetische Energie. Wenn die Verdampfung auftritt, nimmt die Temperatur der verbleibenden Flüssigkeit ab. Sie haben die Auswirkungen der Verdunstungskühlung beobachtet. An einem heißen Tag absorbieren die Wassermoleküle in Ihrem Schweiß Körperwärme und verdunsten von der Hautoberfläche. Der Verdampfungsprozess lässt den verbleibenden Schweiß kühler, was wiederum mehr Wärme von Ihrem Körper absorbiert.
Eine bestimmte Flüssigkeit verdunstet schneller, wenn sie erhitzt wird. Dies liegt daran, dass der Erwärmungsprozess dazu führt, dass ein größerer Teil der Moleküle der Flüssigkeit die notwendige kinetische Energie hat, um der Oberfläche der Flüssigkeit zu entkommen. Die folgende Abbildung zeigt die kinetische Energieverteilung von Flüssigkeitsmolekülen bei zwei Temperaturen. Die Anzahl der Moleküle, die die erforderliche kinetische Energie zum Verdampfen haben, ist im schattierten Bereich unter der Kurve rechts dargestellt. Die Flüssigkeit mit höherer Temperatur \(\left( T_2 \right)\) hat mehr Moleküle, die in die Dampfphase entweichen können als die Flüssigkeit mit niedrigerer Temperatur \(\left( T_1 \right)\).
Mit 29.029 Fuß \(\left( 8848 \: \text{m} \right)\) ist der Mount Everest im Himalaya-Gebirge an der Grenze zwischen China und Nepal der höchste Punkt der Erde. Seine Höhe stellt Kletterer vor viele praktische Probleme. Der Sauerstoffgehalt der Luft ist viel niedriger als auf Meereshöhe, was es notwendig macht, Sauerstofftanks mitzubringen (obwohl einige Kletterer den Gipfel ohne Sauerstoff erreicht haben). Ein weiteres Problem ist das Kochen von Wasser zum Kochen von Speisen. Obwohl Wasser bei \(100 ^ \ text {o} \ text{C}\) auf Meereshöhe kocht, liegt der Siedepunkt auf dem Mount Everest nur bei \(70 ^ \text{o} \text{C}\). Dieser Unterschied macht es sehr schwierig, eine anständige Tasse Tee zu bekommen (was definitiv einige der britischen Kletterer frustrierte).