17.3: Die Bildung komplexer Ionen
Der Einfluss der Bildung komplexer Ionen auf die Löslichkeit
Was passiert mit der Löslichkeit eines schwerlöslichen Salzes, wenn der Lösung ein Ligand zugesetzt wird, der ein stabiles komplexes Ion bildet? Ein solches Beispiel tritt in der konventionellen Schwarz-Weiß-Fotografie auf. Denken Sie daran, dass schwarzweißfotografischer Film lichtempfindliche Mikrokristalle von AgBr oder Mischungen von AgBr und anderen Silberhalogeniden enthält. AgBr ist ein schwerlösliches Salz mit einem Ksp von 5,35 × 10-13 bei 25 ° C. Wenn sich der Verschluss der Kamera öffnet, trifft das Licht des fotografierten Objekts auf einige der Kristalle auf dem Film und löst eine photochemische Reaktion aus, die AgBr in schwarzes Ag-Metall umwandelt. Wohlgeformte, stabile Negativbilder erscheinen in Grautönen, entsprechend der Anzahl der umgewandelten AgBr-Körner, wobei die Bereiche, die dem meisten Licht ausgesetzt sind, am dunkelsten sind. Um das Bild zu fixieren und zu verhindern, dass während der Verarbeitung des Films mehr AgBr-Kristalle in Ag-Metall umgewandelt werden, wird das nicht umgesetzte AgBr auf dem Film unter Verwendung einer Komplexierungsreaktion entfernt, um das schwerlösliche Salz aufzulösen.
Die Reaktion zur Auflösung von Silberbromid ist wie folgt:
\
mit
\
Das Gleichgewicht liegt weit links und die Gleichgewichtskonzentrationen von Ag + − und Br–Ionen sind sehr niedrig (7,31 × 10-7 M). Infolgedessen würde das Entfernen von nicht umgesetztem AgBr von einer einzigen Filmrolle mit reinem Wasser Zehntausende Liter Wasser und viel Zeit erfordern. Das Prinzip von Le Chatelier besagt jedoch, dass wir die Reaktion nach rechts lenken können, indem wir eines der Produkte entfernen, wodurch sich mehr AgBr auflöst. Bromidion ist chemisch schwer zu entfernen, aber Silberionen bilden eine Vielzahl stabiler Zweikoordinatenkomplexe mit neutralen Liganden wie Ammoniak oder mit anionischen Liganden wie Cyanid oder Thiosulfat (S2O32−). Bei der fotografischen Verarbeitung wird überschüssiges AgBr mit einer konzentrierten Lösung von Natriumthiosulfat gelöst.
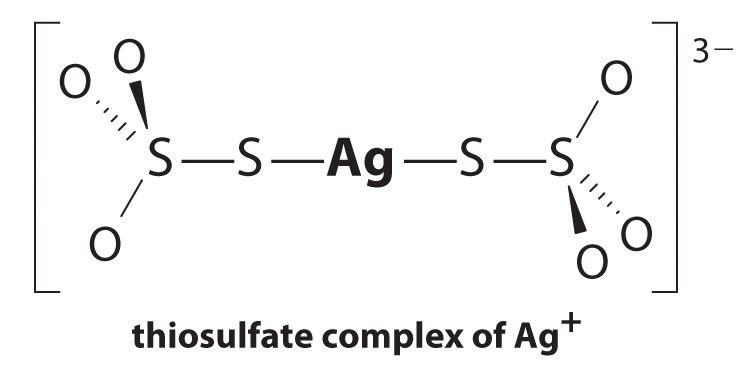
Die Reaktion von Ag + mit Thiosulfat ist wie folgt:
\^{3−}_{( aq)} \Bezeichnung{17.3.5a}\]
mit
\
Die Größe der Gleichgewichtskonstante zeigt an, dass fast alle Ag + −Ionen in Lösung sofort durch Thiosulfat zu 3- komplexiert werden. Wir können die Wirkung von Thiosulfat auf die Löslichkeit von AgBr sehen, indem wir die entsprechenden Reaktionen schreiben und addieren:
\\ \ mathrm{Ag^+(aq)}+\mathrm{2S_2O_3^{2-}(aq)}\rechte linke Harpune\mathrm{^{3-}(aq)}\hraum{3mm}K_\textrm f&=2.9\mal10^{13}
\\ \mathrm{AgBr(s)}+\mathrm{2S_2O_3^{2-}(aq)}\rightleftharpoons\mathrm{^{3-}(aq)}+\mathrm{Br^-(aq)}\hspace{3mm}K&=K_{\textrm{sp}}K_{\ textrm f} = 15\Ende {ausrichten} \ Beschriftung{17.3.6}\)
Der Vergleich von K mit Ksp zeigt, dass die Bildung des Komplex-Ions die Löslichkeit von AgBr um etwa 3 × 1013 erhöht. Die dramatische Erhöhung der Löslichkeit in Verbindung mit den geringen Kosten und der geringen Toxizität erklärt, warum Natriumthiosulfat fast universell für die Entwicklung von Schwarzweißfilmen verwendet wird. Falls gewünscht, kann das Silber aus der Thiosulfatlösung mit einer von mehreren Methoden zurückgewonnen und recycelt werden.
Wenn ein komplexes Ion ein großes Kf hat, kann die Bildung eines komplexen Ions die Löslichkeit schwerlöslicher Salze dramatisch erhöhen.
Beispiel \(\pageIndex{2}\)
Aufgrund des allgemeinen Ioneneffekts können wir erwarten, dass ein Salz wie AgCl in einer konzentrierten Lösung von KCl viel weniger löslich ist als in Wasser. Eine solche Annahme wäre jedoch falsch, da sie die Tatsache ignoriert, dass Silberionen dazu neigen, einen Zweikoordinatenkomplex mit Chloridionen (AgCl2-) zu bilden. Berechnen Sie die Löslichkeit von AgCl in jeder Situation:
- in reinem Wasser
- in 1,0 M KCl-Lösung, wobei die Bildung von komplexen Ionen ignoriert wird
- die gleiche Lösung wie in Teil (b), außer unter Berücksichtigung der Bildung von komplexen Ionen, unter der Annahme, dass AgCl2- ist der einzige Ag + -Komplex, der sich in signifikanten Konzentrationen bildet
Bei 25 ° C, Ksp = 1,77 × 10-10 für AgCl und Kf = 1.1 × 105 für AgCl2−.
Gegeben: Ksp von AgCl, Kf von AgCl2- und KCl-Konzentration
Gefragt: Löslichkeit von AgCl in Wasser und in KCl-Lösung mit und ohne Bildung komplexer Ionen
Strategie:
- Schreiben Sie den Löslichkeitsproduktausdruck für AgCl und berechnen Sie die Konzentration von Ag + und Cl− in Wasser.
- Berechnen Sie die Konzentration von Ag+ in der KCl-Lösung.
- Schreiben Sie ausgewogene chemische Gleichungen für die Auflösung von AgCl und für die Bildung des AgCl2−Komplexes. Addieren Sie die beiden Gleichungen und berechnen Sie die Gleichgewichtskonstante für das Gesamtgleichgewicht.
- Schreiben Sie den Ausdruck der Gleichgewichtskonstante für die Gesamtreaktion. Lösen Sie für die Konzentration des komplexen Ions.
Lösung
- A Wenn wir x gleich der Löslichkeit von AgCl lassen, dann im Gleichgewicht = = x M. Ersetzen dieses Wertes in den Löslichkeitsproduktausdruck,
Somit beträgt die Löslichkeit von AgCl in reinem Wasser bei 25 ° C 1,33 × 10-5 M.
- B Wenn x gleich der Löslichkeit von AgCl in der KCl-Lösung ist, dann im Gleichgewicht = x M und = (1,0 + x) M. Setzen Sie diese Werte in den Löslichkeitsproduktausdruck ein und nehmen Sie an, dass x << 1.0,
Wenn der gemeinsame Ioneneffekt der einzige wichtige Faktor wäre, würden wir vorhersagen, dass AgCl in einer 1,0 M KCl-Lösung ungefähr fünf Größenordnungen weniger löslich ist als in Wasser.
- C Um die Auswirkungen der Bildung komplexer Ionen zu berücksichtigen, müssen wir zuerst die Gleichgewichtsgleichungen sowohl für die Auflösung als auch für die Bildung komplexer Ionen schreiben. Das Addieren der Gleichungen, die Ksp und Kf entsprechen, ergibt eine Gleichung, die die Auflösung von AgCl in einer KCl-Lösung beschreibt. Die Gleichgewichtskonstante für die Reaktion ist daher das Produkt von Ksp und Kf:
\\ \ mathrm{Ag^+(aq)}+\mathrm{2Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hraum{3mm}K_\textrm f&=1.1\times10^{5}
\\ \mathrm{AgCl(s)}+\mathrm{Cl^{-}}\rightleftharpoons\mathrm{^{-}}\hspace{3mm}K&=K_{\textrm{sp}}K_{\ textrm f}=1.9\times10^{-5}\end{align}\)
D Wenn wir x gleich der Löslichkeit von AgCl in der KCl-Lösung lassen, dann im Gleichgewicht = x und = 1.0 – x. Ersetzen dieser Mengen in den Gleichgewichtskonstanten Ausdruck für die Nettoreaktion und unter der Annahme, dass x << 1.0,
Das heißt, AgCl löst sich in 1,0 M KCl auf, um eine 1,9 × 10-5 M Lösung des AgCl2−Komplex-Ions zu erzeugen. Somit sagen wir voraus, dass AgCl in einer 1,0 M KCl-Lösung ungefähr die gleiche Löslichkeit aufweist wie in reinem Wasser, was 105-mal größer ist als die aufgrund des allgemeinen Ioneneffekts vorhergesagte. (Tatsächlich ist die gemessene Löslichkeit von AgCl in 1,0 M KCl fast um den Faktor 10 größer als die in reinem Wasser, was hauptsächlich auf die Bildung anderer chloridhaltiger Komplexe zurückzuführen ist.)
Übung \(\pageIndex{2}\)
Berechnen Sie die Löslichkeit von Quecksilber (II) iodid (HgI2) in jeder Situation:
- reines Wasser
- eine 3,0 M Lösung von NaI, unter der Annahme, dass 2- die einzige Hg-haltige Spezies ist, die in signifikanten Mengen vorhanden ist
Ksp = 2,9 × 10-29 für HgI2 und Kf = 6,8 × 1029 für 2−.
Antwort
- 1.9 × 10-10 M
- 1.4 M
Komplexbildner, Moleküle oder Ionen, die die Löslichkeit von Metallsalzen durch Bildung löslicher Metallkomplexe erhöhen, sind übliche Bestandteile von Waschmitteln. Langkettige Carbonsäuren, die Hauptbestandteile von Seifen, bilden mit Ca2+ und Mg2+ unlösliche Salze, die in hohen Konzentrationen in “hartem” Wasser vorliegen. Die Ausfällung dieser Salze erzeugt einen Badewannenring und verleiht der Kleidung einen grauen Farbton. Die Zugabe eines Komplexbildners wie Pyrophosphat (O3POPO34− oder P2O74−) oder Triphosphat (P3O105−) zu Detergenzien verhindert, dass die Magnesium- und Calciumsalze ausfallen, da die Gleichgewichtskonstante für die Komplexionenbildung groß ist:
mit
Phosphate können jedoch Umweltschäden verursachen, indem sie die Eutrophierung fördern, das Wachstum übermäßiger Algenmengen in einem Gewässer, was schließlich zu einer starken Abnahme des Gehalts an gelöstem Sauerstoff führen kann, der Fische und andere Wasserorganismen abtötet. Infolgedessen haben viele Staaten in den Vereinigten Staaten die Verwendung phosphathaltiger Reinigungsmittel verboten, und Frankreich hat ihre Verwendung ab 2007 verboten. “Phosphatfreie” Waschmittel enthalten verschiedene Arten von Komplexbildnern, wie Derivate von Essigsäure oder anderen Carbonsäuren. Die Entwicklung von Phosphatersatzstoffen ist ein Gebiet intensiver Forschung.
Kommerzielle Wasserenthärter verwenden auch einen Komplexbildner, um hartes Wasser zu behandeln, indem sie das Wasser über Ionenaustauscherharze leiten, die komplexe Natriumsalze sind. Wenn Wasser über das Harz fließt, wird Natriumion aufgelöst, und unlösliche Salze fallen auf die Harzoberfläche aus. Auf diese Weise behandeltes Wasser hat aufgrund des Vorhandenseins von Na + einen salzigeren Geschmack, enthält jedoch weniger gelöste Mineralien.
Eine weitere Anwendung von Komplexbildnern findet sich in der Medizin. Im Gegensatz zu Röntgenstrahlen kann die Magnetresonanztomographie (MRT) relativ gute Bilder von Weichteilen wie inneren Organen liefern. Die MRT basiert auf den magnetischen Eigenschaften des 1H-Kerns von Wasserstoffatomen in Wasser, der ein Hauptbestandteil von Weichteilen ist. Da die Eigenschaften von Wasser nicht sehr stark davon abhängen, ob es sich in einer Zelle oder im Blut befindet, ist es schwierig, detaillierte Bilder dieser Gewebe mit gutem Kontrast zu erhalten. Um dieses Problem zu lösen, haben Wissenschaftler eine Klasse von Metallkomplexen entwickelt, die als “MRT-Kontrastmittel” bekannt sind.” Die Injektion eines MRT-Kontrastmittels in einen Patienten beeinflusst selektiv die magnetischen Eigenschaften von Wasser in Zellen normalen Gewebes, in Tumoren oder in Blutgefäßen und ermöglicht es Ärzten, jedes davon separat zu ” sehen” (Abbildung \(\pageIndex{2}\)). Eines der wichtigsten Metallionen für diese Anwendung ist Gd3+, das mit sieben ungepaarten Elektronen hochparamagnetisch ist. Da Gd3 + (aq) ziemlich toxisch ist, muss es als sehr stabiler Komplex verabreicht werden, der im Körper nicht dissoziiert und über die Nieren intakt ausgeschieden werden kann. Als Komplexbildner für Gadolinium werden Liganden wie DTPA5− (Diethylentriaminpentaessigsäure) verwendet, deren vollständig protonierte Form hier dargestellt ist.
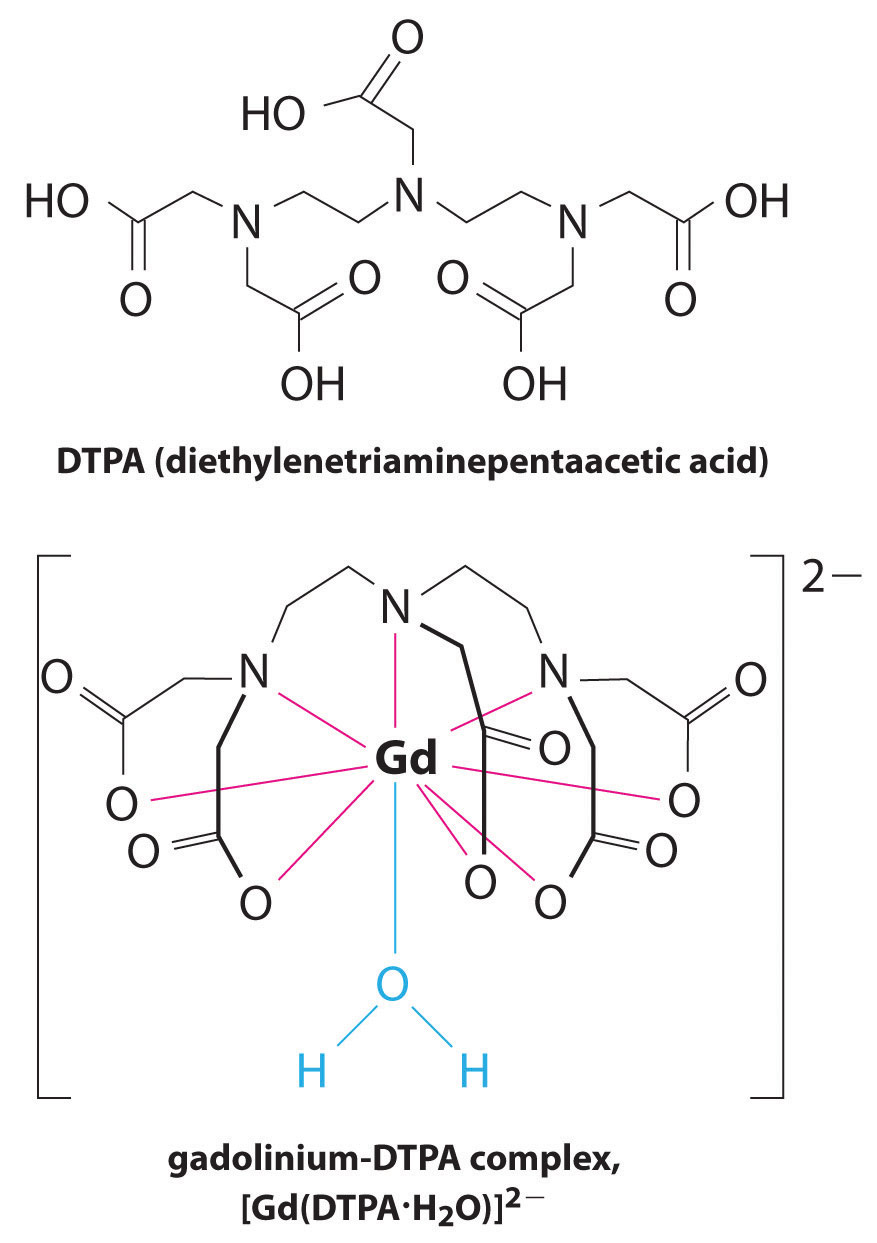
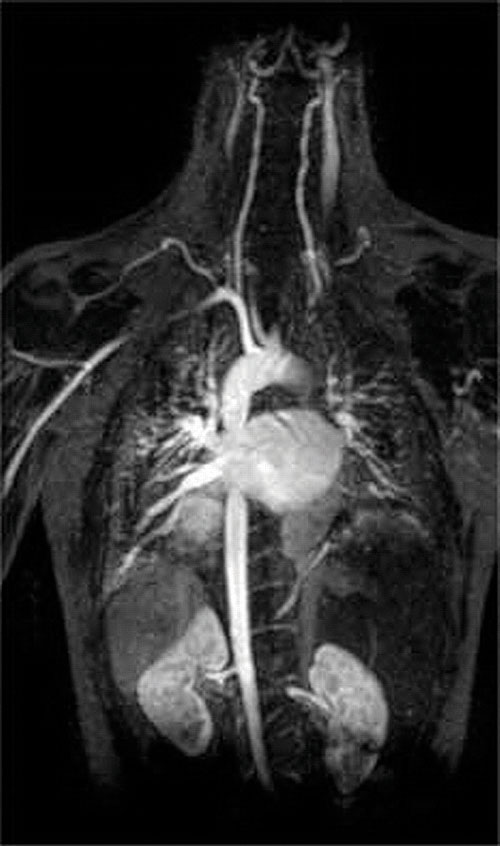
Abbildung \(\pageIndex{2}\): Ein MRT-Bild des Herzens, der Arterien und Venen. Wenn einem Patienten ein paramagnetisches Metallkation in Form eines stabilen Komplexes injiziert wird, der als MRT-Kontrastmittel bekannt ist, werden die magnetischen Eigenschaften von Wasser in Zellen verändert. Da die verschiedenen Umgebungen in verschiedenen Zelltypen unterschiedlich reagieren, kann ein Arzt detaillierte Bilder von Weichteilen erhalten.