2.3: Kohlenmonoxid und Rückbindung
Allgemeine Eigenschaften
CO ist ein Dativ-Ligand vom L-Typ, der die Oxidationsstufe des Metallzentrums bei der Bindung nicht beeinflusst, aber die Gesamtelektronenzahl um zwei Einheiten erhöht. Wir haben kürzlich gesehen, dass im Carbonylligand wirklich zwei Bindungsinteraktionen im Spiel sind: eine Ligand-zu-Metall-n → dσ-Wechselwirkung und eine Metall-zu-Ligand-dn → π * -Wechselwirkung. Die letztere Wechselwirkung wird als Rückbindung bezeichnet, da das Metall die Elektronendichte an den Liganden zurückgibt. Um mich an die Existenz von Backbonding zu erinnern, verwende ich gerne die rechte Resonanzstruktur, wann immer dies möglich ist; Es ist jedoch wichtig, daran zu denken, CO als Liganden vom L-Typ zu behandeln, unabhängig davon, welche Resonanzform gezeichnet wird.

Orbitale Wechselwirkungen in M = C= O.
CO ist ein starker σ-Donor (oder σ-Base) und ein guter π-Akzeptor (oder π-Säure). Die Eigenschaften von ligiertem CO hängen stark von der Identität des Metallzentrums ab. Insbesondere bestimmen die elektronischen Eigenschaften des Metallzentrums die Bedeutung der Rückbindung in Metallcarbonylkomplexen. Am deutlichsten sind elektronenreichere Metallzentren besser in der Lage, sich an CO zu binden. Warum ist es wichtig, die Stärke des Backbondings zu ermitteln?
Die Infrarotspektroskopie wurde bekanntermaßen verwendet, um die Idee des Backbonding empirisch zu unterstützen. Die folgende Tabelle ordnet einige Metallcarbonylkomplexe in “periodischer” Reihenfolge an und liefert die Frequenz, die dem C = O-Streckmodus entspricht. Beachten Sie, dass ausnahmslos jedes komplexierte CO eine niedrigere Streckfrequenz aufweist als das freie CO. Backbonding ist schuld! Die C–O-Bindungsordnung in komplexiertem Kohlenmonoxid ist (fast immer) niedriger als die von freiem CO.

C=O Streckfrequenzen in Metall-Carbonyl-Komplexen. Scheint hier etwas nicht in Ordnung zu sein?
Die obige Abbildung zeigt eine deutliche Zunahme der Häufigkeit (eine Zunahme der C–O-Bindungsreihenfolge), wenn wir uns von links nach rechts über das Periodensystem bewegen. Dieser Befund mag seltsam erscheinen, wenn wir bedenken, dass die Anzahl der d-Elektronen im neutralen Metall zunimmt, wenn wir uns von links nach rechts bewegen. Sollten Metallzentren mit mehr d-Elektronen nicht besser im Backbonding (und “elektronenreicher”) sein? Was ist hier los? Erinnern Sie sich an den periodischen Trend der Orbitalenergie. Wenn wir uns von links nach rechts bewegen, nehmen die d-Orbitalenergien ab und die Energien der dn- und π * -Orbitale trennen sich. Infolgedessen verschlechtert sich die rückbindende Orbitalwechselwirkung (denken Sie daran, dass starke Orbitalwechselwirkungen gut abgestimmte Orbitalenergien erfordern), wenn wir uns den elektronegativeren späten Übergangsmetallen zuwenden! Wir können eine Analogie zu Enaminen und Enolethern aus der organischen Chemie ziehen. Das elektronegativere Sauerstoffatom in Enolethern ist ein schlechterer Elektronendonor als das Stickstoffatom des Enamins.

Die Bedeutung der Rückbindung hängt von der Elektronegativität des Metalls und seiner Elektronendichte ab.
Natürlich darf auch der Beitrag anderer Liganden am Metallzentrum zur Rückbindung nicht vergessen werden. Logischerweise neigen elektronenspendende Liganden dazu, die Rückbindung stärker zu machen (sie machen das Metall zu einem besseren Elektronendonor), während elektronenziehende Liganden die Rückbindung verschlechtern. Die Zugabe von elektronenreichen Phosphinliganden zu einem Metallzentrum verringert beispielsweise die CO-Streckfrequenz aufgrund einer verbesserten Rückbindung.
Carbonylliganden sind bekanntermaßen in der Lage, mehrere Metallzentren zu überbrücken. Die Bindung in verbrückten Carbonylkomplexen kann entweder “traditionell” oder delokalisiert sein, abhängig von der Struktur des Komplexes und dem Brückenmodus. Die Vielfalt der Brückenmoden ergibt sich aus den verschiedenen Elektronendonoren und Akzeptoren, die auf dem CO-Liganden vorhanden sind (und der Möglichkeit der delokalisierten Bindung). Bekannte Überbrückungsmodi sind in der folgenden Abbildung dargestellt.
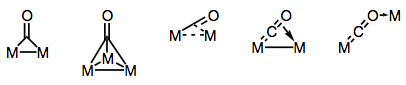
Brücken bauen mit Carbonylliganden!