3.3 Konformation von Cyclohexan
Konformationen von Cyclohexan
Eine planare Struktur für Cyclohexan ist eindeutig unwahrscheinlich. Die Bindungswinkel wären notwendigerweise 120º, 10,5 º größer als der ideale Tetraederwinkel. Außerdem würde jede Kohlenstoff-Kohlenstoff-Bindung in einer solchen Struktur verfinstert. Die resultierenden Winkel- und Bedeckungsdehnungen würden diese Struktur stark destabilisieren. Wenn zwei Kohlenstoffatome auf gegenüberliegenden Seiten des sechsgliedrigen Rings aus der Ebene des Rings herausgehoben werden, kann ein Großteil der Winkeldehnung eliminiert werden.
Diese Bootsstruktur hat immer noch zwei verfinsterte Bindungen und eine starke sterische Verdrängung von zwei Wasserstoffatomen am “Bug” und “Heck” des Bootes. Dieses sterische Gedränge wird oft als sterisches Hindernis bezeichnet. Durch Verdrehen der Bootskonformation kann die sterische Behinderung teilweise gelindert werden, aber der Twist-Boat-Conformer behält immer noch einige der Belastungen bei, die den Bootskonformer charakterisieren. Schließlich wird durch Anheben eines Kohlenstoffs über die Ringebene und des anderen unter die Ebene ein relativ dehnungsfreier Stuhlkonformer gebildet. Dies ist die vorherrschende Struktur von Cyclohexanmolekülen.
Untersuchungen über die Konformationen von Cyclohexan wurden von H. Sachse (1890) und E. Mohr (1918) eingeleitet, aber erst 1950 wurde eine vollständige Behandlung der vielfältigen Folgen der Interkonvertierung von Stuhlkonformern und der unterschiedlichen Orientierungen von Pendentenbindungen von D. H. R. Barton (Nobelpreis 1969 zusammen mit O. Hassel) aufgeklärt. Die folgende Diskussion stellt einige der wesentlichen Merkmale dieser Konformationsanalyse vor.
Bei sorgfältiger Untersuchung einer Stuhlkonformation von Cyclohexan stellen wir fest, dass die zwölf Wasserstoffatome strukturell nicht äquivalent sind. Sechs von ihnen befinden sich an der Peripherie des Kohlenstoffrings und werden als äquatorial bezeichnet. Die anderen sechs sind oberhalb und unterhalb der ungefähren Ebene des Rings ausgerichtet (drei an jeder Stelle) und werden als axial bezeichnet, da sie parallel zur Symmetrieachse des Rings ausgerichtet sind.
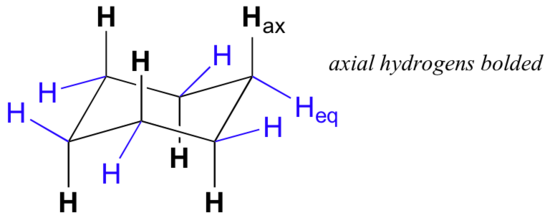
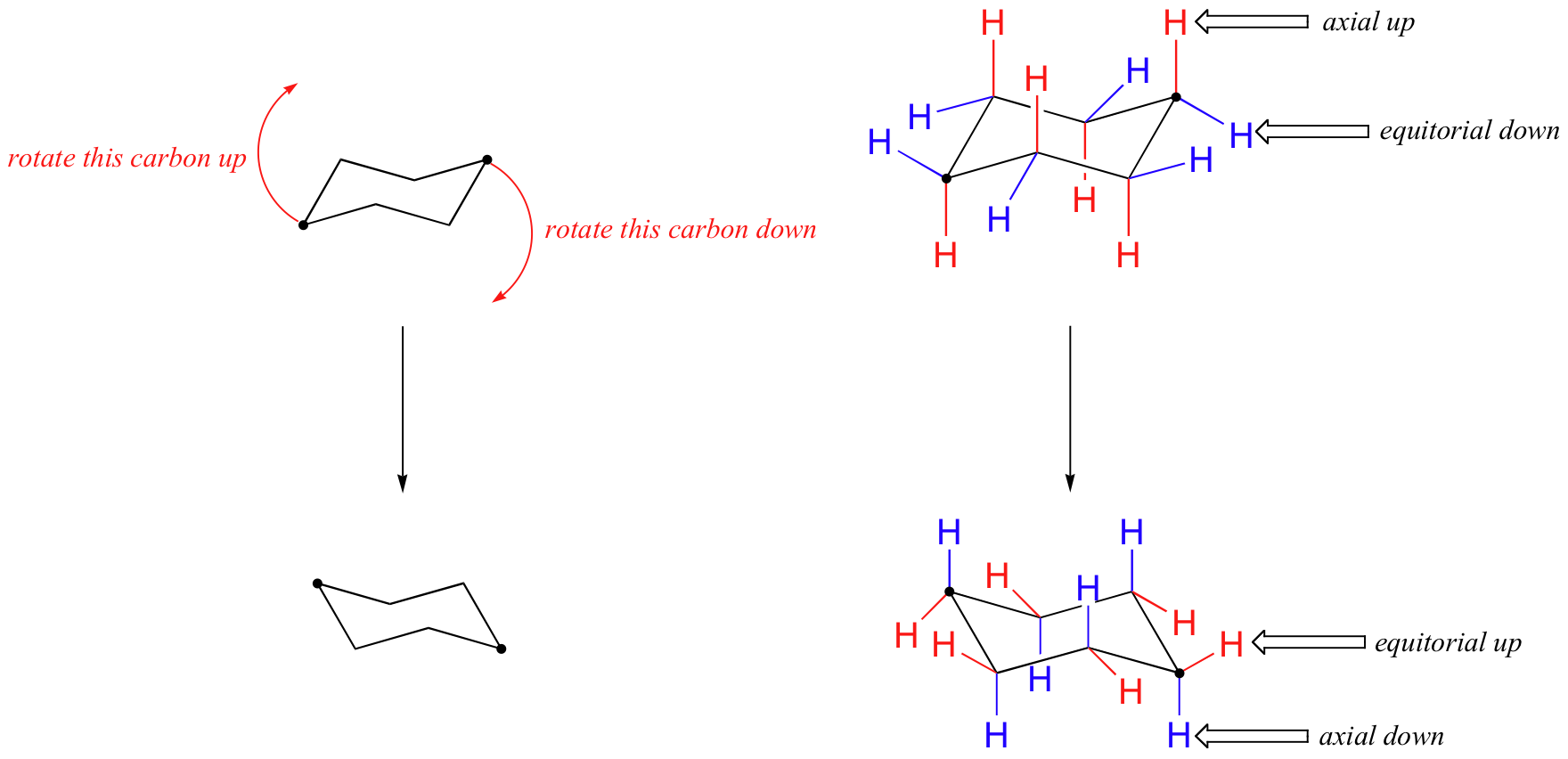
In der obigen Abbildung sind die äquatorialen Wasserstoffatome blau und die axialen Wasserstoffatome fett gedruckt. Da es zwei äquivalente Stuhlkonformationen von Cyclohexan im schnellen Gleichgewicht gibt, haben alle zwölf Wasserstoffatome 50% äquatorialen und 50% axialen Charakter. Die folgende Abbildung zeigt, wie ein Molekülmodell von Cyclohexan zwischen zwei verschiedenen Molekülkonformationen konvertiert wird – dies sollten Sie mit Modellen üben. Beachten Sie, dass ein ‘Ringflip’ bewirkt, dass äquatoriale Wasserstoffatome axial werden und umgekehrt.
Da axiale Bindungen parallel zueinander sind, erleiden Substituenten, die größer als Wasserstoff sind, im Allgemeinen eine größere sterische Verdrängung, wenn sie eher axial als äquatorial ausgerichtet sind. Folglich werden substituierte Cyclohexane bevorzugt Konformationen annehmen, in denen die größeren Substituenten äquatoriale Orientierung annehmen.
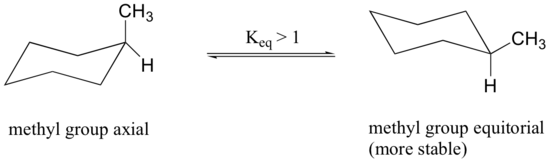
Wenn die Methylgruppe in der obigen Struktur eine axiale Position einnimmt, erleidet sie eine sterische Verdrängung durch die beiden axialen Wasserstoffatome, die sich auf derselben Seite des Rings befinden.

Die Konformation, in der die Methylgruppe äquatorial ist, ist stabiler, und somit liegt das Gleichgewicht in dieser Richtung.
Die relative sterische Hinderung, die von verschiedenen Substituentengruppen erfahren wird, die in einer axialen gegen äquatorialen Position auf Cyclohexan orientiert sind, kann durch das Konformationsgleichgewicht der Verbindung bestimmt werden. Die entsprechende Gleichgewichtskonstante hängt mit der Energiedifferenz zwischen den Konformeren zusammen, und das Sammeln solcher Daten ermöglicht es uns, die relative Tendenz von Substituenten zu bewerten, an einem äquatorialen oder axialen Ort zu existieren.Eine Tabelle dieser Werte für freie Energie (manchmal auch als A-Werte bezeichnet) kann hier eingesehen werden.
Wenn man sich die Energiewerte in dieser Tabelle ansieht, ist es klar, dass die scheinbare “Größe” eines Substituenten (in Bezug auf seine Präferenz für äquatoriale gegenüber axialer Orientierung) durch seine Breite und Bindungslänge an Cyclohexan beeinflusst wird, wie durch die Tatsache belegt, dass eine axiale Vinylgruppe weniger gehindert ist als Ethyl und Jod etwas weniger als Chlor.
Wir haben bereits erwähnt, dass Cycloalkane mit zwei oder mehr Substituenten an verschiedenen Ringkohlenstoffatomen als Paar (manchmal mehr) von Konfigurations-Stereoisomeren existieren. Nun gilt es zu untersuchen, wie günstige Ringkonformationen die Eigenschaften der Konfigurationsisomeren beeinflussen. Denken Sie daran, dass Konfigurations-Stereoisomere stabil sind und sich nicht leicht ineinander umwandeln lassen, wohingegen Konformations-Isomere normalerweise schnell ineinander übergehen. Bei der Untersuchung möglicher Strukturen für substituierte Cyclohexane ist es sinnvoll, zwei Prinzipien zu folgen:
( i) Stuhlkonformationen sind im Allgemeinen stabiler als andere Möglichkeiten.
(ii) Substituenten auf Stuhlkonformeren nehmen aufgrund der erhöhten sterischen Behinderung axialer Stellen bevorzugt äquatoriale Positionen ein.
Die folgenden Gleichungen und Formeln veranschaulichen, wie das Vorhandensein von zwei oder mehr Substituenten an einem Cyclohexanring die Interkonversion der beiden Ringkonformeren auf vorhersagbare Weise stört.
Bei 1,1-disubstituierten Cyclohexanen muss einer der Substituenten notwendigerweise axial und der andere äquatorial sein, unabhängig davon, welcher Stuhlkonformer betrachtet wird. Da die Substituenten in 1,1-Dimethylcyclohexan gleich sind, sind die beiden Konformeren identisch und in gleicher Konzentration vorhanden. In 1-t-Butyl-1-methylcyclohexan ist die t-Butylgruppe viel größer als das Methyl, und der Stuhlkonformer, in dem die größere Gruppe äquatorial ist, wird im Gleichgewicht bevorzugt( > 99%). Folglich ist die Methylgruppe in dieser Verbindung in ihrer Orientierung fast ausschließlich axial.
Bei 1,2-, 1,3- und 1,4-disubstituierten Verbindungen ist die Analyse etwas aufwendiger. Es ist immer möglich, beide Gruppen äquatorial zu haben, aber ob dies eine cis-Beziehung oder eine Trans-Beziehung erfordert, hängt von der relativen Lage der Substituenten ab. Wenn wir um den Ring von Kohlenstoff # 1 bis # 6 zählen, ändert die oberste Bindung an jedem Kohlenstoff seine Orientierung von äquatorial (oder axial) zu axial (oder äquatorial) und zurück. Es ist wichtig, sich daran zu erinnern, dass sich die Bindungen auf einer bestimmten Seite einer Stuhlringkonformation immer auf diese Weise abwechseln. Daher sollte klar sein, dass für die cis-1,2-Disubstitution einer der Substituenten äquatorial und der andere axial sein muss; im Trans-Isomer können beide äquatorial sein. Wegen der abwechselnden Natur von äquatorialen und axialen Bindungen gilt die entgegengesetzte Beziehung für die 1,3-Disubstitution (cis ist alles äquatorial, trans ist äquatorial / axial).
Schließlich kehrt die 1,4-Disubstitution zum 1,2-Muster zurück:
Die obige Analyse sollten Sie sich nicht merken: lieber, Machen Sie es sich bequem, Cyclohexan in der Stuhlkonformation zu zeichnen, mit Bindungen, die für axiale und äquatoriale Substituenten in die richtigen Richtungen zeigen. Wenn Sie eine Struktur korrekt in der Stuhlkonformation zeichnen können, sollten Sie immer feststellen können, welche Positionen axial und welche äquatorial sind.