7.5: Complex IV
Komplex IV ist das Endziel in der Elektronentransportkette. Hier werden die Elektronen, die durch die anderen Mitglieder des respiratorischen Superkomplexes gereist sind, schließlich an O2 abgegeben und zu Wasser reduziert. Das ist eine beeindruckende Leistung, denn zwischen der anfänglichen Zugabe eines Elektrons und der endgültigen Freisetzung von Wasser müssen eine Reihe reaktiver Sauerstoffspezies gebildet werden, aber die Reaktion wird so gesteuert, dass die Möglichkeit einer Zellschädigung minimiert wird. Gleichzeitig werden mehr Protonen über die innere Mitochondrienmembran gepumpt.
- Im Komplex IV werden Elektronen an ihren endgültigen Bestimmungsort, ein Molekül O2, geliefert.
- Das O2 wird zu Wasser reduziert.
Übung \(\pageIndex{1}\)
Schreiben Sie eine ausgewogene Redox-Halbreaktion, um zu zeigen, wie viele Elektronen benötigt werden, um ein Sauerstoffmolekül zu Wasser zu reduzieren.
Antwort
O2 → H2O
O2 → 2 H2O (O ausgeglichen)
O2 + 4H+ → 2 H2O (H ausgeglichen)
O2 + 4e- + 4H+ → 2 H2O (Ladung ausgeglichen)
Die Röntgenstruktur von Komplex IV ist unten gezeigt. Auch hier befindet sich die Matrix am unteren Ende des Bildes und der Intermembranraum oben. Dort dockt das Cytochrom c an, ganz oben.
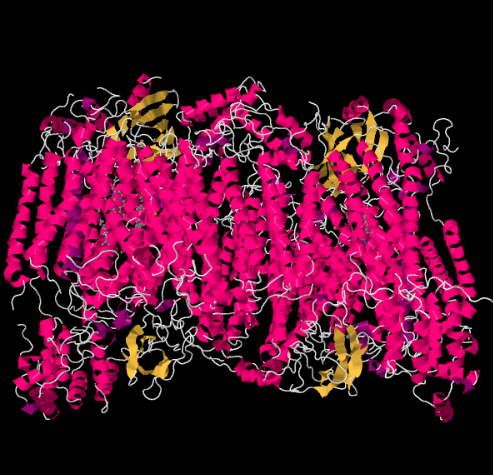
Der mobile Elektronenträger Cytochrom c bindet an Komplex IV und liefert ein Elektron an eine zweikernige Kupferstelle namens CuA. Wir können diese zweikernige Kupferstelle sehen, wenn wir unten in das Protein schauen. Es ist nur an das Protein gebunden und sonst nichts, so dass wir nur die beiden Kupferionen alleine oben im Bild sehen. Dieses Paar Kupferatome sendet das Elektron an ein Häm, Cytochrom a, das Sie unten und links sehen können. Von dort geht das Elektron zu einem anderen zweikernigen Cluster über, der diesmal aus einem Häm-gebundenen Eisen (Cytochrom a3) und einem nahe gelegenen Kupfer (CuB) besteht. Diese zweikernige Stelle führt die Reduktion von Dioxygen zu Wasser durch. In der Struktur ist ein Kohlenmonoxidmolekül im aktiven Zentrum zwischen Cytochrom a3 und CuB gebunden. Die Kohlenstoffatome sind an das Eisen gebunden und der Sauerstoff ist an das Kupfer gebunden. Dort würde das Sauerstoffmolekül binden und darauf warten, zu Wasser reduziert zu werden.
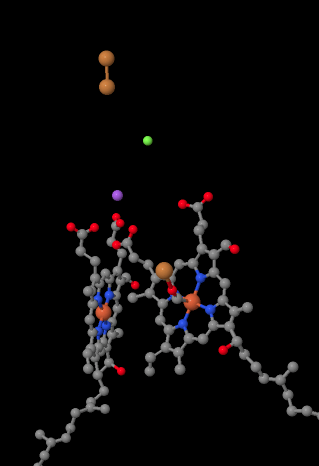
Wenn Sie darüber nachdenken, bedeutet dies, dass sich Elektronen in die entgegengesetzte Richtung bewegen als in den ersten drei Komplexen. In den Komplexen I und II wurden Elektronen aus der Mitochondrienmatrix abgegeben und wanderten in Richtung des Intermembranraums, wobei sie an einem Ubichinon in der Mitochondrienmembran anhielten. In Komplex III setzten sich Elektronen in dieser “Aufwärts” -Richtung von der Mitochondrienmembran zum Cytochrom c im Intermembranraum fort. In Komplex IV kehren Elektronen ihren Kurs um und wandern zurück in Richtung der Mitochondrienmatrix. Denken Sie daran, dass die Mitochondrienmatrix aufgrund des Protonenpumpens n-dotiert ist, sodass diese Elektronen von der positiven Seite der Membran zur negativen Seite wandern. Das muss schwierig sein.
- Im Komplex IV verläuft der Elektronentransport in die entgegengesetzte Richtung zu den anderen Komplexen.
- Elektronen wandern von der Intermembranraumseite zur mitochondrialen Matrixseite gegen den Ladungsgradienten.
Schauen wir uns noch einmal die wichtigen Liganden für den Komplex an. Ein Cartoon ist unten gezeigt. In der Karikatur wird das O2-Molekül gezeigt, das in dieser Position zwischen dem Häm a3 und dem Jungen bindet. Diese dinukleare Metallstelle ist der Ort, an dem das Sauerstoffmolekül zu Wasser reduziert wird.
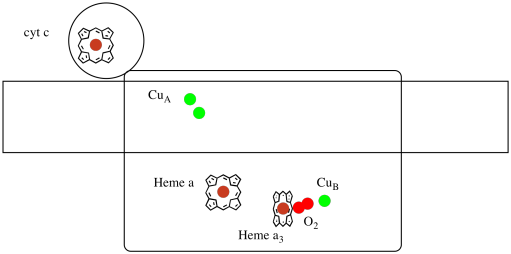
Da vier Elektronen benötigt werden, um O2 zu H2O zu reduzieren, müssen vier Cytochrom-c-Moleküle an Komplex IV binden, bevor diese Reduktion fortgesetzt werden kann. Es ist wahrscheinlich, dass die Koordinationsumgebung des Sauerstoffmoleküls – zwischen zwei Metallen, anstatt nur an eines gebunden – es ermöglicht, schneller bis zum Wasser reduziert zu werden, anstatt reaktive Sauerstoffspezies zu bilden, die in der Zelle bestehen bleiben, wie Peroxide.
Übung \(\pageIndex{2}\)
Angenommen, das Eisen in Häm a3 beginnt in einem reduzierten Fe (II) -Zustand und das CuB beginnt in einem reduzierten Cu (I) -Zustand. Stellen Sie einen Mechanismus für die Reduktion von Sauerstoff zu Wasser unter Zugabe von vier Elektronen und vier Protonen bereit. Verwenden Sie Fe (II) als Elektronendonor und Lysin als Protonendonor.
Antwort
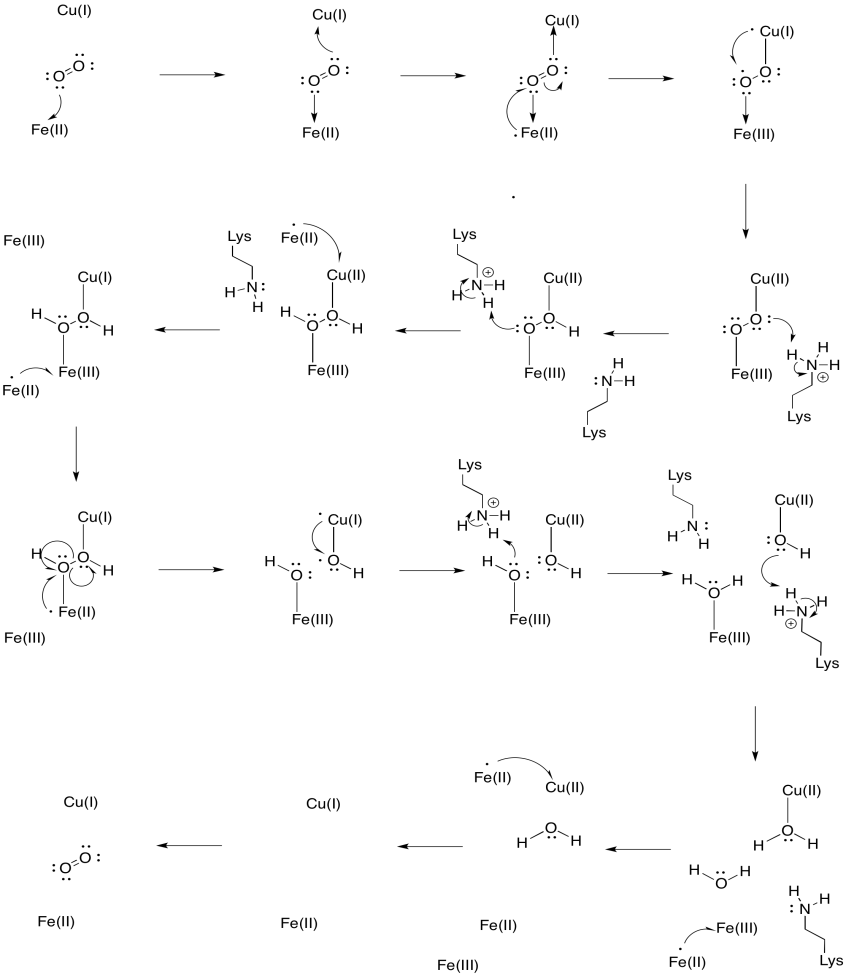
Zusätzlich zu diesen beiden Metallen gibt es auch ein modifiziertes Histidin-Tyrosin-Konjugat, das an CuB gebunden ist. Es ist vorgeschlagen worden, dass dieses Tyrosin eine andere Quelle von unmittelbaren Elektronen zur Verfügung stellt, die in der Verminderung verwendet werden können.
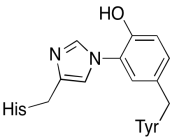
Übung \(\pageIndex{3}\)
Zeigen Sie, warum ein Tyrosin eine Quelle sowohl eines Protons als auch eines Elektrons in biochemischen Prozessen sein kann.
Antwort
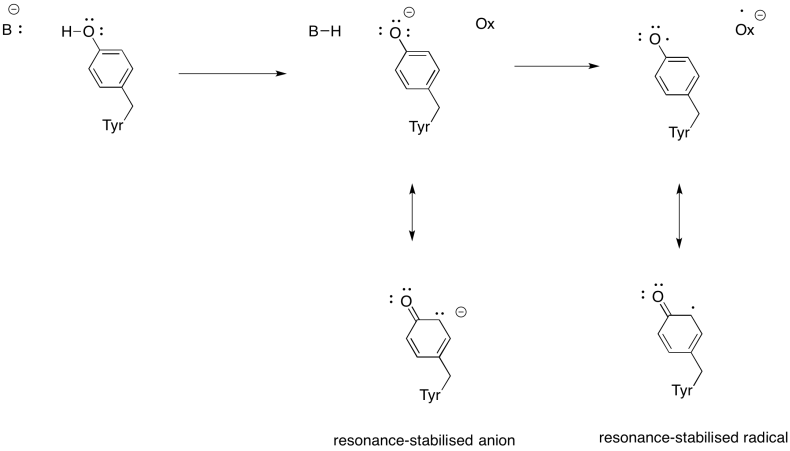
Neben der Notwendigkeit, Sauerstoff zu Wasser zu reduzieren, trägt Komplex IV auch zum Protonengradienten bei und pumpt zusätzliche Protonen über die Mitochondrienmembran. Diese Aufgabe stellt zusätzliche Herausforderungen dar. Ein einfacher Kopplungsmechanismus ist nicht möglich, da sich die Elektronen in die entgegengesetzte Richtung bewegen. Es ist jedoch so, dass der Mechanismus Konformationsänderungen im Protein beinhaltet, die auftreten, wenn die Metalle die Oxidationsstufen ändern. Subtile Veränderungen in der Umgebung können zu einer Verschiebung von Aminosäureresten in der Nähe führen. Es ist leicht vorstellbar, dass eine bestimmte Aminosäure, wenn sie sich nach oben in Richtung des Intermembranraums verschiebt, ein Proton mit sich ziehen kann.
- Protonenpumpen und Elektronentransport laufen im Komplex IV gegenläufig und müssen entkoppelt werden.
- Das Pumpen von Protonen in Komplex IV muss auf Konformationsänderungen beruhen.
Übung \(\pageIndex{4}\)
Die CuA-Site enthält zwei Kupfer, umschlossen von zwei überbrückenden Cysteinen. Beide sind an terminale Histidine gebunden. Zusätzlich ist ein Kupfer durch ein zusätzliches Methionin gebunden, während das andere durch ein Carbonyl aus dem Proteinrückgrat gebunden ist.
- Zeichnen Sie die Kupfer in ihre Bindungsstellen.
- Beschreiben Sie die Geometrie jedes Kupfers.
- Wenn jedes Kupfer Cu (I) ist, wie hoch ist die koordinierte Elektronenzahl an jedem Kupfer im Komplex?
- Wenn jedes Kupfer Cu (I) ist, wie hoch ist die Gesamtladung des Komplexes?
Antwort a)
a)
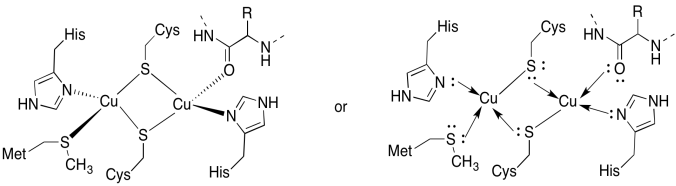
Antwort b)
b) tetraedrisch
Antwort c)
c) Cu (I) = d10
4 Spender = 8 e-
gesamt = 18e-
Antwort d)
d) 2 x Cu (I) = 2+
2 x Cys-S- = 2-
Alle anderen neutral
Gesamt = 0
Übung \(\pageIndex{5}\)
Das Kupfer in der CuB-Stelle ist durch zwei Histidine und das Histidin-Tyrosin-Konjugat gebunden.
- Ziehen Sie das Kupfer in die Bindungsstelle.
- Beschreiben Sie die Geometrie des Kupfers.
- Wenn Kupfer Cu (I) ist, wie hoch ist die koordinierte Elektronenzahl im Komplex?
- Wenn Kupfer Cu (I) ist, wie hoch ist die Gesamtladung des Komplexes?
Antwort a)
a)
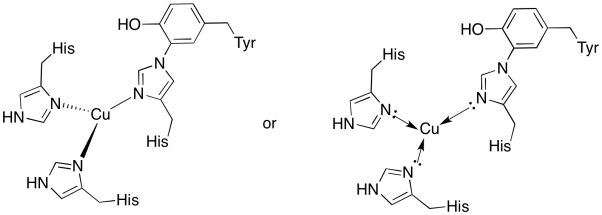
Antwort b)
b) trigonal planar
Antwort c)
c) Cu (I) = d10
3 Spender = 6 e-
insgesamt = 16 e-
Antwort d)
d) Cu(I) = 1+
histidine neutral
Insgesamt = 1+
Übung \(\pageIndex{6}\)
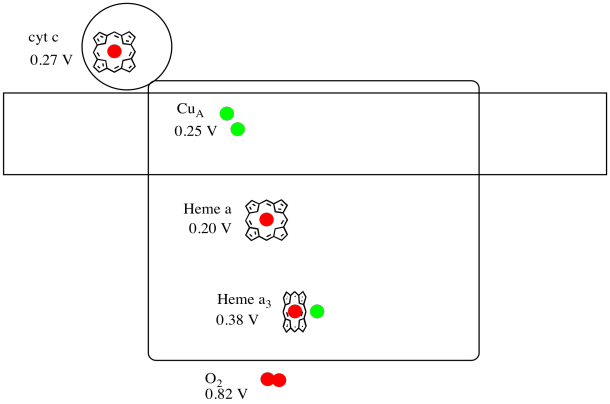
Es ist schwierig, das Reduktionspotential einer einzelnen Stelle innerhalb eines Proteins zu messen. Forscher konnten diese Werte jedoch durch Messung von EPR-Spektren unter verschiedenen Bedingungen abschätzen. Nehmen wir die Reduktionspotentiale unten an, zeichnen Sie ein Reaktionsfortschrittsdiagramm für den Transport eines Elektrons vom Cytochrom c zum molekularen Sauerstoff.
 Antwort
Antwort
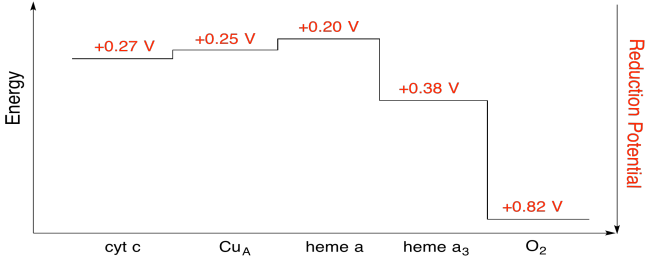
Übung \(\pageIndex{7}\)
Berechnen Sie anhand der Werte in der obigen Abbildung die Energieänderung, wenn ein Elektron von Häm a nach Häm a3 übertragen wird.
Antwort
Angenommen, die Reduktionspotentiale sind:
Häm a(ox) + e- → Häm a(rot) Eored = 0,20 V
Häm a3(ox) + e- → Häm a3(rot) Eored = 0.38 V
Dann ergibt die Potentialdifferenz für die Reaktion ΔEo = 0,38 – (0,20) V = 0,18 V.
Die Faradaysche Beziehung ΔG = – n F ΔEo ergibt
ΔG = – 1 x 96.485 J V-1 mol-1 x 0,13 V = 17.367 J mol-1 = 17,4 kJ mol-1
Namensnennung – weitergabe unter gleichen Bedingungen
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)