Atlas der Pflanzen- und Tierhistologie
1. Cohesins
2. Statine
Die Chromatinorganisation ändert sich während des Zellzyklus dramatisch. Während der Interphase (G1-, S- und G2-Phasen) bleibt ein großer Teil des Chromatins locker und nicht kondensiert (Euchromatin), und der andere Teil erscheint in einem kondensierten Zustand (Heterochromatin). Es gibt Chromatinregionen, die während des normalen Verhaltens der Zelle zwischen kondensierten und nicht kondensierten Zuständen wechseln können. Viele Gene müssen während der Interphase exprimiert werden, und sie müssen für RNA-Polymerasen und Transkriptionsfaktoren zugänglich sein, was in einem weniger kondensierten Zustand des Chromatins einfacher ist. Während der Mitose (M-Phase) erreicht Chromatin jedoch ein hohes Maß an Verdichtung und Organisation, um Chromosomen zu bilden. Die Trennung der Chromosomen zwischen den beiden Tochterzellen ist ein sehr wichtiger Prozess während der Zellteilung. Die Kondensation von Chromatin zu Chromomen ist eine Folge von Histonmodifikationen. Darüber hinaus ist eine Gruppe von Proteinen, die als SMC (Structural Maintenance Chromosome) bekannt sind, an diesem Verdichtungsmechanismus beteiligt. Cohesine und Condensine sind SMC-Proteine.
Cohesin
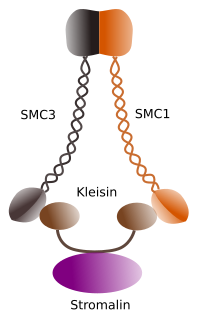
Abbildung 1. Struktur und molekulare Zusammensetzung von Cohesin SMC 1 und 3 (Bild von Ángela L. Debenedetti y Daniel García, Biologiestudenten . Adaptiert von Barbero 2009).
Die erste Funktion, die Kohäsinen (Abbildung 1) zugewiesen wird, und deshalb ihr Name, besteht darin, Schwesterchromatiden entlang des Zellzyklus zusammenzuhalten, bis sie in Anaphase getrennt sind. In Saccharomyces cerevisae, einer Hefe, werden Kohäsinkomplexe an Chromatin in G1- und S-Phase gebunden, während die DNA repliziert wird. Dieser Vorgang wird als “Laden” bezeichnet und ist ATP-abhängig.
Während der Mitose ist eine korrekte Reihenfolge der Chromosomen in der Metaphasenplatte essentiell. Entscheidend ist auch der Verlust der Kohäsion zwischen Schwesterchromatiden, der die Migration jedes Chromatids zu entgegengesetzten mitotischen Spindelpolen während der Anaphase ermöglicht. Dieser Mechanismus der sofortigen und koordinierten Segregation ist möglich, weil Choesine aufhören, Schwesterchromatiden miteinander zu verbinden. Der Prozess muss in allen Chromosomen gleichzeitig ablaufen und mit den Bewegungen der Mikrotubuli-Motorproteine sowie der Polymerisation und Depolymerisation von Mikrotubuli des Spindelpols koordiniert werden. Die gleichzeitige Trennung von Schwesterchromatiden und Mikrotubuli-bezogener Aktivität ist das Ergebnis der Konvergenz zweier molekularer Wege, die durch die Aktivität des Cyclin-M-abhängigen Kynase-Enzyms M-CdK initiiert werden.
Zu Beginn der Mitose knüpfen Cohesine Verbindungen zwischen Schwesterchromatiden entlang der gesamten Länge der Chromatiden (Abbildung 2). M-CdK phosphoryliert Kleisin, eine Komponente von Cohesinen (Abbildung 1), während der Prophase und Prometaphase, was zur Dissoziation von Cohesinen aus Chromatidarmen führt, jedoch im Zentromerbereich verbleibt. Somit bleiben Chromatiden durch Zentromere gebunden. Die Phosphorylierung von Zentromerkohesinen wird durch die PP2A-Phosphatase verhindert, die mit dieser Region assoziiert ist. Auf diese Weise werden Chromosomen (Schwesterchromatiden, die durch Zentromere gebunden sind) in der Metaphasenplatte aufgereiht.
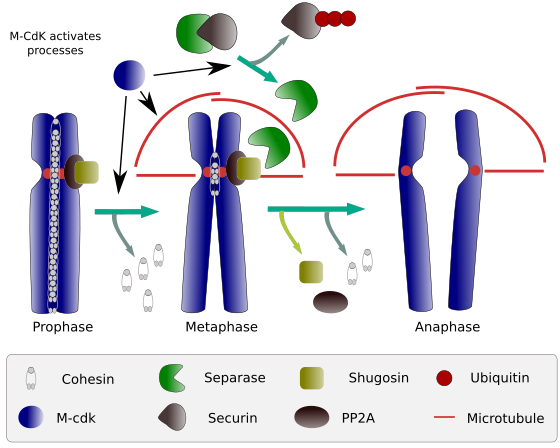
Abbildung 2. Cohesin-Funktion während der Mitose. Cohesine halten Schwesterchromatiden von Prophase zu Anaphase gebunden. M-CdK startet drei molekulare Prozesse, die in der M-Phase konvergieren: Es stimuliert die Bildung der mitotischen Spindel, trennt Cohesine außerhalb der Zentrome, löst den Separase-Securin-Komplex aus, wodurch Separase Shugoshin-PP2A entfernen kann, wodurch die Zentromere dank Cohesins zusammengehalten werden, und dann kann die Anaphase beginnen (Bild von L. Debenedetti y Daniel García, Biologiestudenten, angepasst von Barbero 2009).
Während der ersten Stadien der Mitose phosphoryliert M-CdK den Komplex APC (Anaphase Promoting Factor), der den Separase-Securin-Komplex spaltet. M-CdK phosphoryliert auch Proteine, die Mikrotubuli und Proteine der mitotischen Spindel ermöglichen, die Schwesterchromatiden zu ziehen und zu trennen, sobald die Chromatiden voneinander gelöst sind. Diese Kräfte werden während der Mitosezeit ausgeführt.
Choesine sind auch wichtige Akteure in der Chromosomenbewegung während Meisois. Das Verhalten von Chromosomen während der Meiose ist viel komplexer als in der Mitose, ebenso wie die Funktion von Kohäsinen. Während der ersten mioitischen Teilung verbinden Cohesine sowohl die Schwesterchromatiden (Arme und Zentromere) als auch homologe Chromosomen und halten die bivalenten Chromosomen zusammen, um die äquatoriale Platte der Metaphase I. Zu Beginn der Anaphase I, vermittelt durch Separaseproteine, lösen sich Cohesine sowohl von den Chromosomenarmen oder Schwesterchromatiden als auch von den Chromatiden homologer Chromosomen. Auch hier bleiben Kohäsine zentromerer Regionen gebunden. Jedes homologe Chromosom mit den beiden Schwesterchromatiden wandert zu Opositenspindelpolen. Auf diese Weise endet die erste meiotische Teilung. In der zweiten mioitischen Teilung, in der Prometaphase II, werden die Kinetochoren jedes Chromosoms an Mikrotubuli gebunden, die von gegenüberliegenden Spindelpolen kommen. Cohesine sind immer noch mit den zentromeren Regionen verbunden. In der Prometaphase II verursachen Mikrotubuli zumindest bei Säugetieren mechanische Kräfte in den Zentromerregionen, die zu einer Verlagerung der PP2A-Phosphatase aus den Zentromeren und, vermittelt durch Separase-Proteine, zur Freisetzung von Cohesin aus den Zentromeren führen. Dies geschieht während des Übergangs Metaphase II / Anaphase II. Wie bei der Mitose werden Schwesterchromatiden freigesetzt und können zu opositen Spindelpolen bewegt werden, um haploide Zellen zu bilden.
Cohesine waren an anderen Funktionen wie der DNA-Reparatur, der Kontrolle der Genexpression und mit verschiedenen neuen Rollen in biochemischen Prozessen beteiligt, die nicht mit dem Chromosomenverhalten während der M-Phase zusammenhängen.
Condensine
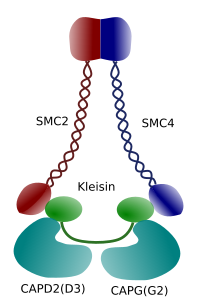
Abbildung 3. Struktur und molekulare Zusammensetzung eines Kondensins (Bild von Ángela L. Debenedetti y Daniel García, Biologiestudenten . Angepasst von Maeshima y Eltsov, 2008).
Die Kondensation von Chromatin in Chromosomen ist ein guter Mechanismus, um den Zugkräften standzuhalten, die während der Methaphase und Anaphase in der Mitose wirken. Darüber hinaus wäre es schwierig, eine korrekte Verteilung von Chromatin zwischen Tochterzellen, wenn DNA locker und gleichmäßig durch den Kern verteilt. Es würde eine massive Verschränkung von DNA-Strängen geben, die die DNA-Integrität und eine gleiche Zuordnung zwischen den beiden neuen Zellen behindern würde. Condensine (Abbildung 3) sind an der Chromatinkondensation beteiligt.
In-vitro-Experimente haben gezeigt, dass Kondensin die DNA-Spannung durch einen ATP-abhängigen Mechanismus induziert. Erstens, unterstützt durch das Enzym Topoisomerase I, produziert Condensin DNA-Super-Coiling. Zweitens fördert es die Bildung von Chromatinschleifen in Zusammenarbeit mit der Topoisomerase II. Es wird angenommen, dass diese Prozesse auch in der Prophase lebender Zellen auftreten.
Condensin-SMC-Dimer kann den Winkel vergrößern, den SMCs untereinander bilden und dann mit entfernten Chromatinregionen durch die molekularen Kopfdomänen jedes SMC in Kontakt treten. Danach kehrt die Dimerstruktur in die Ausgangsposition zurück und erzeugt auf diese Weise eine Zugkraft, die die DNA zieht, die in einer Schleife gefaltet wird (Abbildung 4). Durch Wechselwirkungen von SMC-Dimeren verschiedener Kondensinmoleküle werden Molekular-Chromatin-Komplexe höherer Ordnung gebildet und in Ringen oder Schleifen organisiert. Dieser Mechanismus führt zur Entstehung von mitotischen Chromosomen.
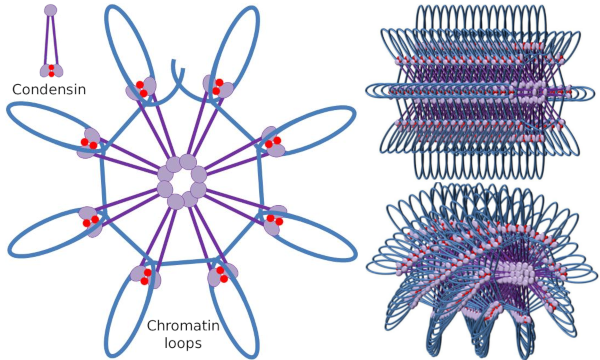
Abbildung 4. Schleifenbildung durch Kondensine (Bild rechts). Blaue Linie ist DNA. Bilder auf der rechten Seite versuchen, die Wirkung von Condesinen auf die dreidimensionale Organisation von Chromatin darzustellen. Beachten Sie, dass die hier abgebildete molekulare Regelmäßigkeit wahrscheinlich nicht in der realen Welt zu finden ist (Bilder von Ángela L. Debenedetti y Daniel García, Biologiestudenten. Angepasst von Maeshima y Eltsov, 2008).
Alle Organismen, einschließlich Bakterien, haben eine Art Kondensat. Pilze haben nur Typ I Condensin, Algen haben zwei Arten und C. elegans hat drei Arten. Die meisten Tiere und Pflanzen haben Kondensine der Typen I und II. In der HeLa-Zelllinie sind Typ I und II gleich häufig (1/1), aber in Xenopus ist 5/1 und 10/1 in Huhn.
Die Kondensine I und II sind an verschiedenen Stadien der Chromosomenkondensation beteiligt. Condensin I wirkt hauptsächlich während der Prophase auf Chromosomen und belässt sie in der Telophase. In der Interphase wird Kondensin I während G1 im Zytoplasma gefunden, kann aber später verschwinden. Condensin II ist in der Interphase mit Chromatin assoziiert und konzentriert sich während der Prophase in Chromosomen. Seine Funktion ist noch nicht klar, obwohl es die Chromatinorganisation beeinflusst hätte. Condensin II ist am frühen Stadium der Chromosomenverdichtung beteiligt, während Condensin I, unterstützt durch Condensin II, den Chromosomen in einem fortgeschritteneren Schritt des Kondensierungsprozesses Form und Stabilität verleihen würde.
Die differentielle räumliche und zeitliche Verteilung beider Condensine beeinflusst ihren Zugang zu Chromatin. Somit wird die anfängliche Kondensation von Chromatin während der Prophase durch Kondensin II erzeugt, nachdem es durch mehrere Kinasen phosphoryliert wurde. Am Ende der Prophase ist die Kernhülle desorganisiert und Condensin I, das sich im Zytoplasma befindet, kann auf das Chromatin zugreifen. Dann können beide Condensine bei der Kondensation von Chromatin zusammenarbeiten, um die in Chromosomen gefundenen Verdichtungsniveaus zu erreichen (Abbildung 5).
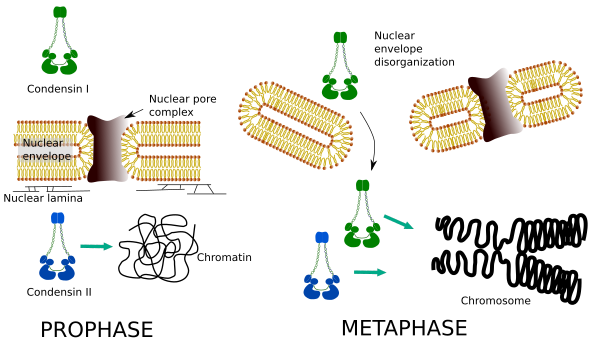
Abbildung 5. Rollen von Condensin I und II in verschiedenen Stadien der Mitose. (Bilder vorbereitet von Ángela L. Debenedetti y Daniel García, Biologiestudenten. Angepasst von Ono et al., 2004).
Statine binden nicht zufällig an das Chromosom. Sie haben mehr Affinität zu Zentromeren, Telomeren, Genen und DNA-Regionen, um die Transkription zu beginnen und zu beenden. Es scheint also, dass ihre Funktion nicht nur strukturell ist. Darüber hinaus bindet Condensin I während der Mitose spezifisch H2A- und H4-Histone.
Obwohl Chromosomen von Wirbeltieren fast spontan kondensieren können, führt das Fehlen von Kondensinen dazu, dass die organisierte Struktur während der Anaphase verloren geht. Darüber hinaus scheint nach dem Ende der M-CdK-Aktivität während der Anaphase Kondensation erforderlich zu sein Stellen Sie sicher, dass die Chromosomen korrekt zu den Spindelpolen wandern. Die Rolle von Condesinen bei der Meiose muss noch sorgfältig untersucht werden, und es gibt bisher nicht viele Daten darüber.
Die Funktionen von Condensin II werden nach der Untersuchung von mutierten Zellen ohne Condesine aufgedeckt. Diese Zellen zeigen längere und biegsamere Chromosomen, die durch eine schlechte axiale Kondensation verursacht werden. Chromatiden sehen selbst in der Anaphase verstrickter aus und die Prophase ist kürzer. Wenn Kondensin I fehlt, kommt es zu einer schwachen lateralen Kondensation der Chromosomen, die Zytokinese versagt und die Zellen werden zu Polyploiden.
Condensine sind auch an der regionalen Chromatinkondensation während der Interphase beteiligt. Es kann moduliert werden, wie einfach es für den Transkriptionssatz von Molekülen ist, Zugang zu einem bestimmten Gen zu erhalten, indem das Verdichtungsniveau des Chromatins geändert wird. Kompakter bedeutet mehr Schwierigkeit. Es sieht so aus, als ob dieser Regulationsmechanismus der Chromatinverdichtung nicht auf denselben Molekülen beruht, die während der Chromosomenverdichtung wirken, obwohl Statine an beiden beteiligt sind. Condensine und Cohesine können mehrere Funktionen unabhängig voneinander ausführen, aber beide Proteinfamilien arbeiten während der Mitose zusammen (Abbildung 6).
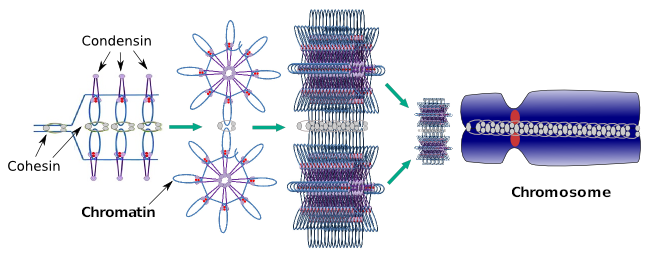
Abbildung 6. Kondensine und Kohäsine arbeiten während der Chromosomenbildung zusammen. (Bilder vorbereitet von Ángela L. Debenedetti y Daniel García, Biologiestudenten. Adaptiert von Maeshima und Eltsov, 2008).
Bibliographie
Barbero JL. 2009. Cohesine: Chromatin beteiligt sich an der Chromosomensegregation, Kontrolle der Genexpression und vieles mehr. Zelluläre und molekulare Lebenswissenschaften. 66:2025-2035.
Hirano T. 2005. SMC-Proteine und Chromosomenmechanik: von Bakterien zum Menschen. Phylosophische Transaktionen der Royal Society B. 360:507-514
Hudson DF, Marshall KM, Earnshaw WC. 2009. Condensin: Architekt der mitotischen Chromosomen. Chromosomenforschung. 17:131-144
Kalitsis P, Zhang T, Marshall KM, Nielsen GF, Hudson DF. 2017. Condensin, Hauptorganisator des Genoms. Chromosomenforschung. 25:61-76
Maeshima K, Eltsov M. 2008. Verpackung des Genoms: die Struktur der mitotischen Chromosomen. Zeitschrift für Biochemie. 143:145-53.
Nashmyth K, Haering CH. 2005. Die Struktur und Funktion von SMC- und Kleisin-Komplexen. Annual Review of Biochemistry. 74:595-648
Ono T, Fang Y, Spector DL, Hirano T. 2004. Räumliche und zeitliche Regulation der Statine I und II bei der mitotischen Chromosomenassemblierung in menschlichen Zellen. Molekularbiologie der Zelle. 15:3296-3308
Peters, JOH. 2008. Der Cohesin-Komplex und seine Rolle in der Chromosomenbiologie. Gene und sevelopment. 22: 3089-3114
Uhlmann F, Lottspelch F, Nasmyth K. 1999. Die Schwesterchromatidtrennung zu Beginn der Anaphase wird durch Spaltung der Cohesin-Untereinheit Scc1 gefördert. Natur. 400, 6739:37-42