Centrosema virginianum
| Centrosema virginianum | |
|---|---|
 |
|
| Foto von Gil Nelson | |
| Wissenschaftliche Klassifikation | |
| Königreich: | Plantae |
| Abteilung: | Magnoliophyta – Blütenpflanzen |
| Klasse: | Magnoliopsida – Dikotyle |
| Artikel-Nr.: | Fabales |
| Familie: | Fabaceae ⁄ Leguminosen |
| Gattung: | Centrosema |
| Art: | C. virginianum |
| Binomialname | |
| Centrosema virginianum (L.) Benth. |
|
 |
|
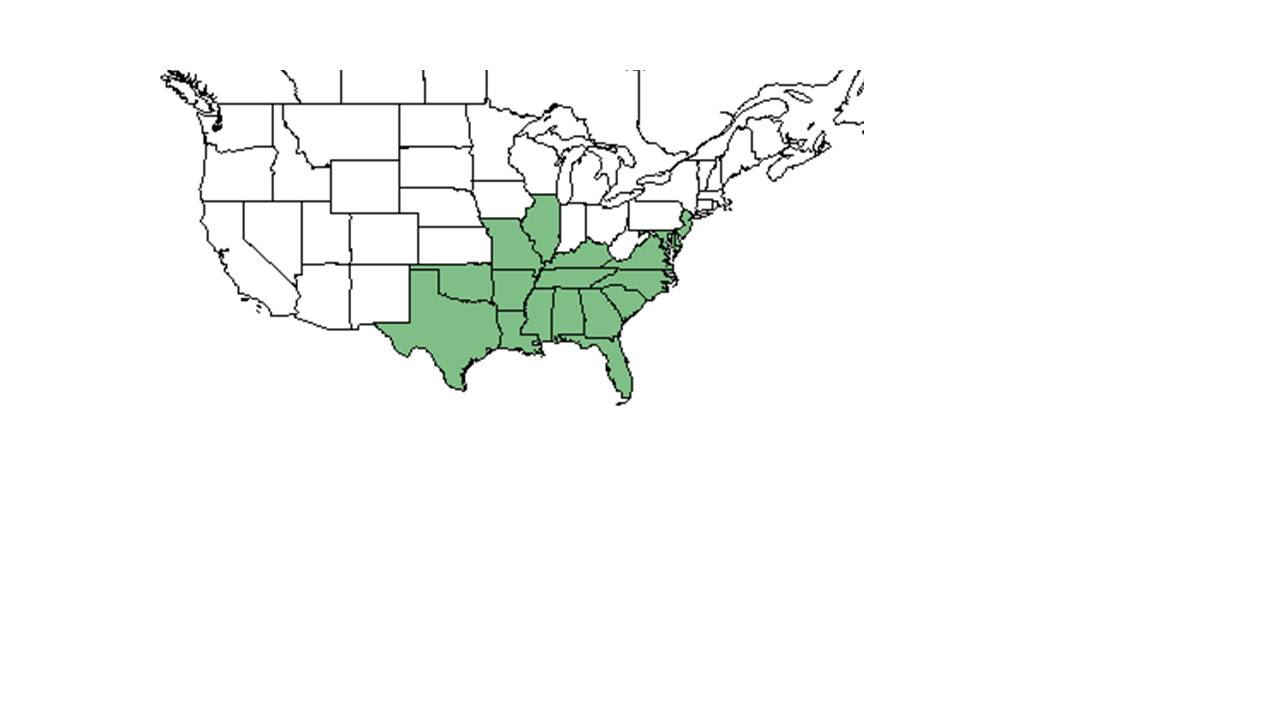
| Natürliches Sortiment von Centrosema virginianum aus der USDA NRCS-Pflanzendatenbank. | |
Gemeinsamer Name: Spornschmetterling Erbse
Taxonomische Hinweise
Synonyme: Bradburya virginiana (Linnaeus) Kuntze.
Sorten: kein.
Beschreibung
Centrosema virginianum ist eine mehrjährige krautige Rebe. Es wächst als sich windende Rebe und klettert auf andere Vegetation. Das Verhältnis von Länge zu Breite der Broschüre ist sehr variabel.
Centrosema virginianum wächst in einer Tailing-, Kletter- und Twining-Mode. Die Pflanze ist eine mehrjährige krautige Rebe, die 0,5-1,5 m lang wird und durchgehend mehr oder weniger kurz weichhaarig ist. Die Blätter sind 3-foliolate; die Blättchen sind breit bis schmal eiförmig, eiförmig-lanzettlich oder länglich bis elliptisch, sind auffällig netzförmig, meist 2-7 cm lang und stipellat. Die Nebenblätter sind eiförmig-lanzettlich bis lanzettlich, gestreift, persistent, 1,5-4 mm lang. Die Trauben sind mit Stielen, die normalerweise 1-5 cm lang werden, die Zick-Zack-Rachis trägt 1-4 Knoten mit jeweils einem eiförmigen Deckblatt, das bis zu 1,5-3 cm lang wird, und einem Stiel (2-10 cm lang), der von 2 eiförmigen Deckblättern überragt wird, die 0,8-1,2 cm lang werden. Der Kelch ist etwas von den Braclets verdeckt, die Röhre ist breit halbkugelförmig, wächst 4-5 mm lang, die Lappen sind linear-subuliert, wachsen 0,6-1,4 cm lang, die unterste am längsten. Die Blütenblätter sind hellblau-violett bis lavendel in der Farbe, wächst 2,5-3,5 cm lang, ist in der Nähe der Basis angespornt, die Perücken und Kiel sind fast gleich groß, ca. 2 cm lang. Die Staubblätter sind diadelphous, 9 und 1. Die Hülsenfrucht ist linear, abgeflacht und wächst 7-14 cm lang und ca. 4 mm breit, ist subsessil, viele mit einem länglichen, hartnäckigen, schnabelartigen Stil ausgesät, Ventile in Längsrichtung verdrehen nach Dehiszenz.
Verbreitung
C. virginianum stammt aus dem Südosten der Vereinigten Staaten, nördlich bis Illinois und New Jersey, entlang der Ostküste und südlich bis Florida und westlich bis Texas und Oklahoma. Es ist auch in Puerto Rico sowie den Jungferninseln beheimatet.
Ökologie
Es ist eine Hülsenfrucht, die eines der höchsten Stickstofffixierungspotentiale aufweist. Aus diesem Grund kann es in der Lage sein, N wiederherzustellen, die durch Feuer verloren gegangen sind. In der Zwischensaison im Juni und Juli wurde eine maximale Stickstofffixierungsrate beobachtet.
Lebensraum
Es kommt in einer Vielzahl natürlicher und gestörter Bedingungen vor, darunter häufig verbrannte Sandhügel, Hochland-langblättriges Drahtgras und Pinienwälder und Flachwälder, Dünen und Küstenlinien von Küsteninseln, offene Gebiete innerhalb von Mangrovensümpfen, bewaldete Auen und Ränder von Laubwäldern und Moore . Es kann in Loblolly Kiefer Gemeinden gefunden werden. Es kann auch in Longleaf Pine-Wiregrass Gemeinden gefunden werden. Auch C. virginianum ist eine charakteristische Art der Shortleaf Pine-oak-Hickory-Gemeinschaft. Es ist tolerant gegenüber überstöckigen Vordächern, die das Lichtniveau auf etwa die Hälfte der Umgebung verringern (dh es kann in teilweise schattigen Bereichen leben und seine Stickstofffixierungsfähigkeit wird nicht signifikant beeinträchtigt). Es wächst in stark gestörten Gebieten, aber es ist auch allgegenwärtig in hochwertigen einheimischen Longleaf Pine Uplands und Sandhills. Es kommt in Böden vor, die von tiefem Sand (Entisol) bis zu sandigem Lehm (Ultisol) reichen. C. virginianum reagiert positiv auf Bodenstörungen in Küstenebenen von South Carolina, einschließlich landwirtschaftlicher Störungen, Kennzeichnung als Indikatorart für postlandwirtschaftliche Wälder. Es reagiert nicht auf Bodenstörungen durch Kahlschlag und Hacken in Nordflorida Flatwoods Wälder.
Zu den assoziierten Arten gehören Brombeerstrauch, Truthahneiche, langblättrige Kiefer, Galactia, Strophostyles, Smilax, Penstemon, Lechea, Chrysopsis, Brumelia, Centrosema, Euphorbia, Cassia, Serenoa repens, Quercus incana, Quercus chapmanii, Diospyros, Aristida, Andropogon, Bahia-Gras, Rubus, Kleeblatt, Pinus taeda, Liquidambar styraciflua, und andere.
Phänologie
C. virginianum blüht zwischen April und Oktober, mit Spitzenblütenständen im Juni und Juli und Früchten hauptsächlich im Juni bis September.
Samenverteilung
Es wird angenommen, dass diese Art durch Ameisen und / oder explosive Dehiszenz zerstreut wird.
Samenbank und Keimung
Es verbreitet sich klonal durch Produktion von Rhizomen. Samenschalen sind hart und und Samen und bleiben in der Samenbank für mindestens zwei Jahre lebensfähig. Für eine optimale Keimung benötigt C. virginianum etwa 2 Sekunden Skarifizierungszeit. Es wurde auch gefunden, um größte trockene Hitzekeimung an einem Hitzeindex zwischen 128,76 und 191,83 und Dampfdauer von 10 Sekunden zu haben. Mit einer Studie über die Auswirkungen der Variation der Feinbrennstoffbelastungen auf die Keimung nach dem Verbrennen wurde festgestellt, dass die Keimung bei niedrigem Brennstoff größer ist als bei hohem Brennstoff mit einer niedrigeren Sterblichkeitsrate, obwohl die größte Keimungsrate und die niedrigste Mortalität bei der Kontrolle von No Burn Regiment.
Feuerökologie
Es gedeiht unter Feuer. Hendricks stellte fest, dass die Parzellen des Piedmont National Wildlife Refuge, die seit 1966 unter einem 4-jährigen Brennregime standen, jeweils mehr als 10-mal mehr C enthielten. virginianum Individuen pro ha als die Oconee National Forest Parzellen, die keine brennende Geschichte hatten. Saisonale Verbrennung scheint die Stickstofffixierung nicht negativ zu beeinflussen. C. virginianum zeigte eine erhöhte Blütensynchronität als Reaktion auf Verbrennungen während der Blitzsaison. Es ist das Beste, um Verbrennungen in Bezug auf den jährlichen Gewebeeintrag sowie den Stickstoffbeitrag zu reduzieren. C. virginianum zeigte eine robuste Blütenreaktion auf Verbrennungen im späten Winter / frühen Frühling und unterstützte die zuvor erwähnte Reaktion auf Verbrennungen im März. Es hat einen hochsommerlichen Blütengipfel. Eine Studie fand auch keine Hinweise darauf, dass eine erhöhte Blüte die Stickstofffixierungsfähigkeit beeinflusst.
Bestäubung
Seine Blüte ist hoch spezialisiert auf die Bestäubung durch große Hymenopteren. Es erfordert Bienen für die Bestäubung, um den Pollenabgabemechanismus zu “stolpern”. Bestäuber-Pflanzen-Beziehungen scheinen robust gegenüber Veränderungen der Blütenphänologie zu sein, die sich aus der Variation der Blütezeit ergeben.Bombus pennsylvanicus wurde beim Füttern und Sammeln von Pollen beobachtet.
Verwendung durch Tiere
Weil C. virginianum ist eine Hülsenfrucht, und Hülsenfrüchte sind reich an Eiweiß und Mineralstoffen, eine Reihe von Pflanzenfressern, einschließlich, aber nicht beschränkt auf Gopherus polyphemus, Weißwedelhirsche und Bob-weiße Wachteln, verbrauchen es. Eine Studie ergab, dass es sich um eine signifikant wichtige Pflanze in 1-Jahres- und 2-Jahres-Ständen für die Bobwhite-Wachteldiät handelt. Es beträgt durchschnittlich etwa 10-25% der Nahrung für große Säugetiere und Landvögel.
Krankheiten und Parasiten
C. virginianum kann durch die Wurzelknotennematodenarten Meloidogyne arenaria, M. incognita und M. javanica infiziert werden, ist jedoch mäßig resistent.
Erhaltung und Management
Es wird vom New Jersey Department of Environmental Protection and Energy als gefährdet eingestuft. C. virginianum ist tolerant gegenüber dem Herbizid imazapyr. Auch für das Management profitiert es davon, dass der Overstory-Baldachin ausgedünnt wird.
Kultivierung und Restaurierung
Referenzen und Anmerkungen
- 1.0 1.1 Weakley, A.S. 2015. Flora der südlichen und mittelatlantischen Staaten. Arbeitsentwurf vom 21.Mai 2015. Universität von North Carolina in Chapel Hill, Chapel Hill, North Carolina.
- 2.0 2.1 2.2 Florida State University Robert K.. Godfrey Herbarium Datenbank. URL: http://herbarium.bio.fsu.edu. Letzter Zugriff: Juni 2014. Sammlerinnen und Sammler: Loran C. Anderson, John C. Ogden, Gwynn W. Ramsey, R.K. Godfrey, R. S. Mitchell; R. C. Phillips, K. Craddock Burks, Gary R. Knight, D. W. Mather, C. Jackson, D. B. Ward, Mary Margaret Williams, O. Lakela, Brenda Herring, Jame Amoroso, Gwynn W. Ramsey, Richard Mitchell, Gail A. Steverson, Grady W. Reinert, George R. Cooley, R. J. Eaton , R. Kral, Cecil R Slaughter, Andre F. Clewell, R. Komarek, R. F. Doren, Kevin Oakes, Richard Gaskalla, Lisa Keppner, Clarke Hudson, Wilbur H Duncan, Jean Wooten, H. R. Totten, R. L. Wilbur, C. Ritchie Bell, Delzie Demaree, F. S. Earle, A. B. Seymour, Samuel B. Jones, Jr., H. R. Reed, A. B. Seymour, Michael B. Brooks, Sidney McDaniel, D. C. Bain, D. S. Correll, H. B. Correll, Lloyd H. Shinners, Geo M. Merrill und HJ Hamby. Staaten und Grafschaften: Alabama: Baldwin. Arkansas: Kleiner Felsen. Florida: Bucht, Zitrus, Collier, Duval, Escambia, Franklin, Gadsden, Golf, Hillsborough, Jackson, Jefferson, Leon, Freiheit, Seekuh, Marion, Okaloosa, Polk, St. Johns, St. Lucie, Suwannee, Wakulla und Washington. Georgia: Bartow, Grady, Madison und Thomas. Mississippi: Forrest, Harrison, Jackson, Pearl River und Pike. North Carolina: Alamance, Orange und Wilkes. Texas: Angelina, Bastrop, Freestone, Harris, Morris, Tarrant und Van Zandt.
- Weakley, AS (2015). Flora der südlichen und mittelatlantischen Staaten. Chapel Hill, NC, Universität von North Carolina Herbarium.
- Radford, Albert E., Harry E. Ahles und C. Ritchie Bell. Handbuch der Gefäßflora der Carolinas. 1964, 1968. Die University of North Carolina Press. 635-6. Drucken
- 5.0 5.1 USDA, NRCS. (2016). Die Pflanzendatenbank (http://plants.usda.gov, 4. April 2019). Nationales Pflanzendatenteam, Greensboro, NC 27401-4901 USA.
- 6,0 6,1 6,2 Cathey, S. E., L. R. Boring, et al. (2010). “Bewertung der N2-Fixierungsfähigkeit einheimischer Leguminosen aus dem Longleaf Pine-Wiregrass-Ökosystem.” Umwelt- und experimentelle Botanik 67: 444-450.
- 7.0 7.1 7.2 7.3 Hainds, M. J., R. J. Mitchell, et al. (1999). “Verbreitung einheimischer Leguminosen (Leguminoseeae) in häufig verbrannten langblättrigen Kiefern (Pinaceae)-Drahtgras (Poaceae) Ökosystemen.” Amerikanisches Journal für Botanik 86: 1606-1614.
- 8.0 8.1 8.2 Cushwa, C. T. (1966). Die Reaktion der krautigen Vegetation auf ihre Verbrennung. Asheville, USDA Forstdienst.
- Clewell, A. F. (2013). “Frühere Prävalenz von Shortleaf Pine-Oak-Hickory Woodlands in den Tallahassee Red Hills.” Castanea 78(4): 266-276.
- Brudvig, L.A. und E.I. Damchen. (2011). Landnutzungsgeschichte, historische Konnektivität, und Landmanagement interagieren, um den Reichtum und die Zusammensetzung des Unterwuchses von langblättrigen Kiefernwäldern zu bestimmen. Ökographie 34: 257-266.
- Brudvig, L.A., E. Grman, C.W. Habeck, und J.A. Ledvina. (2013). Starkes Erbe der landwirtschaftlichen Landnutzung auf Böden und Unterwuchspflanzengemeinschaften in langblättrigen Kiefernwäldern. Waldökologie und -management 310: 944-955.
- Moore, W.H., B.F. Swindel und W.S. Terry. (1982). Vegetative Reaktion auf Kahlschlag und Hacken in einem Flachwald in Nordflorida. Zeitschrift für Bereichsmanagement 35 (2): 214-218.
- Nelson, G. PanFlora: Pflanzendaten für die östlichen Vereinigten Staaten mit Schwerpunkt auf den südöstlichen Küstenebenen, Florida und dem Florida Panhandle. www.gilnelson.com/PanFlora / Zugegriffen: 7 DEZEMBER 2016
- Kirkman, L. Katherine. Unveröffentlichte Datenbank der Samenverteilung Modus von Pflanzen in Küstenebene Longleaf Pine-Grasland des Jones Ecological Research Center, Georgia gefunden.
- Hiers, J. K. und R. J. Mitchell (2007). “Der Einfluss von Verbrennung und Lichtverfügbarkeit auf die N-2-Fixierung einheimischer Leguminosen in langblättrigen Kiefernwäldern.” Zeitschrift der Torrey Botanical Society 134: 398-409.
- Coffey, KL und LK Kirkman (2006). “Samenkeimungsstrategien von Arten mit Wiederherstellungspotenzial in einer feuererhaltenen Kiefernsavanne.” Zeitschrift für Naturgebiete 26: 289-299.
- Wiggers, MS, et al. (2017). “Samenhitzetoleranz und Keimung von sechs Hülsenfruchtarten, die in einem feuergefährdeten langblättrigen Kiefernwald heimisch sind.” Pflanzenökologie 218: 151-171.
- Wiggers, MS, et al. (2013). “Feinskalige Variation der Oberflächenbrandumgebung und der Keimung von Hülsenfrüchten im Ökosystem der langblättrigen Kiefer.” Waldökologie und -management 310: 54-63.
- Hendricks, J. J. und L. R. Boring (1999). “N2-Fixierung durch einheimische krautige Hülsenfrüchte in verbrannten Kiefernökosystemen des Südostens der Vereinigten Staaten.” Waldökologie und -management 113: 167-177.
- 20.0 20.1 20.2 20.3 20.4 20.5 Hiers, J. K., R. J. Mitchell, et al. (2003). “Leguminosen, die in langblättrigen Kiefernsavannen heimisch sind, weisen eine Kapazität für hohe N2-Fixierungsraten und vernachlässigbare Auswirkungen aufgrund des Zeitpunkts des Feuers auf.” Neuer Phytologe 157: 327-338
- Spears, Jr. E. E. 1987. Insel- und Festlandbestäubungsökologie von Centrosema virginianum und Opuntia stricta. In: J. Ecol. 75: 351-362.
- Godts J.E. 1990 Die umgedrehte Blumenpalme 10(4):3
- Schreiber, J., et al. (1981). Bobwhite Wachtelfutter in jungen Arkansas Loblolly Pine Plantagen. Arkansas Experiment Station Bulletin 852. Fayetteville, AR, Universität von Arkansas, Abteilung für Landwirtschaft, Landwirtschaftliche Versuchsstation.
- Miller, J.H. und K.V. Miller. 1999. Waldpflanzen des Südostens und ihre Tierwelt verwendet. In: Southern Weed Science Society.
- Quesenberry, K. H., et al. (2008). “Reaktion von einheimischen südöstlichen US-Leguminosen auf Wurzelknotennematoden.” Crop Science 48: 2274-2278.
- (2000). Die Rolle des Feuers in nongame Wildlife Management und Community Restoration: Traditionelle Verwendungen und neue Richtungen, Nashville, TN, USDA Forest Service, Nordöstliche Forschungsstation.
- Brockway, D. G. und C. E. Lewis (2003). “Einfluss von Hirsch, Rinderweide und Holzernte auf die Pflanzenartenvielfalt in einem langblättrigen Kiefernbluestem-Ökosystem.” Waldökologie und -management 175: 49-69.