Chloridionenkanäle und -transporter: von Kuriositäten der Natur und der Quelle menschlicher Krankheiten zu Wirkstoffzielen
Veröffentlicht: 20 August 2013 | |
Zu Beginn ihrer Grundausbildung wird der Student in verschiedene Arten von integralem Membranprotein eingeführt: Rezeptoren, Adhäsionsproteine, Ionenkanäle, Ionenpumpen und Ionentransporter. Im Laufe ihrer Studien stellen sie fest, dass diskrete Genfamilien und Proteinstrukturen für diese verschiedenen Proteinklassen verantwortlich sind, und es gibt nie einen Grund zu der Annahme, dass es bei der Zuordnung eines bestimmten Proteins zu seiner geeigneten Proteinklasse Unklarheiten geben könnte.
Dies erfüllt praktisch jeden Fall vom Klassenzimmer bis zum Forschungslabor, bis wir Chloridkanäle in Betracht ziehen. Wir wissen, dass sie existieren, wichtig sind und in verschiedenen Krankheitsbereichen gute Wirkstoffziele darstellen könnten, aber bis vor kurzem sind sie in der Welt der Therapeutika etwas stigmatisiert und unmodern geblieben. Der Mangel an selektiven Liganden hat überhaupt nicht geholfen. Die einzige Ausnahme war der GABA-A-Rezeptor, der an einen intrinsischen Chloridkanal gekoppelt ist, der sich bei Bindung des inhibitorischen Neurotransmitters GABA öffnet. Benzodiazepine potenzieren diesen Rezeptor seit der Verfügbarkeit von Valium in den 1960er Jahren und wirken beruhigend und krampflösend. Dies führt zu einem wichtigen Konzept: Es gibt mehrere Genfamilien und verschiedene Proteintypen, die als Chloridkanäle beschrieben werden können.
Dies steht im Gegensatz zu dem, was wir unter kationenselektiven Ionenkanälen verstehen, bei denen die Proteinstruktur wenig flexibel ist und eine für Kalium, Natrium oder Calcium selektive Pore bilden kann; Die Vielfalt dieser Ionenkanäle wird durch die Variationen in den von der Pore verschiedenen Proteindomänen hervorgerufen, die das Öffnungs-Schließverhalten beeinflussen. Um fair zu sein, scheint es nicht viele physiologische Gründe zu geben, warum ein Anionenkanal Chloridselektivität aufweisen sollte, da es eine geringe physiologische Rolle beim Membrantransport anderer Halogenide oder kleiner Anionen gibt; Jeder Anionenkanal ist standardmäßig ein Chloridkanal aus physiologischer Sicht. Auf der anderen Seite spielen Kalium-, Natrium- und Calciummembranströme jeweils unterschiedliche fundamentale Rollen, und die selektive Membranpermeabilität für diese Kationen ist entscheidend für die Zellfunktion und in der Tat für das Leben selbst.
GABA-A-Rezeptoren sind Mitglieder der pentameren ligandengesteuerten Ionenkanalfamilien mit cys-Schleife, zu denen verschiedene Arten von exzitatorischen und inhibitorischen Neurotransmitter-gesteuerten Kanälen gehören. Das Cystic Fibrosis Transmembrane Regulator (CFTR) Protein ist ein Nukleotid-regulierter Chloridkanal. Es ist ein Mitglied der vielfältigen ATP-Binding Cassette (ABC) Transporter Familie und ist die einzige, die kein Substrat über eine Membran zu transportieren scheint, sondern als Chloridkanal fungiert. Die CLC-Familie von spannungsgesteuerten Chloridkanälen stammt aus einer anderen unterschiedlichen Genfamilie und hat eine allgemeine Struktur, die unter Membranproteinen einzigartig ist. Diese Familie von Proteinen hat in den letzten 30 Jahren viele Überraschungen mit sich gebracht, und Mitglieder dieser Familie werden hier vorgestellt und auch, wie sie als Wirkstoffziele angesehen werden könnten.
Weitere spannende Entwicklungen aus dem Bereich der Chloridkanäle sind nach der molekularen Identifizierung von Proteinen entstanden, die Calcium-aktivierten Chloridkanälen (ClCa) zugrunde liegen. Funktionell wissen wir seit einiger Zeit über ihre physiologischen Rollen Bescheid, aber die jüngste molekulare Identifizierung der Kanalproteine hat die Entwicklung molekularer und pharmakologischer Werkzeuge ermöglicht, um ihre Aktivität zu untersuchen und zu verändern. Diese Übersicht konzentriert sich auf das pharmakologische Potenzial von CLCA-Kanälen und CLC-Proteinen; Ihre Funktion und subzelluläre Lokalisation sind in Abbildung 1 zusammengefasst.
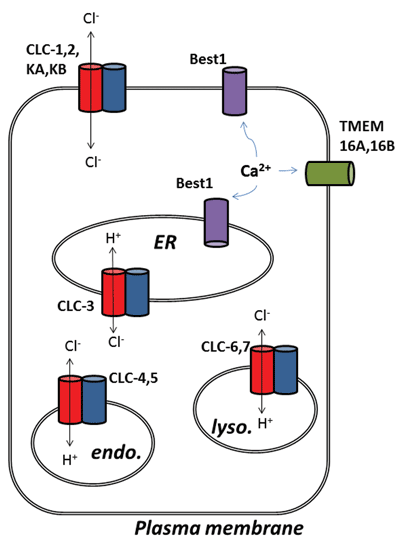
Abbildung 1
Eine Einführung in CLC-Proteine
Die neun Mitglieder dieser Proteinfamilie sind CLC-1 bis 7, CLC-KA und KB. Das Gründungsmitglied, CLC-1, ist der spannungsgesteuerte Chloridkanal des Skelettmuskels und wird im Folgenden diskutiert. Viele funktionelle Studien wurden an einem Homolog mit dem Ehrentitel CLC-0 durchgeführt, das aus dem elektrischen Organ Electroplax isoliert wurde und es dem Strahl ermöglicht, seine aquatischen Opfer zu betäuben. Die Rekonstitution von CLC-0 in Lipiddoppelschichten und die elektrophysiologische Aufzeichnung von Strömen, die durch einzelne Ionenkanäle fließen, zeigten eine faszinierende Eigenschaft. Normalerweise beobachtet man beim Aufzeichnen von Strom von einem kleinen Membranfleck, das einen einzelnen Ionenkanal enthält, Schwankungen zwischen zwei Stromamplituden: eine repräsentiert den geschlossenen Kanal und die andere repräsentiert den Strom, der durch den offenen Kanal fließt. Die Fluktuationen spiegeln Übergänge zwischen offenen und geschlossenen kinetischen Zuständen wider. Mit CLC-0 war es jedoch offensichtlich, dass das einzelne Ionenkanalprotein aus zwei äquivalenten Poren bestand, die sich unabhängig öffnen könnten1. Dieser Kanal wurde daher als doppelläufig beschrieben (Abbildung 2). Es war daher keine große Überraschung, dass die Kristallstrukturen von Homologen aus enterischen Bakterien zeigten, dass der Proteinkomplex ein Dimer war, wobei jede Untereinheit einen ionenleitenden Weg besitzte2 (Abbildung 2).
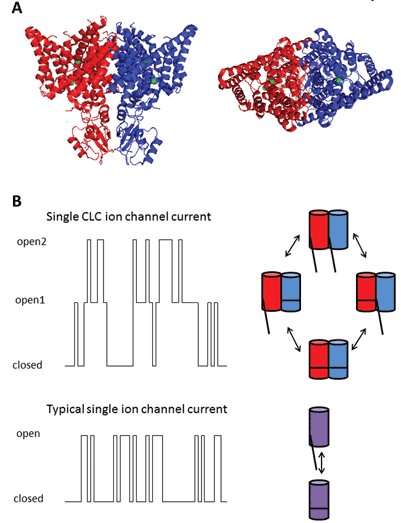
Abbildung 2
Die zweite Überraschung ergab sich, als detaillierte funktionelle Experimente an CLC-ec1 aus E. coli durchgeführt wurden. Anstatt wie sein lange verlorener Verwandter im Skelettmuskel von Wirbeltieren als Chloridkanal zu fungieren, ist CLC-ec1 ein 2Cl- / H + -Austauschtransporter oder Antiporter mit strenger 2: 1-Austauschstöchiometrie 3. Dieses Protein ist wichtig für das Überleben von magensaftresistenten Bakterien bei niedrigem pH-Wert4 und nutzt wahrscheinlich einen Chloridgradienten aus, um den zellulären pH-Wert auf einem tolerierbaren Niveau zu halten. Prokaryotische CLCs könnten daher Ziele für Inhibitoren zur Behandlung pathogener E. coli- oder Salmonelleninfektionen sein4. Die Entdeckung des Ionenaustauschverhaltens stimulierte natürlich weitere Anstrengungen, um festzustellen, ob dieser Chlorid-für-Proton–Austausch in Säugetier-CLCs existierte, unter der Annahme, dass der Cl- / H + -Austausch die wahre Funktion archetypischer CLCs sein könnte und diejenigen, die als Chloridkanäle identifiziert wurden, nur Ausnahmen von der Regel sein könnten. Dies scheint der Fall zu sein, da es starke Hinweise darauf gibt, dass CLC-3 bis CLC-7 als 2Cl– / H + -Austauschtransporter fungieren, die hauptsächlich in intrazellulären Organellen vorkommen, während CLC-1, CLC-2, KA und KB echte Plasmamembran-Chlorid-leitende Ionenkanäle sind5-9. Da die archetypische CLC-Eigenschaft der Austauschtransport ist, der in allen Formen des zellulären Lebens zu finden ist, kann die letztere Unterklasse von Proteinen, die Bona-Fide-Chloridkanäle, daher als ‘gebrochene’ Chloridtransporter angesehen werden, die die Kopplung des Chloridtransports an die Bewegung eines zweiten Substrationens verloren haben.
CLC-1
Dieser Begründer der CLC-Familie ist der spannungsgesteuerte Chloridkanal des Skelettmuskels und dient der Regulierung des Membranpotentials und der Repolarisation der Membran nach Aktionspotentialen zur Entspannung des Muskels. In den meisten Geweben würden wir erwarten, dass Kaliumkanäle diese Rolle spielen, die sie in Herz- und glatten Muskeln spielen, sowie die Membranerregbarkeit in anderen Zelltypen regulieren. Das transversale Tubulussystem ist eine Verlängerung der Plasmamembran (Sarkolemma) und dringt in das kontraktile Gewebe ein. Es ist entscheidend für die schnelle Ausbreitung der elektrischen Aktivität im gesamten Muskel und orchestriert eine schnelle und kontrollierte Kontraktion. Ein Kaliumausfluss aus den Muskelzellen in den engen Raum des t-Tubulus würde die extrazelluläre Kaliumkonzentration erhöhen und diesen Ionengradienten kollabieren lassen, was zu einer verlängerten Membrandepolarisation führen würde. Da Chloridkanäle die vorherrschende repolarisierende Rolle spielen, wird dies verhindert. Funktionsverlust Mutationen in CLC-1 führen bei Menschen, Ziegen und Mäusen zu Myotonie (für eine aktuelle Übersicht siehe 10) und sind durch eine beeinträchtigte Muskelrelaxation gekennzeichnet, die mit dem Verlust eines repolarisierenden Membranstroms übereinstimmt.
Da die Expression auf den Skelettmuskel beschränkt ist, könnte CLC-1 ein attraktives Ziel für Medikamente sein, die die Muskelkontraktion durch Erhöhung oder Verringerung der CLC-1-Funktion kontrollieren und dadurch die Muskelerregbarkeit verringern bzw. erhöhen. Verbindungen, die die CLC-1-Funktion erhöhen, könnten in der Lage sein, Myotonie zu behandeln, insbesondere in Fällen, in denen sie einen teilweisen Verlust der Chloridkanalaktivität kompensieren könnten. Die Hemmung von CLC-1 könnte die Schwelle für die Muskelkontraktion verringern und kann bei Muskelschwäche oder degenerativen Erkrankungen wie Muskeldystrophie nützlich sein.
CLC-2
Der nach innen rektifizierende Chloridkanal CLC-2 hat eine etwas weit verbreitete Gewebeverteilung. Es kann in zentralen Neuronen gefunden werden, wo es die neuronale Aktivität reguliert11-13. In Astrozyten wird das subzelluläre Targeting auf Zellübergänge durch eine Wechselwirkung mit Gliazellen (MLC1) reguliert, Mutationen, bei denen dieses Targeting gestört wird und eine megalenzephale Leukoenzephalopathie verursacht14. Neuere therapeutische Interessen beinhalten CLC-2-Expression in Darmschleimhaut und Lungenbronchiolen, wo es eine Rolle in Darm- und Lungensekreten spielt. Lubiprostone, ein Medikament, das klinisch zur Linderung von Verstopfung eingesetzt wird, wurde vorgeschlagen, seine Wirkung durch Aktivierung von CLC-2 auszuüben, aber dieser Effekt ist umstritten. Während diese Verbindung in einigen Studien CLC-2-Kanäle aktiviert, reguliert sie in anderen Studien den CLC-2-Handel und erhöht die CFTR-Funktion über die Prostaglandinrezeptoraktivierung15,16. Es gibt jedoch nach wie vor ausreichende Hinweise darauf, dass eine Erhöhung der CLC-2-Funktion der Atemwege einen alternativen Chloridweg bei Mukoviszidose bieten könnte17.
CLC-KA/KB
Diese Chloridkanäle werden insbesondere in Nierenepithelien exprimiert und tragen zur Permeabilität der Zellmembranen für den passiven Chloridfluss bei. Sie spielen eine Schlüsselrolle in den aufsteigenden Extremitäten und distalen Tubuli des Nephrons und bieten einen basolateralen Weg für die Chlorid-Reabsorption nach dem Transport vom Primärurin über die apikale Membran. Das CLCKB-Gen, das für CLC-KB kodiert, ist eines von fünf Genen, die dem Bartter-Syndrom zugrunde liegen. Funktionsverlustmutationen in CLC-KB führen zu einer defekten Chlorid-Reabsorption und damit zu einer Salzverschwendungsstörung, die mit Polyurie assoziiert ist. Eines der Hauptmerkmale von Personen, die von CLC-KB-Mutationen (Bartter-Typ III) betroffen sind, ist niedriger Blutdruck. Eine schwerere Form der Krankheit wird durch Mutationen im BSND-Gen (Bartter-Typ IV) verursacht, das für Barttin kodiert, ein akzessorisches Protein, das für den Transport von CLC-KA und KB zur Plasmamembran wichtig ist18. Diese Form der Störung umfasst auch sensorische Taubheit, von der angenommen wird, dass sie durch den Verlust des Transports von CLC-KA und KB an Epithelmembranen im Innenohr verursacht wird. Vermutlich kann der Verlust der CLC-KA- oder KB-Aktivität, aber nicht beider, vom auditorischen System toleriert werden. Dies deutet darauf hin, dass Inhibitoren, die entweder für CLC-KA oder CLC-KB selektiv sind, oder eine teilweise Hemmung beider, als neuartiges Schleifendiuretikum mit dem Potenzial zur Senkung des Blutdrucks und mit wenigen Nebenwirkungen wirken können. Dies hat zur Untersuchung ihrer Pharmakologie und zur Entwicklung neuer Inhibitorderivate mit geringer mikromolarer Affinität geführt19, die bei Verabreichung an Ratten20 harntreibende Wirkungen hatten. Auf der anderen Seite können Medikamente, die CLC-KB-Kanäle aktivieren, die Restaktivität defekter Kanäle bei Bartter-Typ-III-Patienten verstärken.
CLC-7
Von der 2Cl– / H + -Austauschtransporter-Unterklasse ist CLC-7 ein vielversprechendes Ziel für die Arzneimittelwirkung und seine Hemmung kann bei Osteoporose von Vorteil sein. Diese Indikation geht wiederum auf Beobachtungen menschlicher Erkrankungen zurück, die durch Funktionsverlustmutationen in CLC-7 verursacht wurden, die Osteropetrosen verursachen21. Bei dieser Störung ist der Knochenumbau durch Osteoklasten mangelhaft, was vermutlich durch eine defekte Säure- und Enzymsekretion verursacht wird. Dies führt zu dichtem Knochen, der, wenn er durch einen CLC-7-Inhibitor reproduziert wird, die Auflösung von Knochen reduzieren und somit das Skelett von Osteoporose-Patienten stärken22,23. In Proof-of-Concept-Studien verringerte die pharmakologische Hemmung der Versauerung24 oder die Störung der CLC-7-Funktion durch Antikörpere25 die Knochenresorption. Die CLC-7-Hemmung ist jedoch möglicherweise nicht ohne Komplikationen, da Studien an Menschen und Mäusen darauf hindeuten, dass ein Mangel an CLC-7-Funktion aufgrund einer verringerten lysosomalen Funktion auch mit neuronalen Speicher- und Degenerationsstörungen in Verbindung gebracht werden kann26.
Loss-of-function human mutations – lessons from CFTR
Es lohnt sich eine kurze Pause an dieser Stelle zu berücksichtigen, dass einige der therapeutischen Indikationen für neuartige CLC-gezielte Medikamente darauf abzielen, Störungen zu behandeln, die sich von denen unterscheiden, die durch eine defekte CLC-Funktion verursacht werden. Zusätzlich zu den oben beschriebenen ist die Dent-I-Krankheit eine X-chromosomale Nierenerkrankung, die durch den Verlust der CLC-5-Funktion verursacht wird (siehe 27 für eine aktuelle Übersicht). Alle sind seltene erbliche Störungen und ein Hauptproteindefekt mit.einbezieht entweder verringerte Proteintätigkeit oder Handel zur Zielmembran. In der Tat verursachen viele einzelne Mutationen ER-Retention und einen Mangel an Proteinreifung. Eine Parallele könnte mit Mukoviszidose gemacht werden, wobei die meisten betroffenen Personen die ER-beibehaltene ΔF508-Mutation besitzen. Neuere und geschichtete Ansätze zur Behandlung von Mukoviszidose waren das Ergebnis eines zweigleisigen Angriffs zur Korrektur der mutierten Proteinfaltung (CF-Korrektoren) und / oder zur Erhöhung der Aktivität von CFTR-Chloridkanälen der Plasmamembran (CF-Potentiatoren). Erfolge zeichnen sich mit der Potentiatorklasse ab28, die bei Patienten mit Mutationen wirksam sind, die die CFTR-Aktivität ohne Verlust der Proteinbiosynthese oder des Proteintransports reduzieren (z. B. G551D), jedoch Die Wirksamkeit von Faltkorrektoren (die in den meisten Fällen erforderlich ist) muss noch festgestellt werden29. Obwohl die mit dem Verlust der CLC-Funktion verbundenen Krankheiten alle seltene genetische Störungen sind, können wir eines Tages Personen mit Myotonie, Bartter-Syndrom, Dent-Krankheit und Osteopetrose sowie Mukoviszidose mit Medikamenten behandeln, die die tatsächliche Ursache ihrer Störung korrigieren.
Calcium-aktivierte Chloridkanäle
Schließlich werden Calcium-aktivierte Chloridkanäle (ClCa) erwähnt, die in einer Reihe von Zelltypen eine klar definierte physiologische Rolle spielen, deren molekulare Identifizierung jedoch einige falsche und stotternde Starts erlitt. Die Geschichte umfasst vier Arten von Proteinen: Mitglieder der CLCA-, Bestrophin-, Tweety- und TMEM16-Genfamilien. In allen Fällen führte ihre rekombinante Überexpression zur Erzeugung von Membran-Chloridströmen, die durch Erhöhung der intrazellulären Calciumkonzentration und in unterschiedlichem Ausmaß durch Membrandepolarisation stimuliert werden. Die Reise für CLCA endete, als festgestellt wurde, dass dies ein Protein war, das sezerniert wurde, aber wahrscheinlich auch die Membranexpression von ClCa-Kanälen hochregulierte, die dem Expressionssystem endogen waren30. Tweety- und Bestrophin-Proteine weisen nicht alle Eigenschaften von ClCa-Kanälen auf, die in Hauptgeweben untersucht wurden, obwohl Best1 für eine Komponente von ClCa in sensorischen Neuronen verantwortlich zu sein scheint31 und kann auch ein wichtiger Regulator der Calciumfreisetzung aus dem endoplasmatischen Retikulum sein32,33. Drei unabhängige Studien schlugen TMEM16A (auch Ano1 genannt) als Kandidaten für eine Hauptkomponente, wenn nicht sogar in ihrer Gesamtheit, für einen Calcium-aktivierten Chloridkanal34-36 vor. Viele nachfolgende Studien, die durch die Erzeugung molekularer Werkzeuge erleichtert wurden, haben dies unterstützt. TMEM16A ist wichtig für die Regulierung der Membranerregbarkeit in der glatten Gefäßmuskulatur, wird in einem Tiermodell der pulmonalen Hypertonie hochreguliert und kann durch Kanalhemmung reduziert werden37,38. In sensorischen Neuronen koppelt TMEM16A das Vorhandensein von Entzündungsmediatoren an die Membranübererregbarkeit, und die TMEM16A-Hemmung hat antinozizeptive Wirkungen39. In Tiermodellen von Asthma ist die Expression dieses speziellen Chloridkanals erhöht, und seine Hemmung kann vorteilhafte Wirkungen haben40. Es kommt auch in interstitiellen Zellen des Cajal des Darms vor und seine Funktion ist für die rhythmische Kontraktion der glatten Muskulatur in der Darmwand erforderlich41. Darüber hinaus kann die TMEM16A-Aktivierung einen alternativen Weg für die epitheliale Chloridsekretion bei Mukoviszidose bieten42. Während es noch einige Debatten über die genaue Funktion des Restes der TMEM16-Familie gibt, wurde die ClCa-Funktion auch TMEM16B (Ano2) zugeschrieben, von dem angenommen wird, dass es dem ClCa-Kanal in olfaktorischen Haarzellen zugrunde liegt43,44. Diese Klasse von Ionenkanälen kann auch in der Krebszellbiologie eine Rolle spielen, und ihre Hemmung kann die Zellproliferation verhindern45-48.
Abschließende Bemerkungen
Diese Übersicht hat die vielfältigen Rollen von chloridleitenden oder -transportierenden Proteinen hervorgehoben und wie ihre Funktionsstörung mit menschlichen Störungen oder krankheitsähnlichen Symptomen in Tiermodellen verbunden ist. Es besteht ein schwerwiegender Mangel an pharmakologischen Reagenzien, die den Membrantransport von Chloridkanälen und -transportern hemmen, aktivieren oder verbessern. Fortschritte werden mit Medikamenten gemacht, die die defekte Funktion der CFTR bei Mukoviszidose umkehren, was hoffentlich zu Medikamenten führen wird, die spezifisch für die verschiedenen Arten der vererbten Mutation sind. Inhibitoren und Aktivatoren von TMEM16A Calcium-aktivierten Chloridkanälen 42,49 erweisen sich als nützliche Laborwerkzeuge, und neue Verbindungen könnten wirksame Medikamente herstellen, insbesondere wenn sie gewebespezifische Wirkungen erzielen können. Moleküle, die für bestimmte CLCs spezifisch sind, sind wahrscheinlich am schwersten zu fassen. Das Verständnis der strukturellen Grundlagen der spannungsgesteuerten CLC-Aktivierung50 könnte Proteindomänen identifizieren, die durch rationales strukturbasiertes Wirkstoffdesign ins Visier genommen werden können. Solche Werkzeuge werden es uns ermöglichen, einige der neuartigen therapeutischen Ideen, die hier überprüft und vorgestellt wurden, auf den Prüfstand zu stellen.
Biografie des Autors

Dr. Jon Lippiat promovierte über Struktur, Funktion und Pharmakologie von Kaliumkanälen an der University of Leicester. Er studierte pankreatische Betazellfunktion und Diabetes an der Universität Oxford, bevor er als Dozent für Pharmakologie an die Universität Leeds berufen wurde. Seine Forschung umfasst die Aufklärung der strukturellen und physiologischen Eigenschaften verschiedener Arten von Ionenkanälen und -transportern sowie deren potenzielles Targeting durch neuartige pharmakologische Reagenzien.
Ausgabe
Ausgabe 4 2013
Verwandte Themen
Chloridkanäle, Drug Targets, Ionenkanäle