Citrat-Antikoagulation während der CRRT bei akuter Nierenschädigung
- Akute Nierenschädigung
- Management von AKI – Nierenersatztherapien für AKI
- Hämodialyse, Hämofiltration und Hämodiafiltration
- Beginn und Zeitpunkt der RRT für AKI – intermittierende versus kontinuierliche RRT
- Antikoagulation während der kontinuierlichen Nierenersatztherapie (CRRT)
- Citrat – der Mechanismus seiner gerinnungshemmenden Wirkung und seine Anwendung in CRRT
- Mögliche Stoffwechselstörungen während der Citrat-antikoagulierten CRRT
- Biochemische Überwachung von Patienten, die eine Citrat-antikoagulierte CRRT erhalten
Akute Nierenschädigung
Akute Nierenschädigung (AKI), ein klinisches Syndrom mit vielen möglichen Ursachen, ist einfach definiert als eine abrupte Abnahme der Nierenfunktion über einen Zeitraum von Stunden oder Tagen, die durch eine kürzlich erfolgte Erhöhung der Serumkreatininkonzentration und / oder eine Verringerung der Urinausscheidung belegt wird .
Es unterscheidet sich von der chronischen Nierenerkrankung (CKD), bei der die Abnahme der Nierenfunktion langsam, aber irreversibel fortschreitet und über einen Zeitraum von Monaten und Jahren auftritt. AKI kann natürlich bei Patienten mit zugrunde liegender CKD auftreten, und eine Diagnose von AKI ist mit einem größeren als normalen Risiko für eine eventuelle Diagnose von CKD verbunden .
International vereinbarte Richtlinien besagen, dass eine Diagnose von AKI gestellt werden kann, wenn:
• Das Serumkreatinin innerhalb von 48 Stunden um ≥ 0,3 mg / dl (26,5 µmol / l) ansteigt; oder
• Das Serumkreatinin innerhalb der letzten 7 Tage um 50% oder mehr angestiegen ist; oder
• Das Urinvolumen ist
AKI umfasst das gesamte Schweregradspektrum von einer leichten Abnahme der Nierenfunktion (Stadium 1 AKI) bis Nierenversagen (Stadium 3 AKI). Das Staging hängt von der Serumkreatininmessung mit oder ohne Urinausstoßdaten ab (Tabelle I)
|
Bühne |
Serumkreatinin |
Urinausscheidung |
|
1 |
1.5-1.9 zeiten Baseline |
für 6-12 Stunden |
|
2 |
2.0-2.9 mal baseline |
⩾ 12 stunden |
|
3 |
3.0 ausgangswert |
für ⩾ 24 Stunden |
TABELLE I: Die drei Stadien des AKI-Schweregrads (von ref 1)
Die Ursachen von AKI werden üblicherweise unter drei Überschriften klassifiziert: prärenal; renal (intrinsisch); und postrenal, wobei betont wird, dass AKI eine spezifische Nierenätiologie haben kann, aber auch aus primären Problemen außerhalb der Niere resultieren kann.
Jeder Zustand, der den Blutfluss zur Niere verringert (Nierenperfusion), ist eine mögliche Ursache für prärenale AKI; Diese Zustände umfassen: Hypovolämie aufgrund von Erbrechen, Durchfall, Blutungen, Verbrennungen oder septischem Schock; und reduziertes Herzzeitvolumen aufgrund von beispielsweise Herzinsuffizienz und Leberversagen (Zirrhose). Die Hauptursache für intrinsische AKI ist die renale tubuläre Nekrose, die aus einer Nierenischämie oder der Einnahme von nephrotoxischen Arzneimitteln / Toxinen resultiert.
Sepsis, die häufigste Ursache für AKI bei kritisch Kranken, ist zum Teil auf eine schlecht definierte intrinsische Nierenschädigung zurückzuführen, die der renalen tubulären Nekrose ähnelt . Schließlich resultiert die postrenale AKI aus jedem Zustand, der den Urinfluss distal zur Niere behindert. Dazu gehören: Nierensteine (Steine); Prostataerkrankung (Tumor / Hypertrophie); Blasenfunktionsstörung; und Harnröhrenstriktur.
Management von AKI – Nierenersatztherapien für AKI
Es gibt keine spezifische Behandlung für AKI und das Management unterstützt weitgehend die Behandlung, die auf die zugrunde liegende Ursache abzielt. Entzug von nephrotoxischen Medikamenten, Flüssigkeitsreanimation und Korrektur von Elektrolyt- und Säure-Basen-Störungen sind alle Teil dieses allgemeinen unterstützenden Managements . Die Verabreichung von Vasopressor- oder Inotropika zur Wiederherstellung des normalen Blutdrucks und des Herzzeitvolumens kann erforderlich sein.
Die Nierenersatztherapie (RRT), der Schwerpunkt dieses Artikels, stellt die letzte Behandlungsmöglichkeit für Patienten mit schwerer AKI dar, die nicht auf eine konservative unterstützende Behandlung anspricht. Rund 23 % der Intensivpatienten mit AKI (d. H. rund 13 % aller Intensivpatienten) erhalten eine RRT .
Nierenersatztherapie (RRT) ist der Oberbegriff für alle Behandlungen, die die Nierenfunktion ersetzen sollen. Die Transplantation von Spendernieren an Patienten mit Nierenerkrankungen im Endstadium kann als ultimative RRT angesehen werden , Der Begriff ist jedoch häufiger für Therapien reserviert, die die Blutfilterung und die homöostatischen Funktionen der Niere durch Dialyse ersetzen, Ein Verfahren, bei dem eine semipermeable Membran als Blutfilter verwendet wird. Zwei breite Arten von dialytischen RRT sind für die Behandlung von AKI (und für diese Angelegenheit, Endstadium CKD): Peritonealdialyse und Hämodialyse.
Im Gegensatz dazu wird bei der Hämodialyse Blut in einer Maschine außerhalb des Körpers gefiltert (extrakorporal). Blut wird zum Filter / Dialysator gepumpt, wo Abfallprodukte und überschüssige Flüssigkeit entfernt und dann in den Körper zurückgeführt werden. Dieser extrakorporale Kreislauf (das Dialysegerät und seine Verbindungsschläuche vom und zurück zum Patienten) ist eine gerinnungsfördernde Umgebung.
Hämodialyse, Hämofiltration und Hämodiafiltration
Moderne Dialysegeräte verfügen über die Option Hämofiltration (HF) sowie Hämodialyse (HD), wodurch drei verschiedene Dialysemodalitäten für die Behandlung von AKI möglich sind: Hämodialyse (HD); Hämofiltration (HF); und Hämodiafiltration (HDF).
Im Zentrum aller drei Modalitäten steht die semipermeable Membran, die einen Blutfilter darstellt. Wenn das vom Patienten gepumpte Blut auf einer Seite dieser Membran fließt, passieren überschüssiges Wasser und überschüssige gelöste Stoffe die Membran. Das Filtrat oder Abwasser wird in den Abfall gepumpt, wenn das gefilterte Blut zum Patienten zurückgeführt wird.
Der Prozess der Hämodialyse (HD) beinhaltet die Verwendung einer Dialysierflüssigkeit, die kontinuierlich und im Gegenstrom zu Blut auf der anderen Seite der Membran fließt. Die Zusammensetzung und Fließgeschwindigkeit der Dialysierflüssigkeit gewährleistet einen konstanten Konzentrationsgradienten über die semipermeable Membran in Bezug auf gelöste Blutbestandteile. Diese Konzentrationsgradienten wiederum ermöglichen eine kontrollierte Diffusion gelöster Moleküle über die Membran.
Für gelöste Stoffe wie Harnstoff und Kreatinin, die aus dem Blut entfernt werden müssen, ist der Konzentrationsgradient so, dass die Diffusionsrichtung von Blut zu Dialysierflüssigkeit ist, während für gelöste Stoffe wie Bicarbonat, das häufig dem Blut zugesetzt werden muss, um die mit schwerer AKI verbundene Azidose zu korrigieren, Dialysierflüssigkeit Mit hoher Bicarbonatkonzentration im Verhältnis zum Blut sorgt dafür, dass die Diffusion in die entgegengesetzte Richtung erfolgt, von Dialysierflüssigkeit zu Blut. Die Anpassung der Dialysierflüssigkeitszusammensetzung und der Flussrate ermöglicht somit eine patientenspezifische metabolische Korrektur.
Flüssigkeitsüberschuss ist häufig ein Merkmal von AKI, das während der Hämodialyse korrigiert wird. Dies wird durch Ultrafiltration erreicht, die von dem hydrostatischen Druckgradienten abhängt, der über die semipermeable Membran herrscht. Der relative positive hydrostatische Druck auf der Blutseite der Membran “drückt” effektiv Wasser aus dem Blut in die Dialysierflüssigkeit.
Diese Ultrafiltration erleichtert auch den Durchgang von gelösten Molekülen, die während der Ultrafiltration durch einen Mechanismus, der als gelöste Konvektion (oder Lösungsmittelwiderstand) bezeichnet wird, mit Wasser mitgeschleppt werden. Die kombinierte Wirkung von gelöster Diffusion, gelöster Konvektion und Ultrafiltration während der Hämodialyse zielt darauf ab, sicherzustellen, dass das Flüssigkeitsvolumen und die Zusammensetzung sowohl innerhalb des extrazellulären als auch des intrazellulären Kompartiments so nahe wie möglich an das bei normal funktionierenden Nieren wiederhergestellt werden.
Hämodiafiltration (HDF) ist die Kombination von HF und HD. Es ermöglicht eine optimale Clearance von niedermolekularen gelösten Stoffen durch Diffusion in die Dialysierflüssigkeit, kombiniert mit einer optimalen Clearance von hochmolekularen gelösten Stoffen durch Konvektion und Ultrafiltration. Wie bei HF erfordert HDF kontinuierliche Ersatzflüssigkeit; und wie bei HD erfordert HDF Dialyseflüssigkeit.
Beginn und Zeitpunkt der RRT für AKI – intermittierende versus kontinuierliche RRT
Alle Nierenersatztherapien (PD, HD, HF und HDF) können intermittierend (d. H. typischerweise in 3-4 stündlichen Sitzungen) oder kontinuierlich durchgeführt werden, bis die Nierenfunktion wiederhergestellt ist. Bei Patienten mit Nierenversagen im Endstadium, die eine lebenslange (chronische) RRT benötigen, besteht die Behandlung ausschließlich aus einer intermittierenden Hämodialyse (IHD), die fast immer dreimal pro Woche in vier stündlichen Sitzungen durchgeführt wird .
Patienten mit AKI haben nur einen vorübergehenden Bedarf an RRT zur Unterstützung der Nierenfunktion während der Auflösung der kritischen / akuten Erkrankung, die AKI auslöste. Die mittlere Dauer der RRT bei Patienten mit AKI beträgt etwa 13 Tage , obwohl sie in bestimmten Fällen nur für einige Tage oder für viele Wochen erforderlich sein kann.
Traditionelle (absolute) Indikatoren für die Einleitung einer RRT bei AKI sind:
• Hyperkaliämie (Plasmakalium > 6,0-6,5 mmol / L)
• schwere Urämie (Plasmaharnstoff > 30 mmol / l)
• Anzeichen einer urämischen Enzephalopathie
• Azidose (pH-Wert) • akutes Lungenödem
Es kann vorteilhaft sein, mit der Behandlung zu beginnen, bevor diese extremen Wirkungen von AKI offensichtlich sind, der optimale Zeitpunkt für das Einleiten (und Stoppen) von RRT ist jedoch derzeit unklar und Gegenstand laufender Forschung . Es gibt derzeit keine zuverlässigen Daten, die einen bestimmten RRT-Typ für AKI unterstützen, und folglich wurden alle Arten von RRT verwendet.
Die aktuellen Leitlinien spiegeln jedoch einen Konsens darüber wider, dass die RRT unabhängig von der Modalität kontinuierlich und nicht intermittierend an die am kritischsten kranken (hämodynamisch instabilen) Patienten verabreicht werden sollte. Jüngste Umfragen zeigen, dass heutzutage kontinuierliche Nierenersatztherapien (CRRT) werden viel häufiger als intermittierende Therapien für AKI verwendet, und dass die am häufigsten verwendete CRRT die kontinuierliche venöse venöse Hämofiltration (CVVHF) ist, gefolgt von einer kontinuierlichen venösen venösen Hämodiafiltration (CVVHDF).
Antikoagulation während der kontinuierlichen Nierenersatztherapie (CRRT)
Die CRRT beinhaltet, wie alle anderen Nierenersatztherapien mit Ausnahme der Peritonealdialyse, das Pumpen von Blut durch einen nichtphysiologischen, extrakorporalen Kreislauf. Die inhärente Eigenschaft von Blut, bei Kontakt mit nichtphysiologischen Oberflächen zu koagulieren (Gerinnsel), bestimmt, dass Blut antikoaguliert werden muss, um einen “gerinnselfreien” extrakorporalen Kreislauf des Patienten aufrechtzuerhalten.
CRRT hat aufgrund der längeren Behandlungssitzungen und der relativ langsamen Geschwindigkeit, mit der Blut durch den Kreislauf gepumpt wird, einen besonderen Bedarf an Antikoagulation im Vergleich zu intermittierenden Modalitäten . Darüber hinaus befindet sich das Blut von Patienten, die eine CRRT benötigen, aufgrund einer zugrunde liegenden kritischen Erkrankung (z. B. Sepsis) oder eines Traumas häufig bereits in einem relativen gerinnungshemmenden Zustand .
Viele Jahre lang war Heparin, entweder unfraktioniertes Heparin (UF) oder niedermolekulares Heparin (LMWH), das einzige Antikoagulans, das in dialytischen Verfahren, einschließlich CRRT, verwendet wurde. Heparin wird weiterhin verwendet; Es ist ein billiges und im Allgemeinen sicheres Mittel zur Antikoagulation für die Mehrheit der Patienten, die RRT benötigen.
Eine systemische Heparin-Antikoagulation, die nicht vermieden werden kann, birgt jedoch zwangsläufig ein erhöhtes Blutungsrisiko, so dass eine Heparin-Antikoagulation bei dialytischen Eingriffen für diejenigen, die derzeit bluten oder ein höheres Blutungsrisiko als normal haben, absolut kontraindiziert ist.
Darüber hinaus kann Heparin in einer kleinen Minderheit (
Die potenziellen Blutungs- und HIT-II-Risiken im Zusammenhang mit der Verwendung von Heparin) die Notwendigkeit eines alternativen Antikoagulans für einige Patienten, die eine RRT benötigen. Citrat bot eine solche Alternative. Die regionale Citrat-Antikoagulation des Dialysekreislaufs, die Anfang der 1980er Jahre erstmals erfolgreich eingesetzt wurde, war ursprünglich der kleinen Minderheit der Patienten vorbehalten, bei denen Heparin kontraindiziert ist. Dies änderte sich mit den Ergebnissen randomisierter kontrollierter Studien, in denen Heparin-antikoagulierte CRRT mit Citrat-antikoagulierter CRRT verglichen wurde; Diese zeigten, dass Citrat sowohl ein wirksameres als auch ein sichereres Antikoagulans als Heparin ist .
Citrat hat sich folglich in den letzten Jahren als Antikoagulans der Wahl für alle AKI-Patienten herausgestellt, die CRRT benötigen . Intensivstationen auf der ganzen Welt berichten jetzt von einem Wechsel von Heparin zu regionaler Citrat-Antikoagulation für CRRT . Einige Behörden empfehlen sogar die Verwendung von Citrat anstelle der Heparin-Antikoagulation bei intermittierender (chronischer) Hämodialyse (IHD).
Citrat – der Mechanismus seiner gerinnungshemmenden Wirkung und seine Anwendung in CRRT
Citrat, das seit weit über einem Jahrhundert zur Antikoagulation / Konservierung von Blutspenden zur Transfusion verwendet wird, verhindert die Blutgerinnung durch seine Fähigkeit, das im Blutplasma zirkulierende ionisierte Kalzium (iCa) zu binden (Chelat). Diese iCa ist ein notwendiger Cofaktor sowohl für die Thrombozytenaggregation als auch für mehrere Schlüsselschritte in den intrinsischen und extrinsischen Gerinnungswegen, die für die Fibrinproduktion und damit für die Fibringerinnselbildung verantwortlich sind.
Die Blutgerinnung wird durch eine Verringerung der Plasma-iCa-Konzentration auf etwa 0,35 mmol / l (normaler Ref-Bereich 1,15-1,30 mmol / l) verhindert. Dieser unphysiologische, stark hypokalzämische Zustand wird durch Erhöhung der Plasmacitratkonzentration auf etwa 3 mmol / l (normale Plasmacitratkonzentration ~ 0,1 mmol / l) erreicht.
Obwohl es Unterschiede im Detail gibt, die von Morabito et al. skizziert wurden, beinhalten alle Protokolle für die Citrat-Antikoagulation während der CRRT die kontinuierliche Infusion von Citrat-haltiger Lösung (normalerweise entweder Trinatriumcitrat oder Säure-Citrat-Dextrose (ACD) -Lösung) in die Vorfilter- / Dialyseleitung, in der Nähe der Stelle, an der sie den Patienten verlässt, entweder als separate Lösung oder in Kombination mit einer Verdünnungsersatzflüssigkeit. Die Flussrate dieser Infusion wird so eingestellt, dass eine Blutcitratkonzentration von ~ 3 mmol / l und damit eine Plasma-iCa von etwa 0, 35 mmol / l erreicht wird.
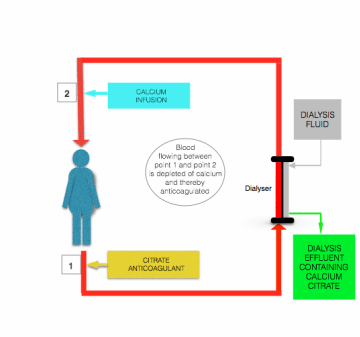
Die durch Citratinfusion induzierte Hypokalzämie wird korrigiert, bevor das Blut zum Patienten zurückkehrt, indem eine calciumhaltige Lösung (Calciumchlorid oder Calciumgluconat) in die Postfilterleitung in der Nähe des Eintrittsortes in den Patienten infundiert wird (siehe Abbildung oben).
Der wesentliche Sicherheitsvorteil der Citrat-Antikoagulation gegenüber der Heparin-Antikoagulation besteht darin, dass die Antikoagulation auf den extrakorporalen Kreislauf beschränkt ist. Diese sogenannte “regionale Antikoagulation” wird erreicht, weil der größte Teil des infundierten Citrats (entweder als Citratanionen oder Calcium-Citrat-Chelat) während des Durchgangs durch den Filter / Dialysator aus dem Blut entfernt wird.
Verbleibendes Citrat im Postfilterblut wird im systemischen Kreislauf verdünnt und durch den sauerstoffabhängigen Krebszyklus in den Mitochondrien von Gewebezellen (vorwiegend Leberzellen) schnell zu Kohlendioxid und Wasser metabolisiert.
Der Metabolismus von Citrat ist mit der Produktion von Bicarbonat verbunden: für jedes metabolisierte 1 mmol Citrat werden 3 mmol Bicarbonat erzeugt. Die schnelle Clearance von Citrat (die Halbwertszeit von Citrat im Blut beträgt normalerweise etwa 5 Minuten) über diesen hauptsächlich hepatischen Weg gewährleistet normalerweise das Fehlen einer systemischen Antikoagulation während der CRRT und damit kein zusätzliches Blutungsrisiko.
Mögliche Stoffwechselstörungen während der Citrat-antikoagulierten CRRT
Die offensichtliche Zurückhaltung, die Citrat-antikoagulierte CRRT bei allen AKI-Patienten bis vor kurzem vollständig anzunehmen, wurde auf die Besorgnis über die Säure-Base- und Elektrolytstörungen zurückgeführt, die bei Patienten auftreten können, die die Behandlung erhalten .
Die folgenden Elektrolyt- und Säure-Basen-Störungen wurden bei Patienten berichtet, die Citrat-antikoagulierte CRRT erhielten :
* Hypokalzämie / Hyperkalzämie
• Hypomagnesie / Hypermagnesie
• Hyponatriämie / Hypernatriämie
• metabolische Alkalose
• metabolische Azidose
Diese Störungen können aus einer Reihe von Gründen auftreten, aber die Ansammlung von Citrat im peripheren Kreislauf (Citrattoxizität) kann für die meisten dieser Störungen von zentraler Bedeutung sein. Gründe, warum sich Citrat während der CRRT ansammeln kann, sind:
* Gestörter Metabolismus von Citrat aufgrund von Lebererkrankungen und / oder verminderte Sauerstoffzufuhr aufgrund unzureichender Perfusion (z. bei septischem / kardiogenem Schock)
• Fortschreitende Verringerung der Membrandurchgängigkeit während der Dialyse mit daraus resultierender verringerter Filtration von Citrat und gleichzeitiger Erhöhung der Citratabgabe in den systemischen Kreislauf
• Betriebsfehler – versehentliche erhöhte Rate der Citratinfusion in den extrakorporalen Kreislauf und gleichzeitige erhöhte Abgabe von Citrat in den systemischen Kreislauf
• Transfusion von Blutprodukten – In Blutprodukten vorhandenes Citratkonservierungsmittel erhöht die Citratbelastung im systemischen Kreislauf, die sich CRRT
Unabhängig von der Ursache, die Akkumulation von Citrat im peripheren Kreislauf kann zu einer Citratchelatbildung von zirkulierendem ionisiertem Calcium führen, was zu einer verringerten Plasmakonzentration von ionisiertem Calcium (Hypokalzämie) führt. Wenn eine ausreichend schwere Hypokalzämie Herzrhythmusstörungen und letztendlich Herzstillstand verursachen kann .
Obwohl plasmaionisiertes Calcium während der Citratakkumulation reduziert wird (Toxizität), ist das Gesamtcalcium erhöht (was auf eine Hyperkalzämie hinweist), da das an Citrat gebundene Calcium im gemessenen Gesamtcalcium enthalten ist. Eine Erhöhung des Verhältnisses von Gesamt- zu ionisiertem Calcium (normalerweise 2,0) auf > 2.1 ist gefunden worden, um das zuverlässigste Signal der Zitratgiftigkeit in Ermangelung der routinemäßig verfügbaren Plasmacitratschätzung zu sein.
Das Risiko einer erhöhten Plasma-Natrium (Hypernatriämie) im Zusammenhang mit Citrat-Antikoagulation ist auf den hohen Natriumgehalt (Hypertonizität) einiger Citratlösungen zurückzuführen, die in CRRT verwendet werden. Zum Beispiel enthält die 4% ige Lösung von Trinatriumcitrat, die in einigen Protokollen verwendet wird, Natrium in einer Konzentration von 420 mmol / L. In der Praxis kann die Verwendung von hypotonischen Dialyse- / Ersatzflüssigkeiten dieses Risiko mindern, und Hypernatriämie ist in jedem Fall eine seltene Komplikation der Citrat-Antikoagulation .
Das Risiko einer Hypomagnesie (reduziertes Serummagnesium) während der Citrat-Antikoagulation spiegelt die Tatsache wider, dass Magnesium wie Calcium ein zweiwertiges Ion ist, das auch an (Chelat-) Citrat binden kann. Wenn Magnesiumverluste aufgrund der Chelatwirkung von Citrat durch Magnesium in Dialyse- / Ersatzflüssigkeiten nicht vollständig kompensiert werden, kann eine Hypomagnesie auftreten .
Biochemische Überwachung von Patienten, die eine Citrat-antikoagulierte CRRT erhalten
Point-of-Care-Tests mit einem Blutgasanalysator auf der Intensivstation ermöglichen eine schnelle und bequeme Messung der meisten Parameter (ionisiertes Calcium, pH-Wert, Bicarbonat, Basenüberschuss, Natrium und Laktat) Serum-Gesamtcalcium- und Magnesiumwerte sind auf diesen Plattformen normalerweise nicht verfügbar und Proben müssen für diese Messungen an das Labor gesendet werden.
Zwei kürzlich durchgeführte Studien belegen, dass einige Blutgasanalysatoren bei der Messung von ionisiertem Kalzium bei extrem niedrigen, unphysiologischen Konzentrationen (~ 0) möglicherweise nicht zuverlässig sind.3 mmol / l), die im Blut nach dem Filter vorhanden sind, obwohl ihre Fähigkeit, plasmaionisiertes Kalzium im systemischen Kreislauf (wo die Konzentration viel höher ist) genau zu messen, nicht zweifelhaft ist.
|
Parameter gemessen |
Überwachung intervall |
Zielwerte oder ca. referenzbereiche |
Zweck der Messung |
Korrekturmaßnahmen, wenn außerhalb des Ziels |
|
ICA-Konzentration (Postfilter ionized Calcium), d. H. Blut, das aus dem Postfilter-Port entnommen wurde. |
Innerhalb von 1 Stunde nach Beginn und nach jeder Änderung der Citratdosis, dann alle 4-6 Stunden |
0.25-0.35 mmol/L |
|
Anpassung der Citratdosis: erhöhen, wenn iCa > 0,35, verringern, wenn iCa |
|
Systemisch ionisiertes Calcium (iCa), d. H. Blut, das dem Patienten entnommen wurde |
Baseline (vor dem Start), dann 1 Stunde nach dem Start, dann mindestens alle 4-6 Stunden |
1.15-1.30 mmol/L |
|
Anpassung der Calciuminfusionsrate; erhöhen, wenn iCa 1.30 |
|
Systemisches Gesamtcalcium (TotCa), d.h. blutprobe vom Patienten (TotCa = iCa + an Albumin gebundenes Calcium + an Citrat gebundenes Calcium) |
Mindestens alle 12-24 Stunden (muss gleichzeitig mit systemisch ionisiertem Kalzium erfolgen)) |
Nur erforderlich für die Bestimmung von totCa:iCa Ratio (siehe unten) |
||
|
Verhältnis von Gesamt- zu ionisiertem Calcium (TotCa:iCa) |
Mindestens alle 12-24 Stunden |
Zum Nachweis der Citratansammlung / -toxizität, die manchmal als “Citratsperre” bezeichnet wird” |
Zu den Optionen gehören:
|
|
|
Arterielle Blutgasanalyse
|
Baseline (vor dem Start) . Innerhalb von 1 Stunde nach dem Start, dann mindestens alle 4-6 Stunden. |
pH 7,35-7,45 Bicarb 23-28 mmol/L SEIN –2-+3 mmol/L |
Zum Nachweis von Säure-Basen-Störungen: metabolische Alkalose metabolische Azidose |
Optionen im Falle einer metabolischen Alkalose sind:
|
|
Serumnatrium |
Einmal täglich |
135-145 mmol/L |
Zur Erkennung von Hypernatriämie / Hyponatriämie |
Seltenes Auftreten – überprüfen Sie die richtige Dialyse- / Ersatzflüssigkeit |
|
Serumlactat |
Baseline (vor Beginn), dann nach klinischen Bedürfnissen |
Um diejenigen zu identifizieren, bei denen das Risiko einer Citrattoxizität besteht |
Berücksichtigen Sie zusammen mit dem TotCa: iCa-Verhältnis das Risiko einer Citrattoxizität |
|
|
Serummagnesiumspiegel |
Mindestens einmal täglich |
Zur Erkennung von Hypomagnesie |
Korrektur mit Magnesiuminfusion |
TABELLE II: Biochemische Überwachung während der Citrat-antikoagulierten CRRT (Ref 24)