Claisen–Umlagerung
Die Claisen-Umlagerung (nicht zu verwechseln mit der Claisen-Kondensation) ist eine leistungsstarke chemische Reaktion zur Bildung von Kohlenstoff-Kohlenstoff-Bindungen, die 1912 von Rainer Ludwig Claisenin entdeckt wurde. Das Erhitzen eines Allylvinylethers initiiert eine -sigmatrope Umlagerung zu einem γ, δ-ungesättigten Carbonyl.
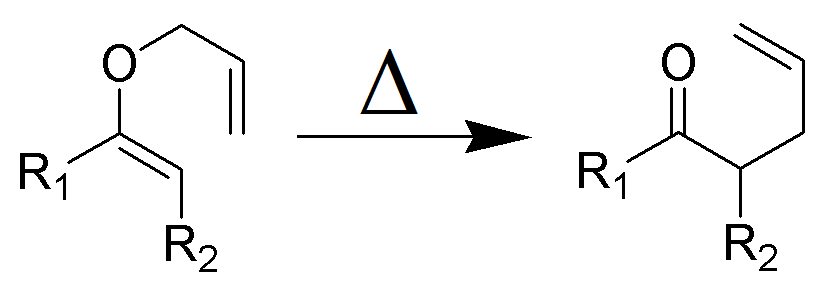
Abbildung 1: Wikimedia (Eigene Arbeit) -sigmatrope Umlagerung.
Die Claisen-Umlagerung ist eine exotherme, konzertierte (Bindungsspaltung und Rekombination) pericyclische Reaktion. Woodward-Hoffmann-Regeln zeigen einen suprafazialen, stereospezifischen Reaktionsweg. Die Kinetik ist von erster Ordnung und die gesamte Transformation verläuft durch einen hochgeordneten zyklischen Übergangszustand und ist intramolekular. Crossover-Experimente eliminieren die Möglichkeit der Umlagerung über einen intermolekularen Reaktionsmechanismus und stimmen mit einem intramolekularen Prozess überein.
Bei der Claisen-Umlagerung werden erhebliche Lösungsmitteleffekte beobachtet, bei denen polare Lösungsmittel dazu neigen, die Reaktion stärker zu beschleunigen. Wasserstoffbindende Lösungsmittel lieferten die höchsten Geschwindigkeitskonstanten. Beispielsweise ergeben Ethanol/Wasser-Lösungsmittelgemische 10-fach höhere Geschwindigkeitskonstanten als Sulfolan. Es wurde gezeigt, dass dreiwertige aluminiumorganische Reagenzien wie Trimethylaluminium diese Reaktion beschleunigen.
Die erste gemeldete Claisen-Umlagerung ist die -sigmatrope Umlagerung eines Allylphenylethers zu Intermediat 1, das schnell zu einem ortho-substituierten Phenol tautomerisiert.
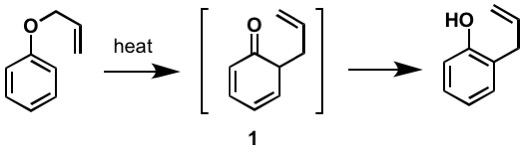
Abbildung 2: Von Kchemyoung (Eigene Arbeit) , über Wikimedia Commons
Irland-Claisen-Umlagerung
Die Irland-Claisen-Umlagerung ist die Reaktion eines Allylcarboxylats mit einer starken Base (wie Lithiumdiisopropylamid) zu einer γ, δ-ungesättigten Carbonsäure. Die Umlagerung erfolgt über Silylketenacetal, das durch Einfangen des Lithiumenolats mit Chlortrimethylsilan gebildet wird. Wie die Bellus-Claisen-Umlagerung (oben) kann auch die Irland-Claisen-Umlagerung bei Raumtemperatur und darüber erfolgen. Die E- und Z-konfigurierten Silylketenacetale führen zu anti- bzw. syn-Umlagerungsprodukten. Es gibt zahlreiche Beispiele für enantioselektive Ireland-Claisen-Umlagerungen, die in der Literatur gefunden wurden, um chirale Borreagenzien und die Verwendung von chiralen Hilfsstoffen einzuschließen.
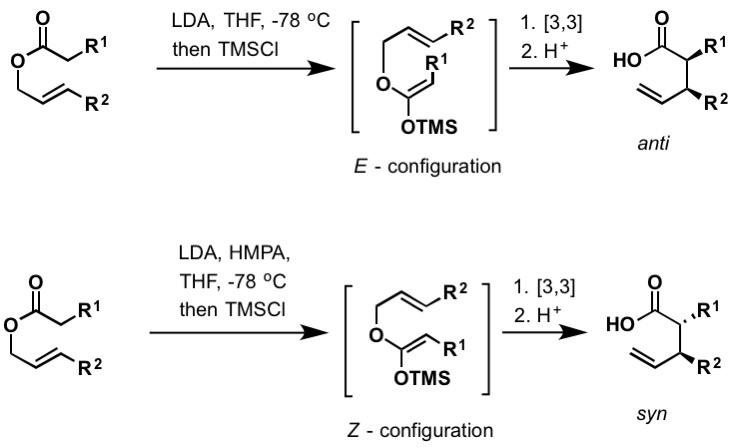
Abbildung 5: Bild mit Genehmigung verwendet (CC BY-SA 4.0; Kchemyoung)
Johnson-Claisen-Umlagerung
Die Johnson-Claisen-Umlagerung ist die Reaktion eines Allylalkohols mit einem Orthoester zu einem γ,δ-ungesättigten Ester. Schwache Säuren, wie Propionsäure, wurden verwendet, um diese Reaktion zu katalysieren. Diese Umlagerung erfordert oft hohe Temperaturen (100 bis 200 ° C) und kann zwischen 10 und 120 Stunden dauern. Mikrowellenunterstütztes Erhitzen in Gegenwart von KSF-Ton oder Propionsäure hat jedoch dramatische Steigerungen der Reaktionsgeschwindigkeit und der Ausbeuten gezeigt.
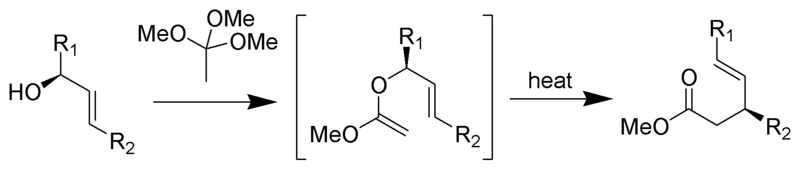
Mechanismus:
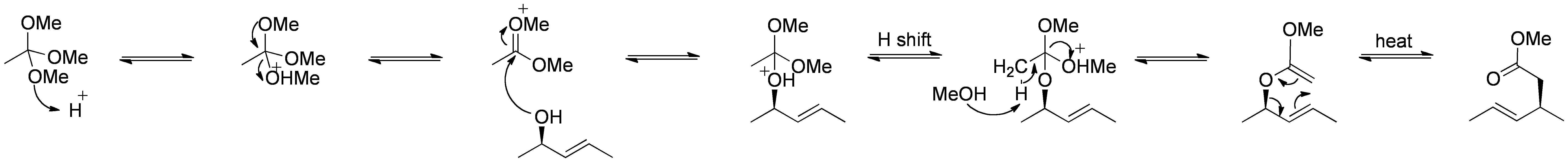
Von Selbst gemacht von RAN 10 (-) , über Wikimedia Commons
Photo-Claisen-Umlagerung
Die Photo-Claisen-Umlagerung ist eng verwandt mit der Photo-Fries-Umlagerung, die durch einen ähnlichen Radikalmechanismus abläuft. Arylether unterliegen der Photo-Claisen-Umlagerung, während die Photo-Fries-Umlagerung Arylester verwendet.
Hetero-Claisens
Aza-Claisen
Ein Iminium kann als eine der pi-gebundenen Einheiten in der Umlagerung dienen.
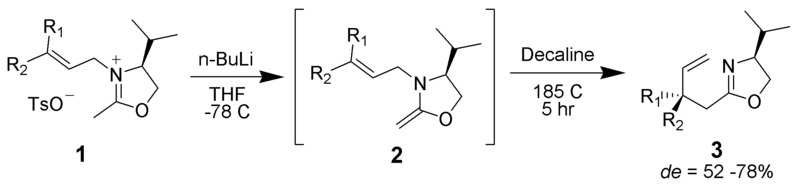
Von keinem maschinenlesbaren Autor zur Verfügung gestellt. ~ K angenommen (basierend auf Urheberrechtsansprüchen). , via Wikimedia Commons
Chromoxidation
Chrom kann Allylalkohole zu alpha-Beta-ungesättigten Ketonen auf der dem Alkohol gegenüberliegenden Seite der ungesättigten Bindung oxidieren. Dies geschieht über eine konzertierte Hetero-Claisen-Reaktion, obwohl es mechanistische Unterschiede gibt, da das Chromatom Zugang zu D-Schalen-Orbitalen hat, die die Reaktion unter einem weniger eingeschränkten Satz von Geometrien ermöglichen.
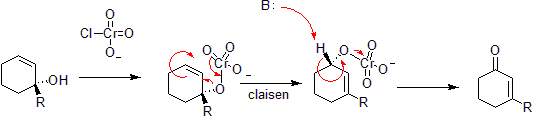
Durch den ursprünglichen Uploader wurde bei Englisch Wikipedia -Phosphorimidate Umlagerung oder Staudinger–Claisen-Reaktion installiert ein Phosphit anstelle eines Alkohols und nutzt die Staudinger-Reduktion, um diese in ein Imin umzuwandeln. Der nachfolgende Claisen wird dadurch angetrieben, dass eine P=O-Doppelbindung energetisch günstiger ist als eine P=N-Doppelbindung.
.png?revision=1&size=bestfit&width=660&height=112)
Von Howcheng bei en.wikipedia , über Wikimedia Commons
Overman-Umlagerung
Die Overman-Umlagerung (benannt nach Larry Overman) ist eine Claisen-Umlagerung von allylischen Trichloracetimidaten zu allylischen Trichloracetamiden.
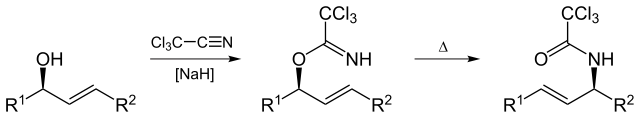
Von Yikrazuul (Eigene Arbeit) , über Wikimedia Commons
Overman-Umlagerung ist anwendbar auf die Synthese von Vicinol Diamino comp aus 1,2 vicinal allylic Diol.
Zwitterionische Claisen-Umlagerung
Im Gegensatz zu typischen Claisen-Umlagerungen, die erhitzt werden müssen, finden zwitterionische Claisen-Umlagerungen bei oder unter Raumtemperatur statt. Die Acylammoniumionen sind für Z-Enolate unter milden Bedingungen in hohem Grade selektiv
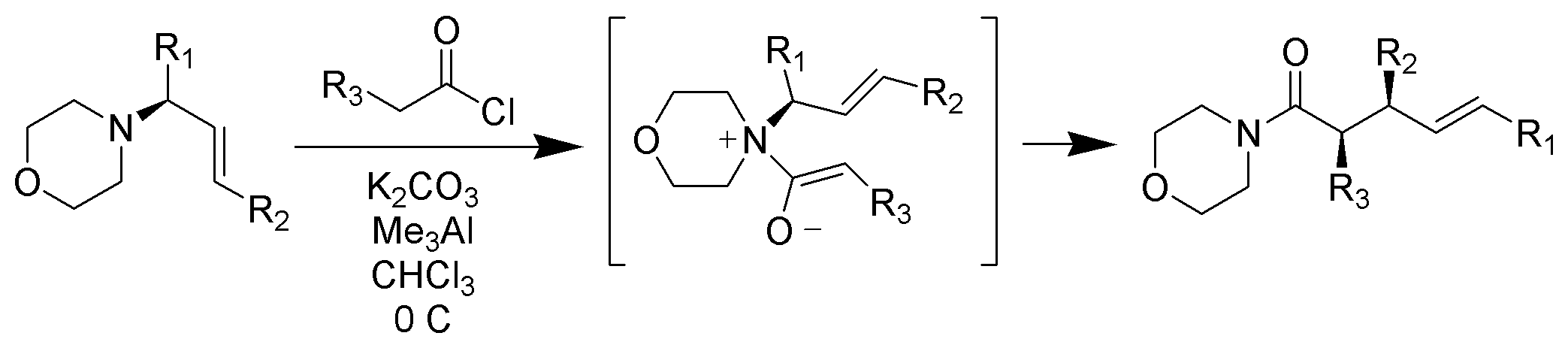
https://upload.wikimedia.org/wikiped…ent_Scheme.png
Claisen-Umlagerung in der Natur
Das Enzym Chorismat-Mutase (EC 5.4.99.5) katalysiert die Claisen-Umlagerung von Chorismat-Ionen zu Präphenat-Ionen, einem wichtigen Zwischenprodukt im Shikiminsäureweg (dem Biosyntheseweg zur Synthese von Phenylalanin und Tyrosin).
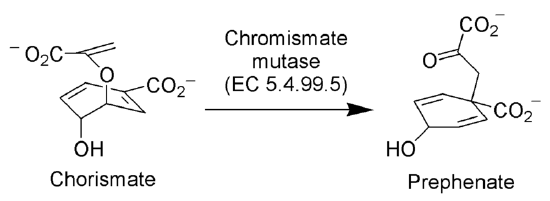
Von keinem maschinenlesbaren Autor zur Verfügung gestellt. ~ K angenommen (basierend auf Urheberrechtsansprüchen). , über Wikimedia Commons