Cytomegalovirus (CMV) -Infektion bei HIV / AIDS-Patienten und diagnostische Werte des CMV-DNA-Nachweises bei verschiedenen Probentypen
- Einführung
- Methoden
- Probanden
- Inklusion und Exklusion
- Reagenzien und Ausrüstung
- HIV-RNA-Quantifizierung
- CD4+ T-Lymphozytenzählung
- CMV-DNA-Quantifizierung
- CMV-Antikörpertest
- Studienmethoden
- Nukleinsäurenachweis
- Nachweis von T-Lymphozyten-Teilmengen
- Nachweis von Immunantikörpern
- Statistische Analyse
- Ergebnisse
- Allgemeine Daten
- Positive Raten von CMV-DNA, CMV-IgG und CMV-IgM
- Korrelation zwischen CMV-Infektion undCD4 + T-Lymphozytenzahl
- Nachweis von CMV-DNA in verschiedenen Proben
- Diskussion
- Schlussfolgerungen
- Danksagung
- Fußnote
Einführung
Cytomegalovirus (CMV) ist ein häufiges Herpesvirus, das in der gesamten menschlichen Bevölkerung weit verbreitet ist. Eine CMV-Infektion verursacht normalerweise keine Symptome und betrifft hauptsächlich die Speicheldrüsen, Nieren und andere Organe. Die Virusreplikation kann jedoch bei immungeschwächten Patienten auftreten und zur Schädigung von Organen und deren Funktionen beitragen. Opportunistische Infektionen sind häufiger und schwerer bei HIV / AIDS-Patienten. Eine CMV-Virusinfektion ist bei diesen Patienten häufig und kann mehrere Organe / Systeme betreffen, einschließlich Augen, Lunge, Nervensystem und Verdauungssystem. Viele Studien haben die virologischen und immunologischen Eigenschaften einer einfachen CMV-Infektion untersucht (1), insbesondere bei Frauen und Kindern. Die immunologischen Merkmale einer CMV-Infektion sind jedoch bei bereits immungeschwächten HIV / AIDS-Patienten ziemlich einzigartig. Es gibt Unterschiede in den klinischen Merkmalen, Behandlungsmaßnahmen und prognostischen Faktoren zwischen HIV-Patienten mit CMV-Infektion und solchen mit CMV-Infektion allein (2). Die Richtlinie von China empfahl, dass bei HIV / AIDS-Patienten mit Komplikationen (Retinitis, Pneumonie, CMV-Enzephalitis, Enteritis usw.) sofort eine antivirale Therapie von CMV und ART erforderlich ist.), wenn eine CMV-Infektion festgestellt wird. Aufgrund der Unspezifität der durch eine CMV-Infektion verursachten klinischen Symptome ist die Laboruntersuchung die Hauptgrundlage für die Diagnose einer CMV-Infektion. Die beiden am weitesten verbreiteten klinischen Methoden sind die CMV-Virusreplikation und serumimmunologische Methoden, einschließlich des Nachweises von CMV-IgG, CMV-IgM und CMV-Antigen PP65 (2) Bei Patienten mit eingeschränkter Immunfunktion ist die Produktion von CMV-Antikörpern geschwächt oder verzögert, was zu falsch negativen Ergebnissen führen und die Rate der versäumten Diagnose erhöhen kann. Daher ist der PCR-Nachweis von CMV-DNA weitgehend zur Standardmethode für die Diagnose einer CMV-Infektion und die Überwachung der Behandlung geworden (3). Daisuke Mizushima et al. es wurde berichtet, dass die Plasma-CMV-DNA-PCR einen wichtigen Wert für die Diagnose sowohl der CMV-Retinitis als auch aller CMV-EOD bei Patienten mit fortgeschrittener HIV-1-Infektion hat (4). Die CMV-DNA-PCR kann in einer Vielzahl von Probentypen wie Plasma, Urin, Liquor cerebrospinalis, Kammerwasser, Kot usw. nachgewiesen werden. (5). Allerdings haben nur wenige Artikel die Bedeutung und den Wert des CMV-DNA-PCR-Nachweises in anderen Proben als Plasma analysiert und diskutiert. In der vorliegenden Studie analysierten wir retrospektiv die Labortests (einschließlich CMV-DNA, CMV-Antikörper, CD4 + T-Lymphozytenzahl, HIV-Viruslast usw.) an 808 HIV / AIDS-Patienten, die von 2017 bis 2019 in unserem Zentrum behandelt wurden, um die CMV-Koinfektion und die Stärken und Schwächen verschiedener Nachweismethoden zu verstehen. Wir präsentieren den folgenden Artikel/ Fall gemäß der MDAR Reporting Checklist (verfügbar unter http://dx.doi.org/10.21037/apm-20-1352).
Methoden
Probanden
Insgesamt 808 HIV / AIDS-stationäre Patienten, die zwischen Januar 2017 und Oktober 2019 in unser Zentrum aufgenommen wurden, wurden eingeschrieben. HIV-RNA, CD4 + T-Lymphozytenzahl, CMV-DNA und verwandte Antikörper wurden bei jedem Patienten gemessen. Die Diagnose einer HIV-Infektion basierte auf den Richtlinien zur Diagnose und Behandlung von HIV / AIDS (dritte Ausgabe) (6), und alle Patienten wurden von den städtischen Zentren für Krankheitskontrolle (CDC) von Fuzhou oder der örtlichen CDC, die den Patienten behandelten, als HIV-Infektion bestätigt. Die Diagnose einer CMV-Infektion basierte auf den folgenden Kriterien: (I) CMV-DNA-positiv in Plasma, Alveolarspülung, Urin, Liquor cerebrospinalis (CSF) und / oder anderen Körperflüssigkeiten; (II) Serum CMV-Immunglobulin M (IgM) positiv; (III) eine ophthalmologische Diagnose einer CMV-Retinitis; (IV) CMV-Pneumonie, die sich hauptsächlich in Form von Fieber, Husten, Schleim und Engegefühl in der Brust manifestiert; CMV-DNA-positiv in Alveolarspülungsflüssigkeit; (V) CMV-Enteritis oder Ösophagitis, die sich hauptsächlich in Form von Dysphagie / Schluckschmerzen, Durchfall oder Bauchschmerzen und einer wirksamen diagnostischen Anti-CMV-Behandlung manifestiert; (VI) CMV-Enzephalitis, die sich als Symptome des Nervensystems und CMV-DNA-positiv in LIQUOR oder Hirngewebe manifestiert; (VII) CMV-Hepatitis, die sich als Fieber, abnormale Leberfunktion und positiv in der Leberbiopsie. Eine Diagnose einer CMV-Infektion wurde gestellt, wenn eines der oben genannten Kriterien außer Punkt (II) erfüllt war oder wenn Punkt (II) plus ein anderes Kriterium erfüllt war (7).
Alle in dieser Studie mit menschlichen Teilnehmern durchgeführten Verfahren entsprachen der Erklärung von Helsinki (in der 2013 überarbeiteten Fassung). Die Studie wurde von der medizinischen Ethikkommission unseres Zentrums genehmigt (Genehmigungs-Nr. KS2019-070-01). Die Daten sind anonym, daher wurde auf das Erfordernis der Einwilligung nach Aufklärung verzichtet.
Inklusion und Exklusion
Einschlusskriterien: patienten mit HIV / AIDS, die das Mengchao Hepatobiliary Hospital der Fujian Medical University zum ersten Mal besuchten und den Nachweis von HIV-RNA, CMV-DNA, CMV-IgG-Antikörper, CMV-IgM-Antikörper und CD4 + T-Lymphozyten innerhalb von 14 Tagen abgeschlossen haben. Schließen Sie HIV / AIDS-Fälle aus, die die oben genannten Testelemente aufgrund unzureichender Stichprobengröße nicht abschließen können.
Reagenzien und Ausrüstung
HIV-RNA-Quantifizierung
Fluoreszierende quantitative Echtzeit-Polymerase-Kettenreaktion (PCR) (FQ-PCR) wurde am QPCR-System Mx3000p (Agilent, USA) unter Verwendung des HIV-RNA-Quantifizierungskits der Firma QiaGen (Shenzhen, China) durchgeführt.
CD4+ T-Lymphozytenzählung
Als Instrument wurde das FACSCalibur-Durchflusszytometer (BD Biosciences, USA) und als Reagenzienkit BD Multitest CD3/CD4/CD8/CD45 (BD Biosciences, USA) verwendet.
CMV-DNA-Quantifizierung
FQ-PCR wurde am QPCR-System Mx3000p (Agilent, USA) durchgeführt, um die CMV-DNA-Spiegel in Plasma, Urin und LIQUOR nachzuweisen. Das verwendete Kit wurde von Sansure Biotech (Hunan, China) hergestellt.
CMV-Antikörpertest
Der Chemilumineszenz-Immunoassay wurde durchgeführt, um Anti-CMV-IgG- und IgM-Antikörper auf dem Cobas e601-Analysator (Roche Diagnostics, Deutschland) mit den unterstützenden Kits (Roche Diagnostics, Deutschland) nachzuweisen.
Studienmethoden
Nukleinsäurenachweis
Nachdem die HIV / AIDS-Patienten in unser Krankenhaus eingeliefert worden waren, wurden 3 ml nüchterne Ethylendiamintetraessigsäure (EDTA) -antikoagulierte Vollblutprobe entnommen und dann 5 Minuten lang bei 3.000 U / min zentrifugiert, um 200 µL Plasma für den HIV-RNA- und CMV-DNA-Nachweis zu gewinnen. Bei allen Patienten wurden morgens 5 ml Urinprobe entnommen und gründlich gemischt, und dann wurden 200 µL für den CMV-DNA-Nachweis geerntet. Bei Patienten mit neurologischen Symptomen wurde 1 ml Liquor zum CMV-DNA-Nachweis erhalten. Entsprechend der Nachweisgrenze und dem positiven Beurteilungsstandard des CMV-DNA-Kits und des HIV-RNA-Kits. Die Proben wurden als positiv angesehen, wenn der CMV-DNA-Wert über 400 Kopien / ml lag oder wenn der HIV-RNA-Spiegel über 500 Kopien / ml lag.
Nachweis von T-Lymphozyten-Teilmengen
Bei den HIV / AIDS-Patienten wurden bei Aufnahme 3 ml EDTA-antikoagulierte Nüchtern-Vollblutprobe entnommen und dann gründlich gemischt für den Nachweis von T-Lymphozyten-Teilmengen auf einem BD FACSCalibur-Durchflusszytometer unter Verwendung der Hilfsreagenzien.
Nachweis von Immunantikörpern
Bei den HIV / AIDS-Patienten wurden bei Aufnahme 3 ml Nüchternblutprobe entnommen, 5 Minuten lang bei 3.000 U / min in einem Serumröhrchen mit Gelseparator zentrifugiert und dann an der Maschine getestet.
Alle oben genannten Tests wurden streng in Übereinstimmung mit den Reagensanweisungen im Herstellerhandbuch und den Standardbetriebsverfahren der Instrumente durchgeführt.
Statistische Analyse
Die statistische Analyse wurde mit der Software SPSS 21.0 durchgeführt. Die normalverteilten Messdaten werden mit der mittleren ± Standardabweichung (x ± SD) dargestellt, und nicht normalverteilte Daten werden als Median (25-75 Perzentile) ausgedrückt. Die Zähldaten werden in Prozentsätzen und Raten ausgedrückt. Der Vergleich der nicht normalverteilten Messdaten zwischen zwei Gruppen wurde unter Verwendung eines nichtparametrischen Rangsummentests durchgeführt, während die Zähldaten unter Verwendung des Chi-Quadrat-Tests verglichen wurden. Ein P-Wert von <0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Allgemeine Daten
Die allgemeinen Daten von 808 HIV/AIDS-Patienten sind in Tabelle 1 zusammengefasst. Geschlecht und Alter zeigten keinen signifikanten Unterschied zwischen der CMV-Gruppe und der Nicht-CMV-Gruppe. Die absolute CD4-Zahl in der CMV-infizierten Gruppe war signifikant niedriger als in der CMV-nicht infizierten Gruppe (Z = -8,87, P< 0,001) und der HIV-RNA-Spiegel war in der CMV-infizierten Gruppe signifikant höher als in der nicht-CMV-infizierten Gruppe (Z= -3,207, P< 0,05) (Tabelle 1).
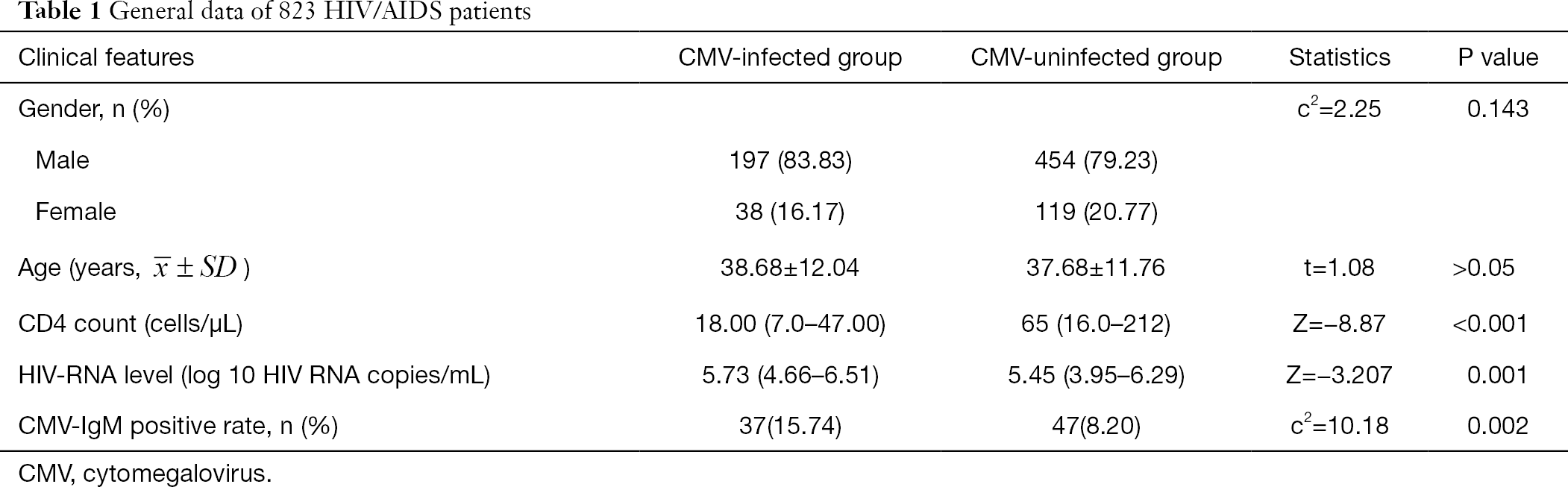
Vollständige Tabelle
Positive Raten von CMV-DNA, CMV-IgG und CMV-IgM
Die insgesamt positive Rate von CMV-DNA betrug 29,08% (235/808 ); insbesondere war es 5,70% (13/228) in CSF 26,01% (77/296) im Plasma und 25,75% (180/699) im Urin. Die positive Rate von CMV-IgG betrug 99,8% (806/808) und die positive Rate von CMV-IgM betrug 10,40% (84/808).
Korrelation zwischen CMV-Infektion undCD4 + T-Lymphozytenzahl
Nach Gruppierung der CD4 + T-Lymphozytenzahl stellten wir fest, dass der Anteil der mit Cytomegalovirus infizierten Patienten bei niedriger Häufigkeit von CD4 + T-Lymphozyten größer war als der von nicht-CMV-infizierten Patienten. Die Inzidenz einer CMV-Infektion nahm mit dem Rückgang der CD4-Zahl zu (Tabelle 2).
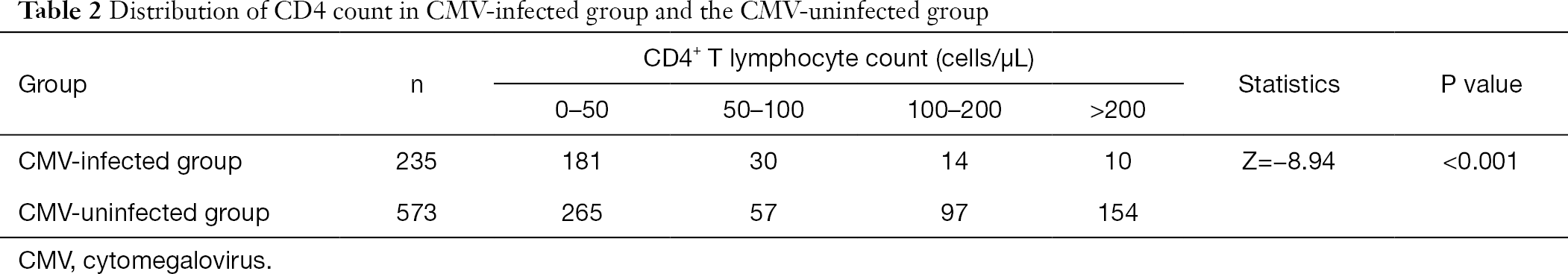
Vollständige Tabelle
Nachweis von CMV-DNA in verschiedenen Proben
Von diesen 808 Patienten erhielten 198 Patienten auch Tests auf Plasma und Urin -CMV-IgG- und CMV-IgM-Antikörper. Unter Verwendung der Chi-Quadrat-Analyse für gepaarte Daten führten wir paarweise Vergleiche von Urin-CMV-DNA und Plasma-CMV-DNA mit Plasma-CMV-IgM-Antikörper durch. Es wurde festgestellt, dass sich die Ergebnisse des Urin- und Plasma-CMV-DNA-Nachweises signifikant von denen des Plasma-CMV-IgG-Antikörpertests unterschieden (P < 0,001), während sich das Ergebnis des Plasma-CMV-DNA-Nachweises nicht signifikant von dem des Urin-CMV-DNA-Nachweises unterschied (P > 0,05) (Tabellen 3,4).

Vollständige Tabelle
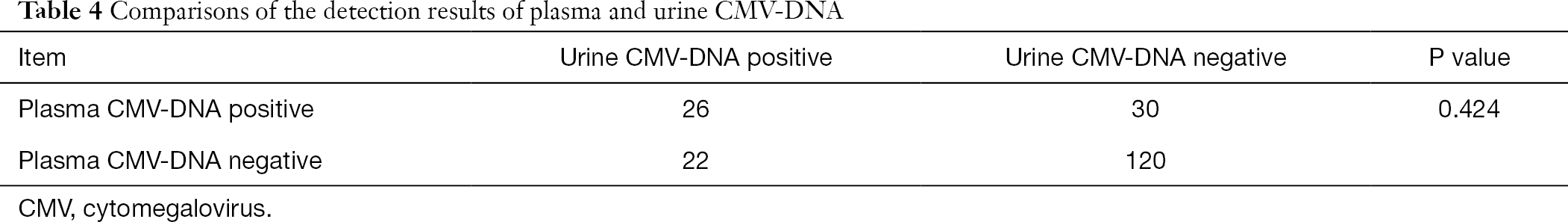
Vollständige Tabelle
Diskussion
CMV ist ein Mitglied der β-Herpes-Virus-Gruppe und zeichnet sich durch seine strenge Artspezifität und weit verbreitete Inzidenz in menschlichen Populationen aus. Die CMV-Seroprävalenz beträgt bei Kindern etwa 85% und bei Erwachsenen bis zu 95%. In unserer aktuellen Studie erreichte die positive Rate von CMV-IgG 99,8%. CMV ist in den meisten Fällen latent, aber bei immungeschwächten Personen repliziert sich das Virus exponentiell und breitet sich im ganzen Körper mit dem Blut aus, was CMV-Virämie und sogar organische CMV-Krankheit verursacht (8). Die CMV-Infektion ist eine der häufigsten opportunistischen Infektionen bei HIV / AIDS-Patienten. CD4 + T-Lymphozyten sind die Zielzellen des HIV-Virus, und ihre Zählungen können oft den Verlauf von AIDS widerspiegeln und können auch als Indikator für die Beurteilung des Immunstatus von AIDS-Patienten verwendet werden. Diese Studie analysierte die CMV-Infektion, die CD4-Anzahl und den HIV-RNA-Spiegel bei 808 Patienten mit HIV / AIDS. Wir fanden heraus, dass die positive CMV-Rate bei AIDS-Patienten mit der Abnahme der CD4-Zahl und mit der Zunahme der HIV-Viruslast zunahm. Auch in unserer aktuellen Studie hatten bis zu 77,02% der CMV-positiven Patienten eine CD4-Zahl von < 50 Zellen / µl, was darauf hindeutet, dass CD4 < 50 Zellen / µL ein Risikofaktor für eine HIV-CMV-Koinfektion ist, was mit dem Befund von Deng et al. (9). Das quantitative Niveau der HIV-RNA in der CMV-infizierten Gruppe war höher als in der CMV-nicht infizierten Gruppe, was indirekt darauf hindeutete, dass eine hohe HIV-RNA-Viruslast ein weiterer Risikofaktor für eine CMV-Infektion bei HIV / AIDS-Patienten war .Daher wird empfohlen, dass Patienten mit HIV / AIDS so bald wie möglich eine ART-Behandlung einleiten, um die Immunrekonstitution zu fördern und opportunistische Infektionen zu verhindern, und ein Screening auf HCMV ist für HIV / AIDS-Patienten mit einer CD4-Zahl von < 50 Zellen / µl unerlässlich (2).
Wir haben auch die Werte viraler Nukleinsäuretests und immunologischer Methoden beim klinischen Nachweis einer CMV-Infektion bewertet. Studien in China und international haben gezeigt, dass CMV-DNA früher auftritt als die klinischen Symptome und serologischen Reaktionen von CMV-Infektionen. Die FQ-PCR ist derzeit die genaueste und schnellste mikrobielle Quantifizierungsmethode und kann einige Probleme der herkömmlichen PCR (z. B. Kontamination des Amplifikationsprodukts und Nichtquantifizierung) überwinden (10). In unserer aktuellen Studie betrug die positive Rate der CMV-DNA 5.70% (13/228) in den Liquorproben von 228 Patienten mit neurologischen Symptomen, was viel niedriger war als in Plasma- und Urinproben, was durch die Blut-Hirn-Schranke und die Organanfälligkeit erklärt werden könnte. Der Anti-CMV-IgM-Antikörper wird häufig als Marker für eine aktive Virusinfektion verwendet; Die positive Rate des Anti-CMV-IgM-Antikörpers betrug jedoch bei unseren HIV / AIDS-Patienten nur 10,40% (84/808), was niedriger war als die positive Rate der CMV-Infektion, die in den Nicht-HIV / AIDS-Populationen berichtet wurde (11). Darüber hinaus stimmte seine positive Rate schlecht mit den Ergebnissen des Nukleinsäurenachweises überein, was auf das geschwächte Immunsystem oder auf die verzögerte Erzeugung von IgM-Antikörpern bei HIV / AIDS-Patienten zurückzuführen sein könnte. Daher spielt der Nachweis von CMV-IgM-Antikörpern eine begrenzte Rolle beim HCMV-Screening bei HIV / AIDS-Patienten. Darüber hinaus betrug die positive Rate der CMV-Infektion bei 808 Patienten in unserer aktuellen Studie 29,05% (235/808), was etwas höher ist als die von Li et al., und kann auf die größere Vielfalt von Proben (einschließlich Plasma, Urin und Liquor) zurückzuführen sein, die in dieser Studie gesammelt wurden (12). Die positive Rate der CMV-DNA betrug 25,57% im Urin und 26,01% im Plasma, der Unterschied war statistisch nicht signifikant. Daher empfehlen wir, das CMV-DNA-Screening in Plasma und Urin durchzuführen, wenn die CD4 + T-Lymphozytenzahl weniger als 200 Zellen / µl beträgt, insbesondere wenn < 50 Zellen / µl; Darüber hinaus ist der Nachweis von CMV-DNA im Liquor erforderlich, wenn offensichtliche neurologische Symptome vorliegen.
Schlussfolgerungen
Zusammenfassend sind eine niedrige CD4 + T-Lymphozytenzahl und eine hohe HIV-1-Viruslast Risikofaktoren für eine CMV-Infektion bei HIV / AIDS-Patienten. Der Nachweis von Urin- oder Plasma-CMV-DNA durch FQ-PCR ist sehr wertvoll beim Screening von CMV-Infektionen bei HIV / AIDS-Patienten, während der Nachweis von Blut-CMV-IgG- und CMV-IgM-Spiegeln hat einen begrenzten klinischen Wert. Blut- oder Urin-CMV-DNA-Screening wird für AIDS-Patienten empfohlen, um eine CMV-Infektion frühzeitig zu verhindern und zu diagnostizieren und ihre Lebensqualität zu verbessern.
Danksagung
Finanzierung: Gefördert durch das Key Clinical Specialty Discipline Construction Program von Fujian, P.R.C.
Fußnote
Berichts-Checkliste: Die Autoren haben die MDAR-Berichts-Checkliste ausgefüllt. Verfügbar unter http://dx.doi.org/10.21037/apm-20-1352
Data Sharing Statement: Verfügbar unter http://dx.doi.org/10.21037/apm-20-1352
Interessenkonflikte: Alle Autoren haben das ICMJE Uniform Disclosure Form ausgefüllt (verfügbar unter http://dx.doi.org/10.21037/apm-20-1352). Die Autoren haben keine Interessenkonflikte zu erklären.
Ethische Erklärung: Die Autoren sind für alle Aspekte der Arbeit verantwortlich, um sicherzustellen, dass Fragen im Zusammenhang mit der Genauigkeit oder Integrität eines Teils der Arbeit angemessen untersucht und gelöst werden. Alle in dieser Studie mit menschlichen Teilnehmern durchgeführten Verfahren entsprachen der Erklärung von Helsinki (in der 2013 überarbeiteten Fassung). Die Studie wurde von der medizinischen Ethikkommission unseres Zentrums genehmigt (Genehmigungs-Nr. KS2019-070-01). Die Daten sind anonym, daher wurde auf das Erfordernis der Einwilligung nach Aufklärung verzichtet.
Open-Access-Erklärung: Dies ist ein Open-Access-Artikel, der gemäß der Creative Commons Attribution-NonCommercial-NoDerivs 4.0 International License (CC BY-NC-ND 4.0), die die nichtkommerzielle Vervielfältigung und Verbreitung des Artikels unter der strikten Voraussetzung gestattet, dass keine Änderungen oder Bearbeitungen vorgenommen werden und das Originalwerk ordnungsgemäß zitiert wird (einschließlich Links sowohl zur formellen Veröffentlichung über das entsprechende DOI als auch zur Lizenz). Siehe: https://creativecommons.org/licenses/by-nc-nd/4.0/.
- Yu X, Tong M, He G. Auswirkungen der Cytomegalovirus-Infektion auf regulatorische Immunzellen bei schwangeren Frauen Chinesisch. Zeitschrift für Nosokomiologie. 2017;27:2103-6.
- Das Nationale Wissenschafts- und Technologie-Großprojekt AIDS opportunistische Infektionsforschungsgruppe während des 13. Expertenkonsens über die klinische Diagnose und Behandlung von AIDS kompliziert mit Cytomegalovirus-Krankheit . Zeitschrift der Southwest University (Naturwissenschaftliche Ausgabe): 1-17 .
- Hodowanec AC, Pikis A, Komatsu TE, et al. Behandlung und Prävention von CMV-Erkrankungen bei Transplantatempfängern: Aktuelles Wissen und Zukunftsperspektiven. J Clin Pharmacol 2019;59:784-98.
- Mizushima D, Nishijima T, Yashiro S, et al. Diagnostischer Nutzen der quantitativen Plasma-Cytomegalovirus-DNA-PCR für Cytomegalovirus-Endorganerkrankungen bei Patienten mit HIV-1-Infektion. J Erwerber Defic Syndr 2015;68:140-6.
- Michaelides A, Liolios L, Glare EM, et al. Eine erhöhte DNA-Belastung des humanen Cytomegalovirus (HCMV) in peripheren Blutleukozyten nach Lungentransplantation korreliert mit einer HCMV-Pneumonitis. Transplantation 2001;72:141-7.
- Die Infektion der Neurologie, AIDS-Gruppe der chinesischen Ärztekammer. HIV / AIDS Diagnose- und Behandlungsrichtlinien (dritte Ausgabe). Chinesische Zeitschrift für Infektionskrankheiten 2015; (10): 577-93.
- Corrales I, Giménez E, Solano C, et al. Inzidenz und Dynamik einer aktiven Cytomegalovirus-Infektion bei allogenen Stammzelltransplantationspatienten gemäß Einzelnukleotidpolymorphismen in Spender- und Empfängergenen CCR5, MCP-1, IL-10 und TLR9. J Med Virol 2015;87:248-55.
- Tagarro A, Del Valle R, Dominguez-Rodríguez S, et al. Wachstumsmuster bei Kindern mit angeborener Cytomegalovirus-Infektion. Pediatr Infizieren Dis J 2019;38:1230-5.
- Deng X, Liu J, Zhang M, et al. Analyse der virologischen und immunologischen Eigenschaften von HIV / AIDS in Kombination mit einer Cytomegalovirus-Infektion. Chinesisches Journal für Krankenhausinfektionen 2019; 29: 2241-6.
- Kawano Y, Kawada J, Kamya Y, et al. Analyse von zirkulierender humaner und viraler microRNA bei Patienten mit kongenitaler Cytomegalovirus-Infektion. J Perinatol 2016;36:1101-5.
- Li L, Gao S, Zhang T, et al. Vergleich des DNA-Nachweises und des IgM-Nachweises einer humanen Cytomegalovirus-Infektion und Diskussion ihres kombinierten Anwendungswerts. Chinesisches Journal für experimentelle Diagnostik 2015; (1): 78-80.
- Li X, Cao L, Yu C, et al. Studie zur Infektion des Cytomegalovirus bei AIDS-Patienten. Moderne Präventivmedizin 2012;39:2278-9.
( English Language Editor: J. Gray)